Exportación y modificación de poli(péptidos) de tipo lantibiótico.
Un método para producir, en una célula hospedadora, un polipéptido que contiene un puente tioéter,
cuyo origenno es una bacteria Gram-positiva, comprendiendo el procedimiento;
a) seleccionar una célula hospedadora que tenga una molécula de ácido nucleico que comprenda un primer y unsegundo fragmento de ácido nucleico que estén en la misma fase de lectura abierta, en la que
- el primer fragmento de ácido nucleico codifica un péptido líder de lantibiótico que es funcionalmenteequivalente a un péptido líder N-terminal encontrado en un prepéptido de un lantibiótico, y en el que estepéptido líder actúa como una secuencia señal de translocación y una señal de reconocimiento, de tal maneraque pueda producirse la formación de un puente tioéter;
- el segundo fragmento de ácido nucleico codifica un polipéptido deseado que comprende una secuencia amodificar en un puente tioéter, seleccionándose la secuencia del grupo de secuencias constituido por Ser-Xaan -Cys y Thr-Xaan-Cys, donde Xaa es un cualquier aminoácido y donde n es 1-13, y donde el polipéptidono tiene como origen una célula bacteriana Gram-positiva;
b) seleccionar la célula hospedadora para detectar la presencia de la proteína transportadora LanT;
c) traducir la molécula de ácido nucleico, produciendo de este modo un péptido de fusión del péptido líder delantibiótico y el polipéptido que comprende la secuencia seleccionada del grupo de secuencias constituido porSer-Xaan -Cys y Thr-Xaan-Cys, donde Xaa es cualquier aminoácido y donde n es 1-13; y
d) recoger el polipéptido que contiene el puente tioéter de un medio de la célula hospedadora.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2003/000389.
Solicitante: LanthioPep B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: Postbus 719 9700 AS Groningen PAISES BAJOS.
Inventor/es: KUIPERS, OSCAR PAUL, MOLL,GERT NIKOLAAS, LEENHOUTS,CORNELIS JOHANNES, DRIESSEN,ARNOLD JACOB MATHIEU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que contienen radicales sacárido; Sus derivados.
- C07K14/315 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Streptococcus (G), p. ej. Enterococci.
- C07K9/00 C07K […] › Péptidos de hasta 20 aminoácidos, que contienen radicales sacáridos y una secuencia totalmente determinada; Sus derivados.
- C12N5/06
- C12P21/02 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2444840_T3.pdf
Fragmento de la descripción:
Exportación y modificación de poli (péptidos) de tipo lantibiótico La invención se refiere al campo de los lantibióticos y al campo de las modificaciones post-traduccionales de (poli) péptidos.
Los lantibióticos forman un grupo de péptidos antibióticos únicos modificados post-traduccionalmente y sintetizados ribosomalmente producidos por, y que actúan principalmente sobre, bacterias Gram-positivas (para una revisión véase McAuliffe et al., FEMS Microbiol. Rev. 25: 285-308 (2001) . Dado que, por definición, contienen puentes tioéter intramoleculares o anillos formados por los aminoácidos con grupos tioéter, lantionina (Lan) y 3-metil lantionina (MeLan) y dado que todos son antibióticos peptídicos con actividad bactericida de moderada a fuerte, estos toman su nombre de estas propiedades más llamativas.
Los anillos tioéter protegen a los péptidos contra la degradación proteolítica. Por ejemplo, el lantibiótico nisina permanece activo después de tratamiento con tripsina. Los anillos tioéter son esenciales para algunas actividades de los lantibióticos. Por ejemplo, la apertura del anillo A o C en la nisina suprime la capacidad de permeabilización de la membrana. El anillo A de la nisina es necesario con respecto a su capacidad para autoinducir su propia síntesis y con respecto a la capacidad de la nisina para bloquear la síntesis del peptidoglucano interaccionando con el lípido II. Es esencial tener anillos tioéter y no puentes disulfuro dado que el reemplazo de anillos tioéter por puentes disulfuro conduce a la pérdida de actividad microbiana.
No deterioran el ambiente y no son tóxicos para los animales o el hombre y encuentran, o pueden encontrar, aplicaciones como bioconservantes en la preparación de alimentos y bebidas, pero también como agente bactericida 25 en productos cosméticos, veterinarios y médicos. Dado que el creciente número de microorganismos patógenos resistentes a fármacos múltiples ha creado la amenaza de otra “era preantibiótica” para muchas enfermedades bacterianas, se espera que los lantibióticos también puedan servir como un nuevo compuesto principal para remediar este problema alarmante. Principalmente por estas razones, en la década anterior, los lantibióticos han experimentado un notable aumento en actividades de investigación aplicada y básica, lo que conduce a un aumento extraordinario en cuanto al conocimiento acerca de sus propiedades estructurales y funcionales, sus mecanismos de acción y de los genes y componentes proteicos implicados en su biosíntesis y secreción. Por ejemplo, los lantibióticos se han convertido actualmente en objeto de proyectos de “modificación por ingeniería genética de proteínas”, con el objetivo de alterar, mediante mutagénesis dirigida a sitio, su actividad, estabilidad y espectro de células diana susceptibles. En la presente descripción se realiza un enfoque sobre los lantibióticos lineales (tipo A)
ya que hasta el momento se dispone de muy poca información específica acerca de los lantibióticos circulares (tipo B) .
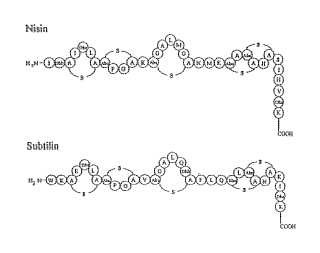
Los lantibióticos subtilina y nisina pertenecen a, y son representativos de, antibióticos peptídicos o lantibióticos de tipo A. Contienen los aminoácidos poco frecuentes deshidroalanina (Dha) , deshidrobutirina (Dhb) , meso-lantionina y 3-metillantionina, y los puentes tioéter característicos. La nisina es el lantibiótico más destacado y se usa como un conservante alimenticio debido a su alta fuerza contra determinadas bacterias Gram-positivas. Las cepas de Lactococcus lactis que pertenecen al grupo serológico N producen nisina. Las fuertes actividades bactericidas de la nisina, y de muchos otros lantibióticos, se basan en su capacidad para permeabilizar la membrana citoplasmática de bacterias diana. La degradación del potencial de membrana comienza por la formación de poros a través de los 45 cuales se liberan moléculas de bajo peso molecular. Además, la nisina inhibe la síntesis de la pared celular uniéndose al lípido II, un precursor de la síntesis del péptidoglucano, modula la actividad de enzimas autolíticas e inhibe el desarrollo de esporas (véase también Breukink y de Kruijf, Biochem. Biophys. Acta 1462:223-234, 1999) .
En muchos países la nisina se usa para impedir el desarrollo de clostridia en queso y en alimentos en conserva. La estructura peptídica de la nisina la describieron primera vez Gross y Morell (J. Am. Chem. Soc. 93:4634-4635, 1971) , y su gen estructural se aisló en 1988 (Buchmann et al., J. Biol. Chem. 263:16260-16266, 1988) . La nisina tiene dos variantes naturales, la nisina A y la nisina Z, que solo se diferencian en un resto de aminoácido en la posición 27 (la histidina en la nisina A se reemplaza por asparagina en la nisina Z) .
La subtilina la produce Bacillus subtilis ATCC 6633. Groos y Kiltz (Biochem. Biophys Res Commun 50: 559-565, 1973) desenmarañaron por primera vez su estructura y en 1988 se aisló su gen structural (Banerjee & Hansen, J. Biol. Chem. 263:9508-9514, 1988) . La subtilina comparte fuertes similitudes con la nisina con una idéntica organización de las estructuras en anillo de la lantionina (Fig. 1) , y ambos lantibióticos poseen similares actividades antibióticas.
Debido a su fácil análisis genético B. subtilis se convierte en un organismo modelo muy adecuado para la identificación y caracterización de genes y proteínas implicados en la biosíntesis de lantibióticos. La ruta mediante la cual se produce la nisina es muy similar a la de la subtilina, y las proteínas implicadas comparten homologías significativas sobre las proteínas completas (para una revisión véase también De Vos et al., Mol. Microbiol. 17:427
437, 1995) .
Otro lantibiótico bien conocido y estudiado, producido por Staphylococcus epidermis 5, es Pep 5, que contiene tres estructuras en anillo (una MeLan y dos Lan) , un resto oxobutirilo N-terminal, y dos restos Dhb (Kellner et al., Angew. Chemie Int. Ed. Engl. 28:616-619, 1989) .
Los genes respectivos que actúan postraduccionalmente se han identificado adyacentes a genes los estructurales, y juntos se organizan en estructuras de tipo operón (Fig. 2) . Se piensa que estos genes son responsables de la modificación postraduccional, del transporte del prepéptido modificado, de la escisión proteolítica y de la inmunidad que impide efectos tóxicos sobre la bacteria productora. Además de esto, la biosíntesis de la subtilina y de la nisina está fuertemente regulada por un sistema regulador de dos componentes que consiste en una histidina quinasa y una proteína reguladora de respuestas.
De acuerdo con un modelo presente (Fig. 3) se supone que una señal dependiente de la fase de crecimiento extracelular puede activar la histidina quinasa localizada en la membrana. La naturaleza de esta señal puede ser diferente para la biosíntesis de la subtilina y de la nisina. Mientras que en la biosíntesis de la nisina, la propia nisina tiene una función inductora, en la biosíntesis de la subtilina se mostró que esta biosíntesis era dependiente de esporulación.
De acuerdo con el modelo, después de su auto-fosforilación, la histidina quinasa Spak y Nnisk transfiere el resto fosfato al regulador de respuestas que a su vez activa los genes necesarios para la biosíntesis de la subtilina y de la nisina. Por lo tanto, el prepéptido se modifica en un complejo de modificación localizado en la membrana (lantionina sintetasa) que consiste en las proteínas SpaB/SpaC y NisB/NisC intracelulares, respectivamente. De acuerdo con el modelo, estas proteínas también están asociadas con el transportador SpaT y NisT, respectivamente.
Como en cualquier lantibiótico, la molécula de presubtilina o prenisina consta de un segmento líder y un segmento maduro, y se piensa que el segmento líder desempeña diversas funciones en la ruta biosintética. Se piensa que no es sólo una secuencia señal de translocación, sino que proporciona señales de reconocimiento para las enzimas de modificación y para suprimir la actividad antimicrobiana hasta que el péptido maduro se libere de la célula. Como también suponen Qiao y Saris, (Fems Microbiol. Let. 144:89-93 (1996) , el prepéptido modificado es, en el caso de algunos lantibióticos, escindido proteolíticamente después de su transporte a través de la membrana celular, pero en el caso de otros lantibióticos la escisión del líder a partir del péptido modificado se produce dentro de la célula antes de la secreción. En el caso de la nisina, la escisión la realiza NisP, mientras que en el caso de la subtilina no se ha encontrado ninguna proteasa específica dentro de la estructura de tipo operón. Sin embargo, B. subtilis es rica en proteasas extracelulares y posiblemente la subtilisina, que también... [Seguir leyendo]
Reivindicaciones:
1. Un método para producir, en una célula hospedadora, un polipéptido que contiene un puente tioéter, cuyo origen no es una bacteria Gram-positiva, comprendiendo el procedimiento;
a) seleccionar una célula hospedadora que tenga una molécula de ácido nucleico que comprenda un primer y un segundo fragmento de ácido nucleico que estén en la misma fase de lectura abierta, en la que
-el primer fragmento de ácido nucleico codifica un péptido líder de lantibiótico que es funcionalmente equivalente a un péptido líder N-terminal encontrado en un prepéptido de un lantibiótico, y en el que este péptido líder actúa como una secuencia señal de translocación y una señal de reconocimiento, de tal manera que pueda producirse la formación de un puente tioéter; -el segundo fragmento de ácido nucleico codifica un polipéptido deseado que comprende una secuencia a modificar en un puente tioéter, seleccionándose la secuencia del grupo de secuencias constituido por Ser
Xaan -Cys y Thr-Xaan-Cys, donde Xaa es un cualquier aminoácido y donde n es 1-13, y donde el polipéptido no tiene como origen una célula bacteriana Gram-positiva;
b) seleccionar la célula hospedadora para detectar la presencia de la proteína transportadora LanT; c) traducir la molécula de ácido nucleico, produciendo de este modo un péptido de fusión del péptido líder de lantibiótico y el polipéptido que comprende la secuencia seleccionada del grupo de secuencias constituido por Ser-Xaan -Cys y Thr-Xaan-Cys, donde Xaa es cualquier aminoácido y donde n es 1-13; y d) recoger el polipéptido que contiene el puente tioéter de un medio de la célula hospedadora.
2. Un método de acuerdo con la reivindicación 1, que adicionalmente comprende recoger dicho polipéptido deseado 25 después de detectar la presencia de dicho péptido líder en el medio de cultivo de dicha célula.
3. Un método de acuerdo con la reivindicación 1 o 2 donde dicho polipéptido deseado es de origen esencialmente eucariota o viral.
4. Un método de acuerdo con la reivindicación 1 o 2 donde dicho polipéptido se selecciona del grupo constituido por polipéptidos con SEC ID Nº: 1 a 249 como se indica en la tabla 1A.
5. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 4 donde dicho péptido líder se selecciona
del grupo constituido por péptidos líder con SEC ID Nº: 250 a 280 como se indica en la tabla 1B. 35
6. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 5 donde dicha célula hospedadora es una célula procariota Gram-negativa o eucariota.
7. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 6 donde dicho (poli) péptido que no ha sufrido modificación postraduccional intracelular comprende la deshidratación de una serina o una treonina y/o formación de un puente tioéter.
8. Un método que permite la modificación de un polipéptido deseado producido por una célula hospedadora recombinante, comprendiendo dicho método las etapas a, b, c y d de la reivindicación 1 y comprendiendo
adicionalmente seleccionar dicha célula hospedadora para detectar la presencia de una enzima capaz de proporcionar modificación postraduccional.
9. Un método de acuerdo con la reivindicación 8 que permite la modificación extracelular de dicho (poli) péptido deseado comprendiendo adicionalmente dicho método seleccionar dicha célula hospedadora para detectar la presencia de una enzima esencialmente extracelular capaz de proporcionar modificación postraduccional.
10. Un método de acuerdo con la reivindicación 8 o 9 donde dicha enzima es capaz de deshidratar una serina o una treonina.
11. Un método de acuerdo con la reivindicación 8 o 9 donde dicha enzima es capaz de proporcionar la formación de un puente tioéter.
12. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 11 donde dicho (poli) péptido deseado es de origen esencialmente eucariota o viral.
13. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 11 donde dicho polipéptido se selecciona del grupo constituido por polipéptidos con SEC ID Nº: 1 a 249.
14. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 13 donde dicho péptido líder se selecciona 65 del grupo constituido por péptidos líder con SEC ID Nº: 250 a 280.
15. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 14 donde dicha modificación comprende la deshidratación de una serina o una treonina y/o la formación de un puente tioéter.
16. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 15 donde dicha célula hospedadora es 5 una célula procariota Gram-negativa o una célula eucariota.
17. Un método de acuerdo con una cualquiera de las reivindicaciones 8 a 16 donde dicho polipéptido que no ha sufrido modificación postraduccional intracelular comprende la deshidratación de una serina o una treonina y/o la formación de un puente tioéter.
18. Un método para la producción de un polipéptido de origen no lantibiótico que comprende deshidroalaninas y/o restos de ácido deshidrobutírico que comprende:
a) seleccionar una célula hospedadora que tenga una molécula de ácido nucleico que comprenda un primer y un 15 segundo fragmento de ácido nucleico que estén en la misma fase de lectura abierta, donde
-el primer fragmento de ácido nucleico codifica un péptido líder de lantibiótico que es funcionalmente equivalente a un péptido líder N-terminal encontrado en un prepéptido de un lantibiótico y donde este péptido líder actúa como una secuencia señal de translocación y una señal de reconocimiento, de tal manera que
pueda producirse la formación de un puente tioéter; -el segundo fragmento de ácido nucleico codifica un polipéptido deseado que comprende una secuencia a modificar en un puente tioéter, seleccionándose la secuencia del grupo de secuencias que consiste en Ser-Xaan -Cys y Thr-Xaan-Cys, donde Xaa es cualquier aminoácido y donde n es 1-13; y donde el polipéptido no tiene como origen una célula bacteriana Gram-positiva;
-y una molécula de ácido nucleico que codifica LanB o la parte N-terminal de LanM y opcionalmente una molécula de ácido nucleico que codifica LanT;
b) permitir la traducción de dichas moléculas de ácido nucleico; y c) opcionalmente someter a lisis dichas células hospedadoras; y 30 d) recoger dicho polipéptido deseado.
19. Una célula hospedadora que comprende una molécula de ácido nucleico recombinante que comprende un primer y un segundo fragmento de ácido nucleico que están en la misma fase de lectura abierta, donde -el primer fragmento de ácido nucleico codifica un péptido líder de lantibiótico que es funcionalmente equivalente a un péptido líder N-terminal encontrado en un prepéptido de un lantibiótico y donde este péptido líder actúa como una secuencia señal de translocación y una señal de reconocimiento, de tal manera que puede producirse la formación de un puente tioéter; -el segundo fragmento de ácido nucleico codifica un polipéptido deseado que comprende una secuencia a modificar en un puente tioéter, seleccionándose la secuencia del grupo de secuencias que consiste en Ser-Xaan -Cys y Thr-Xaan-Cys, donde Xaa es cualquier aminoácido donde n es 1-13; y donde el polipéptido no tiene como origen una célula bacteriana Gram-positiva;
20. Una célula hospedadora de acuerdo con la reivindicación 19 donde dicho polipéptido deseado es de origen 45 esencialmente eucariota o viral.
21. Una célula hospedadora de acuerdo con la reivindicación 20 donde dicho (poli) péptido se selecciona del grupo que consiste en polipéptidos con SEC ID Nº: 1 a 249.
22. Una célula hospedadora de acuerdo con cualquiera de las reivindicaciones 19 a 21 donde dicho péptido líder se selecciona del grupo que consiste en péptidos líder con SEC ID Nº: 250 a 280.
23. Una célula hospedadora de acuerdo con cualquiera de las reivindicaciones 19 a 22, siendo dicha célula hospedadora una célula procariota Gram-negativa o una célula eucariota. 55
24. Una célula hospedadora de acuerdo con una cualquiera de las reivindicaciones 19 a 23 provista de una proteína LanT y no provista de una proteína LanB.
25. Una célula hospedadora de acuerdo con una cualquiera de las reivindicaciones 19 a 23 provista de una proteína 60 LanT y no provista de una proteína LanC.
26. Una célula hospedadora de acuerdo con la reivindicación 25 provista con una LanB.
27. Una célula hospedadora de acuerdo con la reivindicación 23 provista con una proteína LanT, LanB, LanC y/o 65 LanM.
28. Una molécula de ácido nucleico que comprende un primer y un segundo fragmento de ácido nucleico que están en la misma fase de lectura abierta, donde
-el primer fragmento de ácido nucleico codifica un péptido líder de lantibiótico que es funcionalmente equivalente
a un péptido líder N-terminal encontrado en un prepéptido de un lantibiótico y donde este péptido líder actúa como una secuencia señal de translocación y una señal de reconocimiento, de tal manera que puede producirse la formación de un puente tioéter; -el segundo fragmento de ácido nucleico codifica un polipéptido deseado que comprende una secuencia a modificar en un puente tioéter, seleccionándose la secuencia del grupo de secuencias que consiste en Ser-Xaan Cys y Thr-Xaan-Cys, donde Xaa es cualquier aminoácido y donde n es 1-13; -en el que dicho polipéptido es de origen eucariota o viral.
29. Un ácido nucleico de acuerdo con la reivindicación 28 donde dicho (poli) péptido se selecciona del grupo que consiste en polipéptidos con SEC ID Nº: 1 a 249. 15
30. Un ácido nucleico de acuerdo con la reivindicación 28 o 29, donde dicho péptido líder se selecciona del grupo que consiste en péptidos líder con SEC ID Nº: 250 a 280.
Patentes similares o relacionadas:
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Métodos para aumentar la producción de células madre hematopoyéticas y plaquetas, del 22 de Enero de 2020, de Janssen Pharmaceuticals, Inc: Una composición farmacéutica para su uso en un método de (i) proporcionar células madre hematopoyéticas a un sujeto; (ii) reducir el tiempo de injerto […]
Dispositivos de filtración de flujo tangencial y métodos para el enriquecimiento de leucocitos, del 4 de Septiembre de 2019, de NORTHWEST BIOTHERAPEUTICS, INC.: Un dispositivo de filtración de flujo tangencial para la preparación de una población de células enriquecida en leucocitos, eliminando de forma selectiva […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Sistema automatizado de ingeniería de tejidos, del 22 de Mayo de 2019, de Octane Biotech Inc: Un método para (a) la proliferación automatizada de células autólogas, alogénicas o xenogénicas para uso en procedimientos de ingeniería de tejidos, […]
Métodos para conservar órganos y tejidos, del 15 de Abril de 2019, de DYAX CORP.: Composición para conservar y/o almacenar un órgano, comprendiendo la composición una disolución de conservación de órganos ex vivo fisiológicamente aceptable y un […]
Péptidos largos de 22-45 residuos de aminoácidos que inducen y/o mejoran las respuestas inmunológicas específicas para antígenos, del 27 de Febrero de 2019, de ACADEMISCH ZIEKENHUIS LEIDEN: Uso de un peptido que consiste en una secuencia de aminoacido, que cubre la region de la posicion de aminoacidos 127-158 de la proteina E6 de VPH16 para la fabricacion de un […]