Procedimiento para diagnosticar diferencialmente demencias.
Un procedimiento ex vivo para diagnosticar diferencialmente demencias vasculares,
que comprende la etapa dedeterminar en un fluido corporal obtenido de un paciente al menos una concentración relativa seleccionada del grupoque consiste en
- la relación de la concentración absoluta de Aß1-38 con respecto a la concentración de ß amiloide total(Aß1-38 %),
- la relación de la concentración absoluta de Aß1-38 con respecto a la concentración absoluta de especiesde ß amiloide Aß1-40 (Aß1-38/Aß1-40), y
- la relación de la concentración absoluta de Aß1-38 con respecto a la concentración absoluta de especiesde ß amiloide Aß1-42 (Aß1-38/Aß1-42).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/009974.
Solicitante: Friedrich-Alexander-Universität Erlangen-Nürnberg.
Nacionalidad solicitante: Alemania.
Dirección: Schlossplatz 4 91054 Erlangen ALEMANIA.
Inventor/es: WILTFANG, JENS, DR., BIBL,MIRKO, MOLLENHAUER,BRIT, ESSELMANN,HERMANN, LEWCZUK,PIOTR, KORNHUBER,JOHANNES.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2441253_T3.pdf
Fragmento de la descripción:
Procedimiento para diagnosticar diferencialmente demencias
Campo de la invención La invención se refiere a un procedimiento ex vivo para diagnosticar diferencialmente demencias que comprende las características del preámbulo de la reivindicación 1 independiente. Particularmente, la presente invención se refiere a un procedimiento tal que es adecuado para discriminar demencias vasculares y/o degeneraciones del lóbulo frontotemporal de demencias relevantes del diagnóstico diferencial, tales como enfermedad de Alzheimer, y trastornos demenciales, tales como depresión. La invención también se refiere a diferenciar entre demencias vasculares y degeneraciones del lóbulo frontotemporal. Además, la invención se refiere a un uso de ciertos componentes en diagnosticar diferencialmente demencias según el preámbulo de la reivindicación 15 independiente.
Abreviaturas usadas En esta descripción se usan las siguientes abreviaturas: péptidos Aº = péptidos beta amiloides; Aº-SDSPAGE/inmunotransferencia = electroforesis en gel de dodecilsulfato de sodio-poliacrilamida de amiloide beta con inmunotransferencia Western; EA = enfermedad de Alzheimer; PPA = proteína precursora de beta-amiloide; cámara CCD = cámara con dispositivo de carga acoplada; LCR = líquido cefalorraquídeo; CD = control depresivo; DGN = Deutsche Gesellschaft für Neurologie; DFT = demencia frontotemporal; DLFT = degeneración del lóbulo frontotemporal; MMSE = miniexamen del estado mental; NINCDS-ADRDA = Instituto Nacional de Trastornos Neurológicos y de la Comunicación y Accidente cerebrovascular-Asociación de la Enfermedad de Alzheimer y Trastornos relacionados; SDS = dodecilsulfato de sodio; %T = porcentaje de acrilamida; DV = demencia vascular.
Técnica anterior
El diagnóstico diferencial entre las dos formas más comunes de demencias, la enfermedad de Alzheimer (EA) y las demencias vasculares (DV) , es crucial, ya que influye en la estrategia terapéutica. Hasta ahora, los diagnósticos de demencia neuroquímicos basados en LCR multiparamétricos (LCR-DDN) pueden respaldar el diagnóstico diferencial de EA y DV midiendo Aº1-42, tau total y fosfo-tau.
Van Oijen y col., 2006, informaron que los péptidos Aº en plasma pueden tener valor diagnóstico en EA incipiente.
Gurol y col., 2006, informaron que la concentración en plasma de las especies de péptidos Aº Aº1-40 mostraron relación con la carga de lesiones vasculares en deterioro cognitivo leve, EA y angiopatía amiloide cerebral. Particularmente, se ha encontrado que la concentración en plasma de Aº1-40 se asocia a lesiones de la sustancia blanca cerebral independientemente de posibles factores de confusión.
Un quinteto de especies de péptidos Aº, es decir, Aº 1-37/38/39/40/42, se ha caracterizado como constituyentes regulares de LCR humano (Wiltfang y col., 2002; Lewczuk y col., 2004) .
Kapaki y col., 2003, desvelaron el uso de concentraciones de proteína tau y Aº1-42 medidas en líquido cefalorraquídeo (LCR) en diagnóstico de enfermedad de Alzheimer. Particularmente, proponen una relación de tau/Aº1-42 como criterio clínico para distinguir EA de DV en el diagnóstico de demencia.
En seres humanos por debajo de la edad de 65 años, la DLFT es la segunda causa más común de demencia después de la enfermedad de Alzheimer.
La EA es una enfermedad degenerativa progresiva del cerebro que produce deterioro de la memoria y demencia manifestada por confusión, desorientación visuoespacial, incapacidad para calcular, deterioro del criterio, trastornos del pensamiento y alucinaciones. Esta enfermedad cerebral degenerativa más común constituye el 70 % de todos los casos de demencia en seres humanos. La aparición es normalmente en la edad madura tardía, y la muerte normalmente se produce en 5 a 10 años.
El grupo heterogéneo de DLFT y EA comparten rasgos neuroquímicos y clínicos, aunque el aspecto temporal de los síntomas durante la evolución de la enfermedad y hallazgos neuropatológicos se diferencian sorprendentemente entre estos dos síndromes de demencia.
La deposición extracelular de péptidos beta amiloides (Aº) agregados, principalmente Aº1-42 total, como placas de amiloide es un distintivo neuropatológico de enfermedad de Alzheimer (Glenner y Wong, 1984) , mientras que las placas de amiloide se encuentran raramente en DLFT (Arnold y col., 2000) . Los niveles de Aº1-42 en fluidos corporales tales como líquido cefalorraquídeo (LCR) son significativamente reducidos en EA y a un menor grado en DLFT (Hulstaert y col., 1999) .
Los péptidos Aº se derivan de una proteína precursora de amiloide (PPA) transmembrana, después de la escisión por dos enzimas, - y -secretasa (Haas y Selkoe, 1993) . A consiste predominantemente de A 1-38, A 1-40 y A 1-42. Se supone que las distintas actividades de -secretasa son responsables de la generación de tanto péptidos A truncados del extremo carboxi (truncados en Ct) como alargados (alargados en Ct) como se refiere a A 1-40 (Citron y col., 1984) . Así, puede asumirse que la medición de las diferentes especies de péptidos A en fluidos corporales representa más adecuadamente cambios específicos de enfermedad del metabolismo de PPA en vez de los simples niveles de A 1-42 absolutos (Wiltfang y col., 2001, Bibl y col., 2006) .
Hasta la fecha se han documentado tres conjuntos de criterios clínicos para el diagnóstico diferencial de DLFT. El conjunto de criterios más reciente se sugirió por McKhann y colaboradores (McKhann y col., 2001) , principalmente como una ayuda al diagnóstico clínico rutinario. Los criterios clínicos de Near y y colaboradores (Near y y col., 1998) son más útiles cuando se basan en los tres subtipos prototípicos de DLFT, demencia frontotemporal (DFT) , afasia progresiva primaria (APP) y demencia semántica (DS) . Sin embargo, el diagnóstico clínico frecuentemente sigue siendo crucial en un caso determinado y biomarcadores para pruebas de diagnóstico aplicables están todavía en intensa investigación. La constelación de A 1-42 reducidos en fluidos corporales, acompañado de una elevación de niveles de proteína tau, puede encontrarse en tanto DFT como EA (Blennow, 2004) . Hasta la fecha se han publicado datos incoherentes sobre el rendimiento de estas proteínas como biomarcador aplicable para el diagnóstico diferencial de DFT y EA (Sjögren y col., 2000; Riemenschneider y col., 2002) . El diagnóstico clínico de enfermedades neurodegenerativas es todavía muy difícil, específicamente con respecto a la diferenciación de EA de DFT y DFT de APP.
Se ha sugerido que las formas de A pueden usarse conjuntamente con diagnóstico clínico para respaldar un diagnóstico diferencial. Los biomarcadores para ayudar en el diagnóstico clínico, tales como beta amiloide 1-42 (A 142) , tau y tau fosforilada se han investigado sistemáticamente en DFT, pero no en APP.
Problema de la invención Es el problema de la presente invención proporcionar un procedimiento ex vivo para diagnosticar diferencialmente demencias vasculares, que muestre buena sensibilidad y especificidad de manera que permita particularmente discriminar demencias vasculares de degeneraciones del lóbulo frontotemporal u otros tipos de demencia como, por ejemplo, enfermedad de Alzheimer.
Solución El problema de la invención se resuelve mediante un procedimiento que comprende las características de la reivindicación 1 independiente. Realizaciones preferidas de este nuevo procedimiento se definen en las reivindicaciones 1 a 7 dependientes. La reivindicación 8 se refiere al uso de ciertos componentes en el nuevo procedimiento. Las reivindicaciones 9 a 15 dependientes definen realizaciones preferidas del nuevo uso.
Descripción de la invención Los inventores encontraron el mismo quinteto de especies de péptidos A , es decir, A 1-37/38/39/40/42, que se han caracterizado como constituyentes regulares de LCR humano antes (Wiltfang y col., 2002; Lewczuk y col., 2004) , en plasma. Sin embargo, los péptidos A en plasma se caracterizaron por otras especies truncadas en el extremo amino A 2-40. La última especie de péptidos no puede diferenciarse de A 1-40 por los procedimientos de ELISA actualmente disponibles.
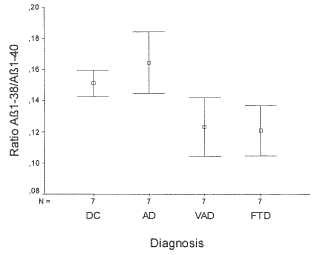
Adicionalmente y sorprendentemente, los inventores encontraron que las concentraciones en plasma de las especies de péptidos A individuales muestran variaciones características en caso de demencia vascular y degeneraciones del lóbulo frontotemporal.
Particularmente, en caso de demencias vasculares, además de un aumento de A 1-40, las concentraciones de A 137, A 1-38, A 1-39, A 1-42 y A 2-40 disminuyen. La disminución de estas especies de péptidos A es característica de demencias vasculares porque no se muestra con otros trastornos demenciales... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento ex vivo para diagnosticar diferencialmente demencias vasculares, que comprende la etapa de determinar en un fluido corporal obtenido de un paciente al menos una concentración relativa seleccionada del grupo que consiste en
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración de amiloide total (A 1-38 %) ,
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de especies de amiloide A 1-40 (A 1-38/A 1-40) , y
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de especies de amiloide A 1-42 (A 1-38/A 1-42) .
2. El procedimiento de la reivindicación 1, en el que dicho fluido corporal es una muestra de sangre.
3. El procedimiento de la reivindicación 2, en el que dicha muestra de sangre es una muestra de plasma sanguíneo.
4. El procedimiento de cualquiera de las reivindicaciones 1 a 3, que comprende además la etapa de enriquecer péptidos amiloides del fluido corporal usando un anticuerpo para péptido amiloide.
5. El procedimiento de cualquiera de las reivindicaciones 1 a 4, en el que dicha concentración relativa de A 1-38 seleccionada del grupo que consiste en
- A 1-38 %, y
- A 1-38/A 1-40,
siendo superior a un valor umbral es indicativa de ausencia de demencia vascular en el paciente.
6. El procedimiento de cualquiera de las reivindicaciones 1 a 4, en el que
- siendo A 1-38 % inferior a un valor umbral o siendo A 1-38/A 1-40 inferior a un valor umbral, y
- siendo la concentración absoluta de A 1-38 superior a un valor umbral, o siendo A 1-38/A 1-42 superior a un valor umbral, o siendo la relación de la concentración absoluta de A 1-40 con respecto a la concentración absoluta de especies de amiloide A 1-42 (A 1-40/A 1-42) superior a un valor umbral, o siendo la relación de la concentración absoluta de A 1-42 con respecto a la concentración total de amiloide (A 1-42 %) inferior a un valor umbral, es indicativo de demencia vascular en el paciente.
7. El procedimiento de cualquiera de las reivindicaciones 1 a 4, en el que
- A 1-38/A 1-42 siendo superior a un valor umbral, y
- siendo A 1-40 % superior a un valor umbral, o siendo A 1-42 % inferior a un valor umbral, o siendo A 140/A 1-42 superior a un valor umbral, o siendo la concentración absoluta de A 1-40 superior a un valor umbral, o siendo la concentración total de amiloide superior a un valor umbral, es indicativo de demencia vascular en el paciente.
8. Uso de componentes para determinar la concentración de A 1-38 en un fluido corporal para el diagnóstico diferencial ex vivo de demencias vasculares.
9. El uso según la reivindicación 8, en el que dichos componentes para determinar la concentración de A 1-38 son anticuerpos.
10. El uso según la reivindicación 8 o 9, que comprende además el uso de un anticuerpo para péptidos amiloides para enriquecer péptidos amiloides a partir del fluido corporal.
11. El uso según una cualquiera de las reivindicaciones 8 a 10, en el que dichos componentes para determinar la concentración de A 1-38 permiten determinar la concentración de A 1-38 como una concentración relativa.
12. El uso según una cualquiera de las reivindicaciones 8 a 11, en el que dichos componentes para determinar la concentración de A 1-38 permiten determinar al menos un concentración relativa de A 1-38 seleccionada del grupo que consiste en
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración de péptido amiloide total en el fluido corporal (A 1-38 %) ,
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de las especies de péptido amiloide A 1-40 en el fluido corporal (A 1-38/A 1-40) , y
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de las especies de péptido amiloide A 1-42 en el fluido corporal (A 1-38/A 1-42) .
13. El uso según cualquiera de las reivindicaciones 8 a 12, que comprende el uso de componentes para determinar al menos una concentración adicional seleccionada del grupo que consiste en:
- la concentración absoluta de A 1-38,
- la concentración absoluta de A 1-40,
- la relación de la concentración absoluta de A 1-40 con respecto a la concentración total de amiloide (A 1-40 %) ,
- la relación de la concentración absoluta de A 1-40 con respecto a la concentración absoluta de especies de amiloide A 1-42 (A 1-40/A 1-42) ,
- la concentración absoluta de A 1-42,
- la relación de la concentración absoluta de A 1-42 con respecto a la concentración total de amiloide (A 1-42 %) , y
- la concentración total de amiloide.
14. El uso según cualquiera de las reivindicaciones 8 a 13, que comprende el uso de componentes para indicar que la concentración seleccionada del grupo que consiste en:
- la concentración absoluta de A 1-38,
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración total de amiloide (A 1-38 %) ,
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de especies de amiloide A 1-40 (A 1-38/A 1-40) ,
- la relación de la concentración absoluta de A 1-38 con respecto a la concentración absoluta de especies de amiloide A 1-42 (A 1-38/A 1-42) ,
- la concentración absoluta de A 1-40,
- la relación de la concentración absoluta de A 1-40 con respecto a la concentración total de amiloide (A 1-40 %) ,
- la relación de la concentración absoluta de A 1-40 con respecto a la concentración absoluta de especies de amiloide A 1-42 (A 1-40/A 1-42) ,
- la concentración absoluta de A 1-42,
- la relación de la concentración absoluta de A 1-42 con respecto a la concentración total de amiloide (A 1-42 %) , y
- la concentración total de amiloide,
es superior o inferior a un valor umbral.
15. El uso según la reivindicación 13 o 14, en donde dichos componentes para determinar al menos una concentración adicional son anticuerpos.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]