Composiciones y métodos para detectar y tratar enfermedades y estados patológicos relacionados con los receptores de quimiocinas.
Método de cribado de un agente que se une a CCX-CKR2 sobre una célula,
comprendiendo el métodoponer en contacto una pluralidad de agentes con un polipéptido de CCX-CKR2 que comprende un dominioextracelular al menos 95% idéntico a un dominio extracelular de SEC ID nº:2, o un fragmento de unión a SDF1 oI-TAC del mismo; y
determinar que un agente compite con I-TAC o SDF1 por la unión al polipéptido de CCX-CKR2 o su fragmento;
en el que el método se lleva a cabo como un ensayo in vitro o basado en células.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/034807.
Solicitante: CHEMOCENTRYX, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1539 INDUSTRIAL ROAD SAN CARLOS, CA 94070 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MIAO, ZHENHUA, SCHALL, THOMAS, J., BURNS,JENNIFER M, SUMMERS,BRETTON, HOWARD,MAUREEN C.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K45/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00.
- G01N33/566 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › utilizando un soporte específico o proteínas receptoras como reactivos para la formación de uniones por ligando.
- G01N33/567 G01N 33/00 […] › utilizando un extracto de tejido o de órgano como agente de unión.
PDF original: ES-2399403_T3.pdf
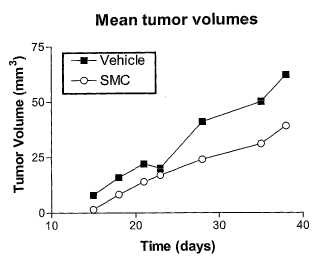
Fragmento de la descripción:
Composiciones y métodos para detectar y tratar enfermedades y estados patológicos relacionados con los receptores de quimiocinas.
Antecedentes de la invención Las quimiocinas constituyen una familia de pequeñas citocinas que son producidas en la inflamación y regulan el reclutamiento, activación y proliferación de leucocitos (Baggiolini, M. et al., Adv. Immunol. 55: 97-179 (1994) ; Springer, T. A., Annu. Rev. Physiol. 57: 827-872 (1995) ; y Schall, T. J. y K. B. Bacon, Curr. Opin. Immunol. 6: 865873 (1994) ) . Las quimiocinas son capaces de inducir selectivamente quimiotaxia de los elementos formados de la sangre (distintos de los glóbulos rojos) , incluyendo leucocitos tales como neutrófilos, monocitos, macrófagos, eosinófilos, basófilos, mastocitos, y linfocitos, incluyendo células T y células B. Además de estimular la quimiotaxia, se pueden inducir selectivamente otros cambios mediante quimiocinas en células sensibles, incluyendo cambios en la forma de las células, elevaciones transitorias en la concentración de iones calcio (Ca2+) libres intracelulares, exocitosis de gránulos, aumento de integrinas, formación de lípidos bioactivos (por ejemplo, leucotrienos) y estallido respiratorio, asociado con la activación de leucocitos. De este modo, las quimiocinas son desencadenantes tempranos de la respuesta inflamatoria, provocando liberación de mediadores inflamatorios, quimiotaxia y extravasación a sitios de infección o inflamación.
Se distinguen dos subfamilias de quimiocinas, denominadas quimiocinas CXC y CC, por la disposición de los primeros dos de cuatro restos de cisteína conservados, que están separados por un aminoácido (como en las quimiocinas CXC SDF-1, IL-8, IP-10, MIG, PF4, ENA-78, GCP-2, GROα, GROβ, GROγ, NAP-2, NAP-4, I-TAC) o son restos adyacentes (como en las quimiocinas CC MIP-1α, MIP-1β, RANTES, MCP-1, MCP-2, MCP-3, I-309) . La mayoría de las quimiocinas CXC atraen leucocitos neutrófilos. Por ejemplo, las quimiocinas CXC interleucina 8 (IL8) , el factor plaquetario 4 (PF4) , y el péptido 2 activador de neutrófilos (NAP-2) son potentes quimioatrayentes y activadores de neutrófilos. Las quimiocinas CXC designadas MIG (monocina inducida por gamma interferón) e IP10 (proteína de 10 kDa inducida por interferón-γ) son particularmente activas induciendo quimiotaxia de linfocitos de sangre periférica activados. Las quimiocinas CC son generalmente menos selectivas y pueden atraer a una variedad de tipos celulares de leucocitos, incluyendo monocitos, eosinófilos, basófilos, linfocitos T y células asesinas naturales. Las quimiocinas CC, tales como proteínas 1-3 quimiotácticas de monocitos humanos (MCP-1, MCP-2 y MCP-3) , RANTES (quimiocina expresada y segregada por células T normales y regulada por activación) , y las proteínas inflamatorias 1α y 1β de macrófagos (MIP-1α y MIP-1β) , se han caracterizado como quimioatrayentes y activadoras de monocitos o linfocitos, pero no parecen ser quimioatrayentes para neutrófilos.
Las quimiocinas CC y CXC actúan a través de receptores que pertenecen a una superfamilia de siete receptores acoplados a proteínas G que comprenden la transmembrana (Murphy, P. M., Pharmacol Rev. 52:145-176 (2000) ) . Esta familia de receptores acoplados a proteínas G comprende un gran grupo de proteínas de membrana integrales, que contienen siete regiones que comprenden la transmembrana. Los receptores están acoplados a proteínas G, que son proteínas reguladoras heterotrímeras capaces de unirse a GTP y mediar la transducción de señales a partir de receptores acoplados, por ejemplo mediante la producción de mediadores intracelulares.
Hablando de forma general, las interacciones de quimiocinas y receptores de quimiocinas tienden a ser promiscuas por cuanto una quimiocina se puede unir a muchos receptores de quimiocinas, y a la inversa, un único receptor de quimiocinas puede interaccionar con varias quimiocinas. Existen pocas excepciones a esta regla; una de tales excepciones ha sido la interacción entre SDF-1 y CXCR4 (Bleul et al., J Exp Med, 184 (3) : 1101-9 (1996) ; Oberlin et al., Nature, 382 (6594) : 833-5 (1996) ) . Originalmente identificada como un factor estimulante del crecimiento de células pre-B (Nagasawa et al., Proc Natl Acad Sci USA, 91 (6) : 2305-9 (1994) ) , SDF-1 ha sido el único ligando humano dado a conocer para CXCR4. El gen de SDF-1 codifica dos proteínas, denominadas SDF-1α y SDF-1β, mediante ayuste alternativo. Estas dos proteína son idénticas excepto por los cuatro restos de aminoácidos que están presentes en el término carboxi de SDF-1β y ausentes en SDF-1α.
Existen muchos aspectos de la señalización y selectividad de receptores de quimiocinas por ligandos que no se comprendieron previamente. Por ejemplo, existe un número de receptores huérfanos para los que no se ha determinado previamente ninguna función. RDC1, por ejemplo, aunque se pensó previamente que era un receptor para el péptido intestinal vasoactivo (VIP) , es considerado actualmente como un receptor huérfano debido a que no se ha identificado su ligando endógeno. Véase, por ejemplo, Cook et al., FEBS Letts. 300 (2) :149-152 (1992) .
La presente invención se refiere a estos y a otros problemas.
Breve sumario de la invención La presente invención proporciona métodos para identificar un agente que se une a CCX-CKR2 en una célula. En algunas formas de realización, el método comprende poner en contacto una pluralidad de agentes con un polipéptido de CCX-CKR2 que comprende un dominio extracelular al menos 95% idéntico a un dominio extracelular
de SEC ID nº:2, o un fragmento de unión a SDF1 o I-TAC del mismo; y seleccionar un agente que compite con I-TAC o SDF1 por la unión al polipéptido de CCX-CKR2 o su fragmento, identificando de ese modo un agente que se une a CCX-CKR2 en una célula.
En algunas realizaciones, la célula es una célula cancerosa. En algunas realizaciones, el método comprende además ensayar el agente seleccionado en busca de la capacidad para unirse a, o inhibir el crecimiento de, una célula. En algunas realizaciones, la célula es una célula cancerosa.
En algunas realizaciones, el método comprende además ensayar el agente seleccionado en busca de la capacidad para cambiar la adhesión celular a células endoteliales.
En algunas realizaciones, el agente es menor que 1.500 daltons. En algunas realizaciones, el agente es un anticuerpo. En algunas realizaciones, el agente es un polipéptido. En algunas realizaciones, el polipéptido de CCX-CKR2 comprende la secuencia presentada en SEC ID nº:2.
La presente invención también proporciona métodos para determinar la presencia o ausencia de una célula cancerosa. En algunas realizaciones, los métodos comprenden poner en contacto una muestra que comprende una célula con un agente que se une específicamente con SEC ID nº:2: y detectar la unión del agente a un polipéptido en la muestra, en el que la unión del agente a la muestra indica la presencia de una célula cancerosa.
En algunas realizaciones, el agente es un anticuerpo. En algunas realizaciones, el agente tiene menos de 1500 daltons. En algunas realizaciones, el agente es un polipéptido. En algunas realizaciones, el polipéptido detectado es SEC ID nº:2. En algunas realizaciones, la muestra procede de un ser humano. En algunas realizaciones, el método se usa para diagnosticar cáncer en un ser humano. En algunas realizaciones, el método se usa para proporcionar un pronóstico de cáncer en un ser humano. En algunas realizaciones, el cáncer se selecciona del grupo que consiste en cáncer de cuello uterino, cáncer de mama, linfoma, glioblastomas, cáncer de próstata, y leucemia. En algunas realizaciones, el cáncer no es sarcoma de Kaposi, enfermedad de Castleman multicéntrica o linfoma de efusión primaria asociado a SIDA. En algunas realizaciones, el anticuerpo compite con SDF1 e I-TAC por la unión a SEC ID nº:2.
La presente invención también proporciona métodos para proporcionar un diagnóstico o pronóstico de un individuo que tiene cáncer. En algunas realizaciones, los métodos comprenden detectar la presencia o ausencia de expresión de un polinucleótido que codifica un polipéptido de CCX-CKR2 en una célula de un individuo, en el que el polipéptido de CCX-CKR2 se une a I-TAC y/o SDF1, y el polipéptido de CCX-CKR2 es al menos 95% idéntico a SEC ID nº:2, diagnosticando de ese modo un cáncer en el individuo.
En algunas realizaciones, el polipéptido de CCX-CKR2 se presenta en SEC ID nº:2. En algunas realizaciones, el cáncer se selecciona del grupo que consiste en cáncer de cuello uterino, cáncer de mama, linfoma, glioblastomas, cáncer de próstata, y leucemia. En algunas... [Seguir leyendo]
Reivindicaciones:
1. Método de cribado de un agente que se une a CCX-CKR2 sobre una célula, comprendiendo el método poner en contacto una pluralidad de agentes con un polipéptido de CCX-CKR2 que comprende un dominio
extracelular al menos 95% idéntico a un dominio extracelular de SEC ID nº:2, o un fragmento de unión a SDF1 o I-TAC del mismo; y determinar que un agente compite con I-TAC o SDF1 por la unión al polipéptido de CCX-CKR2 o su fragmento; en el que el método se lleva a cabo como un ensayo in vitro o basado en células.
2. Método según la reivindicación 1, en el que la célula es una célula cancerosa.
3. Método según la reivindicación 1, que comprende además analizar el agente seleccionado respecto a la capacidad para unirse a, o inhibir el crecimiento de, una célula, por ejemplo en el que la célula es una célula cancerosa.
4. Método según la reivindicación 1, que comprende además ensayar el agente seleccionado respecto a la capacidad para cambiar la adhesión celular a las células endoteliales.
5. Método según la reivindicación 1, en el que el agente es un anticuerpo, o en el que el agente es un polipéptido.
6. Método según la reivindicación 1, en el que el polipéptido de CCX-CKR2 comprende la secuencia presentada en SEC ID nº:2.
7. Método según la reivindicación 1, en el que el polipéptido de CCX-CKR2 se expresa en una célula que no expresa una versión endógena de CCX-CKR2.
8. Método para determinar la presencia o ausencia de una célula cancerosa, comprendiendo el método
poner en contacto una muestra que comprende una célula con un anticuerpo que se une específicamente con SEC ID nº:2; y
detectar la unión del anticuerpo a un polipéptido de CCX-CKR2 en la muestra, en el que la célula es una célula no fetal y/o una célula distinta de una célula renal o cerebral, y en el que la unión del anticuerpo a la muestra indica la presencia de una célula cancerosa.
9. Método según la reivindicación 8, en el que la muestra procede de un ser humano, o en el que el método se utiliza para diagnosticar el cáncer en un ser humano, o en el que el cáncer se selecciona de entre el grupo que consiste en cáncer de cuello uterino, cáncer de mama, linfoma, glioblastomas, cáncer de próstata, y leucemia, o en el que el cáncer no es sarcoma de Kaposi, enfermedad de Castleman multicéntrica o linfoma de efusión primaria asociado al SIDA.
10. Método según la reivindicación 8, en el que el anticuerpo compite con SDF1 e I-TAC por la unión a SEC ID nº:2.
11. Anticuerpo que compite específicamente con SDF1 e I-TAC por la unión a SEC ID nº:2.
12. Anticuerpo según la reivindicación 11, en el que dicho anticuerpo es un anticuerpo monoclonal.
13. Anticuerpo según la reivindicación 12, en el que dicho anticuerpo es un anticuerpo humanizado.
14. siRNA que inhibe la expresión de un polinucleótido de CCX-CKR2 para su utilización en el tratamiento del cáncer.
15. siRNA según la reivindicación 14, para su utilización en el tratamiento del cáncer, en el que el polinucleótido de CCX-CKR2 codifica SEC ID nº:2, o comprende SEC ID nº:1.
16. Anticuerpo que compite con SDF1 e I-TAC por la unión a SEC ID nº:2, para su utilización en el tratamiento del cáncer.
17. Anticuerpo según la reivindicación 16, para su utilización en el tratamiento del cáncer, en el que el cáncer se selecciona de entre el grupo que consiste en cáncer de cuello uterino, cáncer de próstata, leucemia, cáncer de mama, linfoma y glioblastomas, o en el que el cáncer no es sarcoma de Kaposi, enfermedad de Castleman multicéntrica o linfoma de efusión primaria asociado al SIDA.
Patentes similares o relacionadas:
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Agente profiláctico y/o agente terapéutico para el linfoma difuso de células B grandes, del 17 de Junio de 2020, de ONO PHARMACEUTICAL CO., LTD.: 6-amino-9-[(3R)-1-(2-butinoil)-3-pirrolidinil]-7-(4-fenoxifenil)-7,9-dihidro-8H-purin-8-ona, una sal de la misma, un solvato de la misma o un N-óxido de la misma, […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Proceso para la purificación de daptomicina, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina que comprende: a) someter a la daptomicina a condiciones en las que una solución micelar de daptomicina se forma alterando el pH; y […]
Composición farmacéutica para el tratamiento o la paliación de pacientes con cáncer ancianos o en estado terminal, del 6 de Mayo de 2020, de Delta-Fly Pharma, Inc: Una composición farmacéutica para su uso en el tratamiento de cáncer, que comprende, como principio activo, ácido (2S)-2-(2S,3R)-3-amino-2-hidroxi-4-fenilbutanoilamino]-4-metilpentanoico […]
Enfoque dirigido a GDF6 y a señalización de BMP para la terapia contra el melanoma, del 6 de Mayo de 2020, de UNIVERSITY OF MASSACHUSETTS: Un inhibidor de GDF6 para su uso en el tratamiento de un melanoma en un sujeto, que comprende administrar a un sujeto que lo necesite una cantidad eficaz […]