Cámara multifuncional para alojar un componente biológico.
Cámara (10) para el componente biológico (100) de un hígado bioartificial (200),
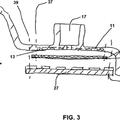
caracterizado por quecomprende un soporte de lecho fluidizado (20) que comprende una placa que está dotada de una gran cantidad deagujeros espaciados que permiten la fluidización controlada del lecho, una entrada de fluidización (16) y una salidade fluidización (18) y que está configurada para permitir:
• La proliferación del componente biológico, in situ, mediante la entrada de fluidización (16) y la salida defluidización (18)
• La crioconservación del componente biológico, in situ, gracias a uno de una gran cantidad de elementos deintercambio térmico (38) dispuestos en la cámara y
• La perfusión del componente biológico, in situ, mediante la entrada de fluidización (16) y la salida defluidización (18).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2008/002227.
Solicitante: UNIVERSITY COLLEGE LONDON.
Nacionalidad solicitante: Reino Unido.
Dirección: 5 GOWER STREET LONDON WC1E 6BT REINO UNIDO.
Inventor/es: SELDEN,CLARE, HODGSON,HUMPHREY, COWARD,SAM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61M1/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 1/00 Dispositivos de succión o de bombeo de uso médico; Dispositivos para extraer, tratar o transportar los líquidos del cuerpo; Sistemas de drenaje (catéteres A61M 25/00; conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; dispositivos para tomar muestras sanguíneas A61B 5/15; instrumentos para retirar la saliva para dentistas A61C 17/06; filtros para implantar en los vasos sanguíneos A61F 2/01). › Filtración de la sangre a través de una membrana para eliminar una sustancia, es decir hemofiltración, diafiltración.
- A61M1/36 A61M 1/00 […] › Otros tratamientos de la sangre en una derivación del sistema circulatorio natural, p. ej. adaptación de la temperatura, irradiación.
PDF original: ES-2434218_T3.pdf
Fragmento de la descripción:
Cámara multifuncional para alojar un componente biológico Campo de la técnica La presente invención se refiere al campo de la perfusión hepática extracorporal y, más en particular, al diseño de una cámara en la cual se puede alojar un componente biológico para formar, p. ej., un hígado bioartificial (BAL, por su nombre en inglés) . También se refiere a un hígado bioartificial en sí mismo, sus componentes y las etapas metodológicas asociadas a su desarrollo y uso.
Antecedentes de la invención En la actualidad, el trasplante es la única cura para la hepatopatía crónica y aguda y la insuficiencia hepática. No obstante, este tratamiento está limitado por una ausencia de órganos de donantes. Tan solo en los EE.UU. se encuentran 17.000 pacientes en la lista de espera de trasplantes. Muchos de ellos se mueren mientras esperan un trasplante. Por lo tanto, hay una necesidad urgente de un dispositivo que pueda desempeñar de forma temporal la función del hígado de un paciente, manteniéndolo vivo mientras se encuentra un órgano de donante adecuado, o que proporcione un entorno que garantice que el paciente no se morirá mientras que su propio hígado recupera suficiente funcionalidad para la supervivencia del paciente.
Existen dos tipos principales de máquinas hepáticas:
! Una máquina puramente artificial; y
! Una máquina bioartificial.
Ambas se basan en la perfusión del plasma o de la sangre de un paciente en un circuito extracorporal durante un 20 periodo de 6 horas o más.
Existen sistemas puramente artificiales y se encuentran en desarrollo una serie de sistemas bioartificiales.
Sin embargo, los sistemas puramente artificiales, tales como la diálisis de albúmina, son incapaces de reemplazar todas las funciones hepáticas, entre ellas:
! Desintoxicación ! Biotransformación,
! Síntesis y
! Conservación y aunque han resultado ser relativamente seguros en los ensayos clínicos, no han mejorado de forma significativa la supervivencia de los pacientes.
Los sistemas puramente artificiales tienen una naturaleza únicamente física o química y proporcionan una función de desintoxicación mediante absorción o intercambio sobre, p. ej., resina, carbón, columnas de intercambio iónico o albúmina, o combinaciones de éstos.
En cambio, los hígados bioartificiales (BAL) contienen un componente biológico, a saber, hepatocitos, solos o en combinación con un dispositivo artificial a modo de sistema híbrido. La hipótesis que subyace a la incorporación de 35 hepatocitos es que el funcionamiento del hígado es muy complejo, y comprende muchas vías de síntesis, de desintoxicación y metabólicas, que los dispositivos únicamente mecánicos siempre serán inadecuados para reemplazar el abanico de funciones deseadas; además, no se han definido completamente las funciones críticas para ganar tiempo para que se recupere la función hepática y el uso de los hepatocitos permite el reemplazo de las funciones tanto definidas como indefinidas. Para el componente biológico se utilizan hepatocitos aislados o, en determinadas ocasiones, cortes de hígado, y los sistemas han utilizado tanto células humanas como animales (más a menudo porcinas) .
La mayoría de los primeros BAL utilizaban cartuchos de fibra hueca en los cuales las células se separaban con una membrana del plasma o de la sangre completa. El tamaño de los poros de la membrana difería de un sistema a otro, algunos se limitaban a la transferencia de moléculas de menos de 10.000 Da, algunos con un tamaño de poro de 45 hasta 2 μm.
Más recientemente han surgido otras configuraciones que abordan mejor las limitaciones de la transferencia de masa. Incluyen:
! Un AMC-BAL que contiene células adheridas a una matriz de poliéster que está expuesta directamente al plasma oxigenado, (Flendrig L M, LaSoe J W, Joming G G A, Steenbeek A, Karlsen O T, Bovee W M M J, Ladiges N C J J, TeVelde A A, Chamuleau R A F M «In vitro evaluation of a novel bioreactor based on an integral oxygenator and a spirally wound non-woven polyester matrix for hepatocyte culture as small aggregates». Journal of Hepatology, 1998; 26: 1379-1392) .
! Un biorreactor de tejido sin tejer (Li L J, Du W B, Zhang Y M, Li J, Pan X P, Chen J J, Cao H C, Chen Y, Chem Y M. «Evaluation of a bioartificial liver based on a non-woven fabric bioreactor with porcine hepatocytes in pigs». Journal of Hepatology, 2006; 44: 317-324) .
! Un biorreactor de flujo radial (Morsiani E, Brogli M, Galavotti D, Bellini T, Ricci D, Pazzi P, Puviani A C. «Long-term expression of highly differenciated functions by isolated porcine hepatocytes perfused in a radial 10 flow bioreactor». Artif. Organs. 2001; 25: 740-748) y
! El hígado bioartificial de Innsbruck que contiene agregados de hepatocitos (Hochleitner B, Hengster P, Duo L, Bucher H, Klima G, Margreiter R. «A novel bio-artificial liver with culture porcine hepatocyte aggregates under simulated microgravity». Artif. Organs. 2005; 29: 58-66) .
Los ejemplos anteriores utilizan hepatocitos de animales.
Los ejemplos de reactores con células humanas incluyen los que utilizan:
! Hepatocitos primarios (Gerlach J C, Mutig K, Sauer I M, Schrade P, Efimova E, Mieder T, Naumann G, Grunwald A, Pless G, Mas A, Bachmann S, Neuhaus P, Zeilinger K. «Use of primar y human liver cells originating from discarded grafts in a bioreactor for liver support therapy and the prospects of culturing adult liver stem cells in bioreactors: a morphologic study». Transplantation 2003; 76: 781-786) .
! Cartuchos de fibra hueca que utilizan líneas celulares procedentes de tumores bien diferenciados, tales como células C3A (Ellis A J, Hughes R D, Wendon J A, Dunne J, Langley P G, Kelly J H, Gislason G T, Sussman N L, Williams R. «Pilot controlled trial of the extracorporal liver assist device in acute liver failure». Hepatology 1996; 24: 1446-1451) y
! Un biorreactor de lecho fluidizado con células C3A humanas encapsuladas a gran densidad
(aproximadamente 1 millón de células/ml) en alginato (David B, Dufresne M, Nagel M D, Legallais C. «In vitro assessment of encapsulated C3A hepatocytes functions in a fluidized bed bioreactor». Biotechnol. Prog. 2004; 20: 1204-1212) .
Distintos grupos en todo el mundo están trabajando con diferentes componentes biológicos, que incluyen:
! El uso de cultivos primarios de hepatocitos humanos;
! El uso de cultivos primarios de hepatocitos de cerdo; y
! El uso de células C3A, una línea celular capaz de proliferar procedente inicialmente de un tumor bien desarrollado de hepatocitos humanos.
Hay diferencias fundamentales entre los sistemas que utilizan líneas celulares capaces de proliferar y los que utilizan células primarias. Las líneas celulares capaces de proliferar se pueden inocular de forma individual y se deja que se multipliquen in situ, para formar esferoides cohesivos durante un periodo de tiempo, que depende del tiempo de generación de un tipo celular específico. En cambio, las células primarias, incluso si se inoculan a una densidad celular muy alta, no formarán necesariamente contactos intercelulares entre células cercanas y, por consiguiente, no darán lugar necesariamente a un entorno tridimensional verdadero, lo cual está asociado a la inducción de la función, ya que imita la situación in vivo.
La estrategia del solicitante ha sido utilizar una línea celular, y tiene similitudes con la estrategia de C3A que no ha resultado ser eficaz en los ensayos clínicos. Sin embargo, la línea celular del solicitante es diferente y tiene algunas propiedades funcionales diferentes. También hay diferencias fundamentales entre el alojamiento y el cultivo inicial de las células antes de su uso.
Las células C3A se han utilizado con anterioridad en:
! Una «configuración de cultivo de cartuchos de fibras huecas» o bien ! «Sin cultivar», en un lecho fluidizado en perlas de alginato de baja ocupación.
Esto contrasta con la metodología utilizada por el solicitante, que utiliza una matriz de alginato sin revestir en una configuración de biorreactor de lecho fluidizado con precultivo de células encapsuladas para que tengan buena calidad.
El componente biológico de los solicitantes, que comprende líneas celulares de hepatocitos humanos cultivados en una configuración tridimensional, se ha demostrado, a escala de laboratorio, que proporciona una capacidad funcional hepática gracias a las células, que se acerca a la observada in vivo para varias de las funciones clave del hígado, que incluyen:
! Síntesis de factores de coagulación;
5 ! Metabolismo de los corticoesteroides, y
! Funciones... [Seguir leyendo]
Reivindicaciones:
1. Cámara (10) para el componente biológico (100) de un hígado bioartificial (200) , caracterizado por que comprende un soporte de lecho fluidizado (20) que comprende una placa que está dotada de una gran cantidad de agujeros espaciados que permiten la fluidización controlada del lecho, una entrada de fluidización (16) y una salida de fluidización (18) y que está configurada para permitir:
! La proliferación del componente biológico, in situ, mediante la entrada de fluidización (16) y la salida de fluidización (18)
! La crioconservación del componente biológico, in situ, gracias a uno de una gran cantidad de elementos de intercambio térmico (38) dispuestos en la cámara y
! La perfusión del componente biológico, in situ, mediante la entrada de fluidización (16) y la salida de fluidización (18) .
2. Cámara de acuerdo con cualquiera de las reivindicaciones anteriores, que es una unidad sellable de construcción tubular que comprende un alojamiento cilíndrico con pared (36) que se puede cerrar mediante las placas superior (12) e inferior (14) .
3. Cámara de acuerdo con la reivindicación 2, que tiene un volumen de trabajo (v) de 1 a 10 litros, y tiene una proporción de aspecto (a) , a = h/d, en donde h = altura y d = diámetro, del orden de 10:1 a 1, 3:1.
4. Cámara de acuerdo con cualquiera de las reivindicaciones anteriores, que comprende adicionalmente una malla filtrante (26) .
5. Cámara de acuerdo con cualquiera de las reivindicaciones anteriores, que comprende adicionalmente un sistema de transporte de fluido (30) que tiene una entrada (32) , una salida (34) y un tubo que es semipermeable a los gases.
6. Cámara de acuerdo con la reivindicación 5, en donde el sistema de transporte de fluido (30) está dispuesto de forma helicoidal alrededor del interior de la cámara.
7. Cámara de acuerdo con la reivindicación 2, en donde uno o una gran cantidad de elementos de intercambio térmico (38) atraviesan la placa superior (12) y entran en la cámara justo encima del soporte del lecho fluidizado (20) .
8. Cámara de acuerdo con la reivindicación 1, en donde una o una gran cantidad de elementos de intercambio térmico (38) están dispuestos a lo largo de una longitud (h) de la cámara.
9. Cámara de acuerdo con la reivindicación 2, en donde los elementos de intercambio térmico (38) están dispuestos esencialmente perpendiculares a las placas superior (12) e inferior (14) .
10. Dispositivo de hígado bioartificial (200) , que comprende una cámara (10) de acuerdo con cualquiera de las reivindicaciones 1 a 9 rellena con un componente biológico (100) .
11. Dispositivo de hígado bioartificial (200) de acuerdo con la reivindicación 10, en donde el componente biológico (100) comprende un agente formador de matriz (120) que comprende una gran cantidad de células (110) y uno o más modificadores de la densidad (130) .
12. Dispositivo de hígado bioartificial (200) de acuerdo con la reivindicación 10 u 11, en donde el dispositivo comprende entre 3 x 1010 y 1 x 1011 hepatocitos de buena calidad.
13. Dispositivo de hígado bioartificial (200) de acuerdo con cualquiera de las reivindicaciones 11 a 12, en donde el agente formador de matriz comprende perlas de alginato con un diámetro de 300 a 1200 μm y el modificador de la densidad comprende perlas de vidrio con un diámetro medio de 10 a 50 μm.
14. Procedimiento de perfusión de sangre o plasma que imita un hígado en los estudios de metabolismo de fármacos y de hepatotoxicidad, que comprende la etapa de introducción de plasma o de sangre en un dispositivo de hígado bioartificial de acuerdo con cualquiera de las reivindicaciones 10 a 13, de tal forma que penetra en la cámara
(10) a través de la entrada (16) y la abandona a través de la salida (18) .
15. Procedimiento para la crioconservación de células proliferadas en una cámara de acuerdo con cualquiera de las reivindicaciones 1 a 13, que comprende:
i. El intercambio del crioprotector con las células proliferadas en la cámara;
ii. La disposición en horizontal de la cámara para permitir la distribución de las células proliferadas a lo largo de la longitud (h) de la cámara; y
iii. El enfriamiento rápido de las células proliferadas al hacer pasar un refrigerante por los elementos de intercambio térmico.
Patentes similares o relacionadas:
RECIPIENTE PARA TRATAMIENTO EX VIVO DE LÍQUIDOS BIOLÓGICOS, del 16 de Julio de 2020, de META CELL TECHNOLOGY SL: Recipiente para tratamiento ex vivo de líquidos biológicos, que comprende: - un cuerpo rígido; - un depósito , previsto en el interior […]
Aparato y método de cardioplejía, del 15 de Julio de 2020, de Quest Medical, Inc: Una consola para controlar la administración de cardioplejía a un paciente, que comprende en combinación: un ordenador configurado para perfundir la cardioplejía […]
Procedimiento para la interrupción transitoria de un tratamiento extracorporal de la sangre, dispositivo de control y dispositivo para el tratamiento de la sangre, del 24 de Junio de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Dispositivo de control o de regulacion que esta programado para ser activado para pasar un dispositivo para el tratamiento de la sangre , […]
 Dispositivo, así como dispositivo funcional externo y dispositivo de tratamiento para tratar fluidos médicos, del 27 de Mayo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Dispositivo funcional externo con un dispositivo , donde el dispositivo presenta:
- al menos una cámara de recepción de fluido para recibir al menos […]
Dispositivo, así como dispositivo funcional externo y dispositivo de tratamiento para tratar fluidos médicos, del 27 de Mayo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Dispositivo funcional externo con un dispositivo , donde el dispositivo presenta:
- al menos una cámara de recepción de fluido para recibir al menos […]
Tratamiento de afecciones asociadas al síndrome metabólico, del 22 de Abril de 2020, de TLA Targeted Immunotherapies AB: Un reactivo de unión capaz de unirse específicamente al receptor de quimiocinas CCR2 para utilizarlo en el tratamiento de una afección de diabetes, en donde el reactivo de unión […]
Métodos y aparatos para el soporte de órganos, del 15 de Abril de 2020, de Biomedinnovations, LLC: Un aparato de soporte de órganos, que comprende: (a) un circuito de líquido que define tramos situados más arriba y situados […]
Métodos para diagnosticar enfermedades infecciosas usando medios de adsorción, del 15 de Abril de 2020, de ExThera Medical Corporation: Un método in vitro para concentrar patógenos infecciosos presentes en una muestra biológica obtenida de un sujeto que es sospechoso de estar […]
Detección de una interrupción de una conexión de fluido entre dos sistemas que contienen fluido, del 15 de Abril de 2020, de GAMBRO LUNDIA AB: Un sistema de monitorización para detectar una interrupción de una conexión de fluido entre un primer sistema (1a, 1b) que contiene fluido y un segundo […]