Agente de diagnóstico.
Un péptido que comprende:
i) la secuencia de aminoácidos DThr-DVal-DVal-DAIa o DVal-DVal-DAIa;
ii) un péptido de poli-D-Arginina unido al extremo N o C de la secuencia de (i) por un resto de glicina o Nmetilglicinay/o cualquier otro espaciador; y
iii) un marcador detectable o un sustituyente capaz de formar un complejo con un marcador detectable.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2008/002932.
Solicitante: UNITED ARAB EMIRATES UNIVERSITY.
Nacionalidad solicitante: Emiratos Árabes Unidos.
Dirección: RESEARCH AFFAIRS P.O. BOX 17551 AL AIN ABU DHABI EMIRATOS ARABES UNIDOS.
Inventor/es: EL-AGNAF,OMAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/03 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen hasta 20 aminoácidos en una secuencia indeterminada o parcialmente determinada; Sus derivados.
- A61K47/42 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K49/08 A61K […] › A61K 49/00 Preparaciones para examen in vivo. › caracterizadas por el soporte.
- A61K51/04 A61K […] › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Compuestos orgánicos.
- A61K51/08 A61K 51/00 […] › Péptidos, p. ej. proteínas.
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- G01N33/58 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
PDF original: ES-2436424_T3.pdf
Fragmento de la descripción:
Agente de diagnóstico
Campo de la invención La presente invención se refiere a péptidos capaces de reconocer y unirse a agregados de !-sinucleína y al uso de los péptidos en el diagnóstico y control de enfermedades sinucleinopáticas (enfermedades de sinucleinopatía o sinucleinopatías) , que son enfermedades neurodegenerativas que implican anomalías en una o más de las sinucleínas.
Antecedentes de la invención La presente invención se refiere a péptidos y sus derivados que son útiles para el diagnóstico y control de sinucleinopatías. Estas son enfermedades asociadas con anomalías en una o más de los sinucleínas e incluyen algunas afecciones neurodegenerativas importantes, por ejemplo enfermedad de Parkinson (PD) , demencia con cuerpos de Lewy (DLB) , enfermedad de Alzheimer (AD) y atrofia sistémica múltiple (MSA) . Las sinucleínas también se expresan a niveles anormalmente altos en diversos tumores (por ejemplo, de mama, ovárico) en cáncer humano.
Las sinucleínas son una familia de proteínas pequeñas (∀14 kDa) que se expresan a altos niveles en el tejido nervioso. Los tres miembros de la familia (sinucleína !, # y ∃) son los productos de tres genes presentes en diferentes cromosomas. Las pruebas genéticas y bioquímicas convergentes sugieren que la deposición de agregados de !-sinucleína insoluble o fibrillas es una etapa importante en el desarrollo de varias sinucleinopatías.
El primer indicio de la implicación de !-sinucleína en la patogénesis de enfermedad vino del aislamiento de uno de sus fragmentos proteolíticos de amiloide purificado de cerebros con enfermedad de Alzheimer (AD) . Este fragmento de !-sinucleína, que representa aproximadamente el 10% del material insoluble en dodecil sulfato sódico (SDS) , se nombró componente no A# de amiloide de AD (NAC) . La secuenciación de aminoácidos reveló que el NAC comprendía al menos 35 aminoácidos, aunque los restos N terminales no podían asignarse con certeza debido a la especificidad de la enzima usada en la secuenciación. Se mostró posteriormente que estos 35 aminoácidos correspondían a los restos 61-95 de un precursor de 140 aminoácidos (NACP) . Se descubrió que el NACP era idéntico a la proteína llamada !-sinucleína.
Se estableció una clara conexión genética con la PD cuando se mostró que se encontraban tres mutaciones diferentes en el gen de !-sinucleína en formas heredadas raras de esta enfermedad. Se ha descubierto una mutación, !-sinucleína (A53T) , en ciertas familias italianas y griegas, y da como resultado sustitución de Ala53 a Thr. La otra mutación, !-sinucleína (A30P) , se ha encontrado en una familia de origen alemán, y da como resultado cambio de Ala30 a Pro, y la última mutación E46K se encontró en Parkinsonismo familiar y DLB. Además, las duplicaciones y triplicaciones genéticas en el locus del SNCA también se han presentado en casos familiares de PD lo que sugiere que el aumento de la dosificación génica de SNCA, que da como resultado simultáneamente un aumento de los niveles de proteína !-sinucleína natural, también es patógeno. Las duplicaciones de SNCA se asemejan mucho a la PD idiopática con aparición en edad tardía, progresión lenta y ausencia de demencia y deterioro cognitivo. Como alternativa, las triplicaciones de SNCA dan como resultado PD de aparición temprana con progresión más rápida y demencia.
Adicionalmente, las lesiones del cerebro conocidas como “cuerpos de Lewy” y “neuritas de Lewy” constituyen las principales características patológicas en los cerebros de pacientes con PD y DLB. Estos cuerpos de Lewy y neuritas de Lewy contienen agregados de !-sinucleína. Los estudios de microscopía inmunoelectrónica e inmunohistoquímica adicionales han mostrado que la !-sinucleína también está asociada con lesiones patológicas en otras enfermedades neurodegenerativas, que implican en ocasiones células no neuronales, tales como las inclusiones citoplásmicas gliales halladas en MSA. Por lo tanto PD, AD, DLB y MSA se denominan de forma colectiva en el presente documento sinucleinopatías.
Se ha indicado recientemente que pueden crearse lesiones similares a las halladas en las enfermedades 55 sinucleinopáticas humanas en animales transgénicos. Los animales transgénicos expresan altos niveles de proteína !-sinucleína humana natural o mutante y desarrollan progresivamente muchas de las afecciones patológicas asociadas con las enfermedades sinucleinopáticas. Estos hallazgos implican la deposición de agregados de proteína !-sinucleína en la patofisiología de las enfermedades sinucleinopáticas. Resulta interesante que las tres mutaciones de !-sinucleína humana parecen acelerar el proceso de agregación.
El-Agnaf et al (2004) FASEB J. 18, 1315-1317 y la publicación de patente Internacional relacionada WO2004/009625 desvela péptidos del fragmento NAC de !-sinucleína como inhibidores potenciales de la agregación de !-sinucleína. El documento WO2004/009625 menciona el uso de dichos péptidos en ensayos in vitro para detectar !-sinucleína. El-Agnaf et al (2006) FASEB J. 20, 419-425 y las publicaciones de patente Internacional WO03/069332 y WO99/50300 describen métodos para la detección de oligomerización de !-sinucleína usando anticuerpos monoclonales.
La secuencia de aminoácidos completa de la !-sinucleína natural humana se proporciona como SEC ID Nº: 1. 5
Sumario de la invención Se han diseñado inhibidores peptídicos pequeños de la agregación y toxicidad de !-sinucleína, y se han nombrado inhibidores de !-sinucleína (ASI) . Estos péptidos cortos contienen parte de la región de unión de !-sinucleína correspondiente a los restos 69-72 de SEC ID Nº: 1. La insolubilidad de estos péptidos se superó colocando restos hidrófilos, tales como arginina y glicina, en el extremo N terminal y glicina y arginina en el extremo C terminal de los péptidos sintéticos. Se descubrió que estos péptidos se unían a las formas monoméricas (libres) de !-sinucleína y eran capaces de bloquear su ensamblaje tanto en agregados solubles tempranos (o aductos) como en agregados maduros (o fibrillas de sinucleína maduras) .
Se desvela en el presente documento un péptido que comprende o consiste esencialmente en una secuencia de aminoácidos correspondiente a la secuencia de aminoácidos de la región de unión de !-sinucleína natural humana (es decir los restos 61 a 95 de SEC ID Nº: 1) . La secuencia de la región de unión se proporciona posteriormente en su totalidad, y como SEC ID Nº:2.
Secuencia de la región de unión de !-sinucleína:
EQVTNVGGAV VTGVTAVAQK TVEGAGSIAA ATGFV (SEC ID Nº 2)
La presente invención se basa en el sorprendente hallazgo de que los péptidos ASI derivados de la secuencia de la región de unión de !-sinucleína de origen natural (restos de aminoácidos 61 a 95 de SEC ID Nº: 1) se unen con mayor afinidad tanto a agregados solubles tempranos como a agregados maduros de !-sinucleína que a !sinucleína libre “forma monomérica de !-sinucleína”. En consecuencia, un péptido que comprende o consiste esencialmente en secuencias de aminoácidos correspondientes a la región de unión de !-sinucleína puede usarse para detectar agregados de !-sinucleína (o sus fragmentos tales como NAC) . A no ser que se indique de otro modo, debería interpretarse que todas las referencias posteriores a agregados de !-sinucleína también se aplican a agregados tanto solubles tempranos (de bajo y/o alto peso molecular de oligómeros solubles) como maduros de !sinucleína o sus fragmentos o derivados, incluyendo agregados que comprenden !-sinucleína en complejo con cualquier otra proteína o proteínas.
Como resultado de la capacidad para unirse a los agregados de !-sinucleína, un péptido de acuerdo con la invención es adecuado para su uso en el diagnóstico de enfermedades que implican !-sinucleína. Puesto que el péptido de la invención es capaz de unirse a los agregados solubles (o aductos) de !-sinucleína que están presentes en los estadios tempranos de enfermedades sinucleinopáticas, el péptido es particularmente adecuado para su uso en el diagnóstico temprano de dichas enfermedades. El péptido es útil para detectar agregados de !sinucleína “natural” (forma nativa) , o formas mutadas, nitradas, fosforiladas, glicosiladas o truncadas o cualquier otra forma modificada de origen natural.
El péptido de la invención puede comprender adicionalmente un sustituyente para aumentar el transporte a través de 45 la barrera hematoencefálica y/o aumentar la captación por células vivas. Además, el péptido de la invención puede marcarse para su uso como agente de formación de imágenes. Por ejemplo, puede introducirse un... [Seguir leyendo]
Reivindicaciones:
1. Un péptido que comprende:
i) la secuencia de aminoácidos DThr-DVal-DVal-DAIa o DVal-DVal-DAIa; ii) un péptido de poli-D-Arginina unido al extremo N o C de la secuencia de (i) por un resto de glicina o Nmetilglicina y/o cualquier otro espaciador; y iii) un marcador detectable o un sustituyente capaz de formar un complejo con un marcador detectable.
2. Un péptido de acuerdo con la reivindicación 1, donde el sustituyente capaz de formar un complejo con un marcador detectable es ácido 1, 4, 7, 10-tetraazaciclododecano-1, 4, 7-tris (éster t-butílico de ácido acético) -10-acético (DOTA) unido al extremo N del péptido.
3. Un péptido de acuerdo con la reivindicación 1 o 2, donde el marcador detectable es un agente de contraste. 15
4. Un péptido de acuerdo con la reivindicación 3, donde el agente de contraste comprende iones de gadolinio.
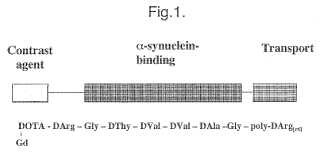
5. Un péptido de acuerdo con una cualquiera de las reivindicaciones anteriores, representado por una cualquiera de las fórmulas (I) a (VI) :
(I) DOTA-DArg-Nmetilglicina-DVal-DVal-DAIa-N-metilglicina-poli-D-Arginina[r6]
(II) DOTA-DArg-Nmetilglicina-DThr-DVal-DVal-DAIaNmetilglicina-poli-D-Arginina[r6]
(III) DOTA-DArg-Glicina-DVal-DVal-DAIa-Glicina-poli-D-Arginina[r6]
(IV) DOTA-DArg-Glicina-DThr-DVal-DVal-DAIa-Glicina-poli-D-Arginina[r6] 25 (V) DOTA-poli-D-Arginina[r6]-Glicina-DVal-DVal-DAIa-Glicina-DArg
(VI) DOTA-poli-D-Arginina[r6]-Glicina-DThr-DVal-DVal-DAIa-Glicina-DArg
(VII) DOTA-DArg-Nmetilglicina-DVal-DVal-DAIa-N-metilglicina-butadiamina
(VIII) DOTA-DArg-Nmetilglicina-DVal-DVal-DAIa-N-metilglicina-pentadiamina
6. Un péptido de acuerdo con una cualquiera de las reivindicaciones 1 a 5 adaptado para facilitar su entrada en células biológicas, o a través de barreras biológicas, opcionalmente donde el péptido está adaptado por la adición de un péptido de soporte al que es permeable la membrana seleccionado entre Tat- (48-60) de VIH, cubierta (35-49) del virus cabaña (FHV) , Antennapedia- (43-58) de Drosophila (43-58) , péptidos básicos o poliaminas.
8. Un método para formar imágenes de agregados de !-sinucleína en un sujeto, comprendiendo dicho método detectar la unión de un péptido como se define en una cualquiera de las reivindicaciones 1 a 6 a agregados de !sinucleína, donde el método comprende administrar dicho péptido a dicho sujeto por medios no quirúrgicos.
9. El método de acuerdo con la reivindicación 8, donde los agregados de !-sinucleína están presentes en un sujeto humano o animal; y/o dicho péptido se detecta por imágenes de resonancia magnética (MRI) .
10. Un método in vitro para diagnosticar una enfermedad sinucleinopática en la que está implicada la !-sinucleína y/o fragmentos de !-sinucleína, comprendiendo dicho método las etapas de
(a) combinar in vitro una muestra de tejido y/o fluido biológico (por ejemplo, sangre, LCR, orina) del paciente con un péptido de acuerdo con una cualquiera de las reivindicaciones 1 a 6 durante un tiempo y en condiciones eficaces para permitir la unión del péptido a agregados de !-sinucleína presentes en dicha muestra; y
(b) detectar de esta manera la presencia o ausencia de agregados de !-sinucleína en dicha muestra, donde la presencia de agregados de !-sinucleína indica que el sujeto tiene una enfermedad sinucleinopática y la ausencia de agregados de !-sinucleína indica que el sujeto no tiene dicha enfermedad sinucleinopática.
11. El método de la reivindicación 10, que comprende además:
(c) cuantificar la cantidad de péptido unido a agregados de !-sinucleína en dicha muestra; y que opcionalmente comprende además:
(d) combinar una muestra adquirida posteriormente de tejido del paciente con una cantidad de péptido durante un tiempo y en condiciones eficaces para permitir la unión de los agregados del péptido de !-sinucleína presentes en la muestra adquirida posteriormente;
(e) cuantificar la cantidad de péptido unido a agregados de !-sinucleína en la muestra adquirida posteriormente;
(f) comparar la cantidad de !-sinucleína en la muestra de la etapa (c) con la cantidad de !-sinucleína en la
muestra de la etapa (e) ; y 65 (g) determinar de esta forma si se ha alterado el estado del paciente, donde una cantidad de !-sinucleína en la muestra de la etapa (e) mayor que en la muestra de la etapa (c) indica que el estado del paciente ha empeorado, y donde una cantidad de !-sinucleína en la muestra de la etapa (c) mayor que en la muestra de la etapa (e) indica que el estado del paciente ha mejorado.
12. Un método para controlar una enfermedad sinucleinopática en la que está implicada la !-sinucleína y/o uno o más fragmentos de !-sinucleína, comprendiendo dicho método administrar un péptido como se define en una cualquiera de las reivindicaciones 1 a 6 a un sujeto por medios no quirúrgicos y detectar la cantidad y/o el tamaño de cualquier agregado de !-sinucleína que se haya formado por la !-sinucleína sola o por !-sinucleína complejada con cualquier otra proteína.
13. Un método de acuerdo con la reivindicación 12, donde dicho sujeto se somete a terapia para tratar dicha enfermedad sinucleinopática y dicho método es para controlar la eficacia de dicha terapia.
14. El péptido de una cualquiera de las reivindicaciones 1 a 6 para uso como en la reivindicación 7, o el método de
una cualquiera de las reivindicaciones 10 a 13, donde la enfermedad sinucleinopática es enfermedad de Parkinson (EP) , enfermedad de Alzheimer (EA) , demencia de cuerpos de Lewy (DCL) o atrofia multisistémica (AMS) .
15. El método de la reivindicación 10 u 11, donde el marcador del péptido comprende un radiomarcador, un marcador enzimático, un marcador fluorescente, un marcador quimioluminiscente o un marcador antigénico;
opcionalmente donde la presencia del péptido unido a !-sinucleína soluble y/o agregados de !-sinucleína en la muestra se detecta por autorradiografía, tomografía de emisión de positrones, formación de imágenes por resonancia magnética nuclear, un contador gamma o un contador de centelleo.
16. Un método in vitro para controlar la eficacia de un agente terapéutico que se ha administrado para tratar una enfermedad sinucleinopática en la que está implicada la !-sinucleína y/o uno o más fragmentos de !-sinucleína, comprendiendo el método analizar una muestra de un modelo animal con respecto a la presencia y cantidad de agregados de !-sinucleína; de acuerdo con las siguientes etapas:
(a) combinar in vitro una muestra del sujeto con un péptido de acuerdo con una cualquiera de las reivindicaciones 1 a 6 durante un tiempo y en condiciones eficaces para permitir la unión del péptido a agregados de !-sinucleína presentes en la muestra; y
(b) detectar de esta manera la presencia y cantidad de agregados de !-sinucleína en la muestra.
17. Un método para controlar la eficacia de un agente terapéutico que se ha administrado para tratar una enfermedad sinucleinopática en la que están implicados !-sinucleína y/o fragmentos de !-sinucleína, comprendiendo el método obtener imágenes del cerebro de un modelo animal no humano con respecto a la presencia y cantidad de agregados de !-sinucleína, comprendiendo dicho método detectar la unión de un péptido como se define en una cualquiera de las reivindicaciones 1 a 6 a agregados de !-sinucleína.
18. Un kit para formar imágenes de agregados de !-sinucleína, comprendiendo dicho kit un péptido de acuerdo con una cualquiera de las reivindicaciones 1 a 6 y medios no quirúrgicos para administrar el péptido a un sujeto.
Patentes similares o relacionadas:
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Inmunoensayos de canalización de oxígeno luminiscentes heterogéneos, del 15 de Julio de 2020, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un kit que contiene un sistema de deteccion quimioluminiscente, comprendiendo el kit: (a) una composicion que comprende un compuesto quimioluminiscente activable […]
Determinación de enriquecimientos de trazadores de glucosa mediante espectrometría de masas, del 13 de Mayo de 2020, de Medizinische Universität Graz: Procedimiento para determinar, en una muestra, los enriquecimientos de un primer y, por lo menos, un segundo trazador marcado de una forma […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Nanomateriales multicomponentes de Au y métodos de síntesis, del 15 de Abril de 2020, de THE CURATORS OF THE UNIVERSITY OF MISSOURI: Una nanoconstrucción de AuNP(DTDTPA)(biomolécula) que comprende una nanopartícula (NP) de Au, DTDTPA y una biomolécula, en donde DTDTPA es ácido dietilentriaminopentaacético […]
Tira para monitorizar concentraciones de analito, del 8 de Abril de 2020, de Biostrip ApS: Un procedimiento para medir la concentración de al menos un analito C en una muestra líquida, consistiendo dicho procedimiento en: i) aplicar una muestra […]
Ensayo para capturar y detectar células de mieloma múltiple circulantes de la sangre, del 25 de Marzo de 2020, de Menarini Silicon Biosystems S.p.A: Un método para capturar, aislar y analizar células de mieloma múltiple circulantes en una muestra de sangre obtenida de un sujeto de prueba que comprende (a) […]