1H-azolil-metil-amidas, procedimiento para su obtención y utilización de las mismas como inhibidores de nitrificación.
N-(1H-azolil-metil)amidas de la fórmula general I, caracterizadas porque
**Fórmula**
A es CH,
C-halógeno, C-alquilo C1-C4 o C-cicloalquilo C3-C8 o N;
R1 y R2 con independencia entre sí significan H, alquilo C1-C4 o cicloalquilo C3-C8;
R3 significa alquilo C1-C4, cicloalquilo C3-C8 o arilo C6-C10 o H;
R4 significa alquilo C1-C20, cicloalquilo C3-C8, arilo C6-C10 o arilalquilo formado por grupos alquilo C1-C4 y arilo C6-C10,los restos arilo de R4 pueden estar eventualmente sustituidos, una o varias veces, por (alquil C1-C4)-sulfonilo, alcoxiC1-C4, acilo C1-C4, halógeno, hidroxilo, ciano, nitro, carboxilo o carboxi-alquilo C1-C5, o significa NHR3;
o significa **Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/007528.
Solicitante: SKW STICKSTOFFWERKE PIESTERITZ GMBH.
Nacionalidad solicitante: Alemania.
Dirección: MOLLENSDORFER STRASSE 13 06886 LUTHERSTADT WITTENBERG ALEMANIA.
Inventor/es: NICLAS, HANS-JOACHIM, MICHEL, HANS-JURGEN, WOZNIAK, HARTMUT, RADICS,UTE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01N43/56 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 43/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos heterocíclicos (que contienen anhídridos cíclicos, imidas cíclicas A01N 37/00; que contienen compuestos de fórmula , que no tienen más que un heterociclo en los que m≥1 y n≥0 y es una pirrolidina, una piperidina, una morfolina, una tiomorfolina, una piperazina o una polimetilenoimina, no sustituida o sustituida por un alcoilo, que tiene al menos cuatro grupos CH 2 A01N 33/00 - A01N 41/12; que contienen ácidos ciclopropanocarbhoxílicos o sus derivados, p. ej. ésteres con heterociclos, A01N 53/00). › 1,2-1,2-Diazoles; 1,2-Diazoles hidrogenados.
- A01N43/653 A01N 43/00 […] › Triazoles-1,2,4; Triazoles-1,2,4 hidrogenados.
- C07D231/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 231/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,2 o diazol-1,2 hidrogenado. › con solamente átomos de hidrógeno, radicales hidrocarbonados o hidrocarbonados sustituidos, unidos directamente a los átomos de carbono del ciclo.
- C07D231/16 C07D 231/00 […] › Atomos de halógeno o radicales nitro.
- C07D249/08 C07D […] › C07D 249/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen tres átomos de nitrógeno como únicos heteroátomos del ciclo. › Triazoles 1,2,4; Triazoles 1,2,4 hidrogenados.
PDF original: ES-2397025_T3.pdf
Fragmento de la descripción:
1H-azolil-metil-amidas, procedimiento para su obtención y utilización de las mismas como inhibidores de nitrificación La presente invención se refiere a N- (1H-azolil-metil) amidas, a un procedimiento para su obtención, a composiciones de fertilizantes (abonos) , que las contienen, así como a su utilización para inhibir o regular la nitrificación.
El empleo de abonos nitrogenados, que contienen inhibidores de nitrificación (a continuación llamados inhibidores de nitrificación) , es especialmente ventajoso porque la nitrificación que en general transcurre con rapidez, es decir, la transformación microbiana del nitrógeno de las amidas y amonio en nitrógeno de nitrato, se ralentiza por la presencia de semejantes sustancias que actúan de este modo. Regulando de este modo la formación de nitratos en el suelo se evita que dicha formación de nitrato sea intensa y, por lo tanto, se evita la acumulación de nitratos. La represión resultante del exceso de nitratos en el suelo, que se produciría de otro modo, conserva el nitrógeno del fertilizante en forma de iones amonio, con lo cual se favorece una mayor eficacia fertilizante y al mismo tiempo produce una carga ecológica notablemente reducida en el contexto del abonado nitrogenado.
Ya es sabido que, a diferencia del amonio, el nitrato se absorbe extremadamente mal en el suelo y por consiguiente es objeto de lixiviación o de desplazamiento hacia las capas más profundas del suelo. Por otro lado, la desnitrificación, que se inicia con mayor intensidad como resultado de la acumulación de nitratos en el suelo, se traduce en pérdidas de nitrógeno gaseoso, emitiéndose además del nitrógeno molecular los óxidos de nitrógeno, por ejemplo el monóxido de nitrógeno o el gas hilarante, que contribuyen a la acidificación del suelo o que son conocidos como gases que alteran el clima.
Con la inhibición o la regulación de la nitrificación se contrarresta al mismo tiempo el aumento de la concentración de nitratos en las aguas freáticas.
La ventaja económica de los abonos nitrogenados provistos de inhibidores de nitrificación estriba precisamente en la reducción de las pérdidas potenciales descritas, que se traduce entre otros en una mayor eficacia nutriente de estos fertilizantes. Para subrayarlo cabe mencionar que las pérdidas de N de los abonos nitrogenados convencionales en condiciones desfavorables pueden situarse en cantidades del orden del 40 % o incluso mayores.
Como inhibidores eficaces de nitrificación se han propuesto entre otros los compuestos heterocíclicos nitrogenados, pertenecientes a los grupos de los 1H-pirazoles y los 1, 2, 4-triazoles, descritos p.ej. en US 3, 635, 690, US 4, 969, 946, US 4, 523, 940, EP-A 166420, publicación de patente JP-71-04135, US 3, 697, 244.
Un inconveniente importante de los derivados de pirazol, que por lo general tienen un efecto muy bueno de inhibición de la nitrificación, consiste en su volatilidad relativamente elevada o en especial en el caso de los compuestos sustituidos sobre el átomo de nitrógeno 1-N en su propensión a la hidrólisis, a raíz de la cual se forman derivados que ciertamente siguen siendo activos, pero que también son volátiles. Por estos motivos no es viable sin más su utilización en fertilizantes sólidos, en especial en combinación con la urea. Para superar este inconveniente se han propuesto modificaciones químicas de pirazoles base no sustituidos en la posición 1-N (publicación de patente DE27 45 833, EP-A 508 191, DD 292 232, publicación de patente DE-40 18 395, EP-A 160 804, publicación de patente DE-37 04 359, SU 1 470 737, publicación de patente DE-44 46 194, EP-A 808 297) . Pero la disminución de la volatilidad, consecuencia de la derivatización, suele llevar asociada también una disminución de la eficacia del efecto inhibidor de la nitrificación. Además, estos procedimientos conllevan un coste adicional debido a un mayor número de pasos de síntesis, que inevitablemente se traducen en mayores costes económicos, de modo que su utilización deja de tener sentido en términos económicos.
Otras soluciones para reducir la volatilidad de los pirazoles inhibidores de la nitrificación consisten en aprovechar el principio de por sí conocido de la formación de sales con ácidos (EP-A 529 473, WO 98/05 607, publicación de patente DE-40 18 395) .
Ni los ácidos inorgánicos de los pirazoles base antinitrificantes ni los pirazoles de acción antinitrificante, que llevan grupos hidrófilos en el nitrógeno 1-N son totalmente satisfactorios como inhibidores de nitrificación porque tienen una estabilidad a la hidrólisis demasiado pequeña, con lo cual se reduce el período de su efecto en el suelo y su estabilidad al almacenaje. Esto afecta p.ej. a los N-glioxilpirazoles (DE-A 3704359) o N-hidroximetilpirazoles (SU-A 1 470 737) . Con la introducción de grupos lipófilos de diversas índoles en la posición 1-N (publicación de patente DE-101 17821 A1, publicación de patente DE-101 35423 A 1) puede solucionar el problema de la propensión a la hidrólisis de estos derivados de pirazol, pero estos inhibidores de nitrificación no tienen una eficacia suficientemente duradera cuando sus concentraciones son bajas. Otro inconveniente consiste en los procesos de obtención laboriosos de estas sustancias activas.
Las (1H-azolil-metil) amidas se han publicado en la base de datos llamada Database Chemcats Chemical Abstracts, XP002307753, EP-A-1 342412, DE 2648008 A, EP-A-O 012 216, EP-A-O 006 542, DE 27 42 583 A, SU 666174 A, y Katritzky y col., Tetrahedron 46 (2) , 633-40, 1990.
Es objeto de la presente invención desarrollar sustancias activas para la inhibición o para la regulación de la nitrificación del nitrógeno amónico, que por su volatilidad reducida y su estabilidad a la hidrólisis permitan realizar todos los procedimientos de aplicación y también permitan todas las posibilidades de incorporación o de aplicación a fertilizan
tes nitrogenados inorgánicos y además tengan un efecto residual excelente y con independencia de ello permitan también la aplicación a fertilizantes orgánicos. Estas sustancias activas deberían poder obtenerse al mismo tiempo por una síntesis sin complicaciones y conveniente en términos económicos.
Este objetivo se alcanza con las N- (1H-azolil-metil) amidas que se ajustan a la fórmula I.
En efecto, se ha puesto de manifiesto que estos compuestos, aparte de su excelente efecto inhibidor de la nitrificación, tienen la ventaja extraordinaria de una tendencia muy reducida a la hidrólisis, con lo cual están prácticamente descartadas las pérdidas de sustancia activa en caso de aplicación en superficie, pero también en caso de almacenado de mezclas de fertilizante-sustancia activa. A diferencia de los derivados de azol ya conocidos, la ventaja especial de los compuestos de la presente invención consiste en que no solo pueden combinarse sin problemas con muchos fertilizantes nitrogenados “que contienen nitratos”, por ejemplo el nitrosulfato amónico, y fertilizantes de reacción ácida, por ejemplo el sulfato amónico, sin que tengan que convertirse previamente en sales, para evitar las pérdidas de sustancia activa resultantes de la volatilidad, sino que en virtud de las propiedades descritas pueden formularse con fertilizantes de base urea de un modo especialmente libre de pérdidas. Esto es tanto más digno de mención, cuando se sabe que la urea siempre va acompañada de pequeñas cantidades de amoníaco libre, que desplaza los derivados de azol, que son ligeramente básicos, de su unión con la urea, que es imprescindible para poder desplegar su acción, y, de este modo conduce a concentraciones de inhibidor de nitrificación inferiores a las críticas, que ya no garantizan la inhibición suficiente de la nitrificación.
Además, por su carácter lipófilo y por lo tanto hidrófobo, las 1H-azolil-metil-amidas de la invención son muy apropiadas para la aplicación sobre la superficie de los fertilizantes.
De modo sorprendente, la acción antinitrificante de las N- (1H-azolil-metil) amidas de la invención se despliega plenamente incluso cuando las concentraciones de sustancia activa son muy bajas, lo cual no era previsible. Por este motivo, por ejemplo los derivados de alquil-1H-1-pirazolilmetanamina (DE 19 82 2340 A1) tienen que utilizarse normalmente en una cantidad aplicada doble que las N- (1H-azolilmetil) amidas de la presente invención para conseguir el mismo efecto inhibidor de la nitrificación.
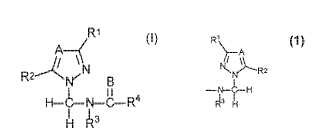
Las N- (1H-azolilmetil) amidas empleadas según la invención como compuestos para inhibir o regular la nitrificación 35 se ajustan a la fórmula general (I)
en la que:
A es CH, C-halógeno, C-alquilo C1-C4 o C-cicloalquilo C3-C8 o N; R1 y R2... [Seguir leyendo]
Reivindicaciones:
1. N- (1H-azolil-metil) amidas de la fórmula general I, caracterizadas porque
A es CH, C-halógeno, C-alquilo C1-C4 o C-cicloalquilo C3-C8 o N; R1 y R2 con independencia entre sí significan H, alquilo C1-C4 o cicloalquilo C3-C8; R3 significa alquilo C1-C4, cicloalquilo C3-C8 o arilo C6-C10 o H;
R4 significa alquilo C1-C20, cicloalquilo C3-C8, arilo C6-C10 o arilalquilo formado por grupos alquilo C1-C4 y arilo C6-C10, los restos arilo de R4 pueden estar eventualmente sustituidos, una o varias veces, por (alquil C1-C4) -sulfonilo, alcoxi C1-C4, acilo C1-C4, halógeno, hidroxilo, ciano, nitro, carboxilo o carboxi-alquilo C1-C5, o significa NHR3;
o significa en la que R1, R2, R3 y A tienen los significados definidos previamente;
o en la que R3 y R4 juntos pueden formar un puente etileno y B significa oxígeno o azufre;
en la que A no puede ser N, cuando R1, R2, R3 son H y R4 significa al mismo tiempo fenilo o -CH=CH-fenilo, A no puede ser CH, cuando R1 es metilo, R2 y R3 son H, B es azufre y R4 significa 2. N- (1H-azolil-metil) amidas según la reivindicación 1, caracterizadas porque con independencia entre sí R1 es un resto metilo y A es un resto C-metilo y, con preferencia, R2 es H.
3. N- (1H-azolil-metil) amidas según la reivindicación 1, caracterizadas porque R1 significa un resto metilo y A significa C-cloro o CH y, con preferencia, R2 es H.
4. Procedimiento de obtención de las N- (1H-azolil-metil) amidas I según las reivindicaciones de 1 a 3, caracterizado porque se hacen reaccionar los azoles correspondientes de la fórmula general II 35
en la que R1, R2 y A tienen los significados definidos anteriormente, con formaldehído y amidas de la fórmula general 5 IV, en la que R3, R4 y B tienen los significados definidos anteriormente.
5. Procedimiento según la reivindicación 4, caracterizado porque la reacción se lleva a cabo a una temperatura entre 100 y 200ºC sin disolventes, en masa fundida y con una proporción molar entre el azol II y el formaldehído y la amida IV de 1:1:1 a 2, 5:3:1.
6. Procedimiento según la reivindicación 5, caracterizado porque la reacción se realiza entre 125 y 145ºC.
7. Procedimiento según la reivindicación 4, caracterizado porque la reacción se realiza a una temperatura entre 40 y
110ºC en agua como disolvente y con una proporción molar entre el azol II y el formaldehído y la amida IV de 1:1:1 a 15 2, 5:3:1.
8. Procedimiento según la reivindicación 7, caracterizado porque se añade un solubilizante elegido entre el grupo de los alcoholes o acetonitrilo.
9. Procedimiento de obtención de las N- (1H-azolil-metil) amidas I según las reivindicaciones de 1 a 3, caracterizado porque se hacen reaccionar los correspondientes 1-hidroximetil-azoles de la fórmula general V
en la que R1, R2 y A tienen los significados definidos anteriormente, con amidas de la fórmula general IV, en la que R3, R4 y B tienen los significados definidos anteriormente.
10. Procedimiento según la reivindicación 9, caracterizado porque se lleva a cabo la reacción añadiendo del 0, 2 al
% de un ácido apropiado, con preferencia de una resina de intercambio iónico ácida. 30
11. Procedimiento según la reivindicación 9, caracterizado porque se realiza la reacción sin disolvente.
12. Uso de las N- (1H-azolil-metil) amidas de la fórmula general (I)
en la que: A es CH, C-halógeno, C-alquilo C1-C4 o C-cicloalquilo C3-C8 o N; R1 y R2 con independencia entre sí significan H, alquilo C1-C4 o cicloalquilo C3-C8;
R3 significa alquilo C1-C4, cicloalquilo C3-C8 o arilo C6-C10 o H; R4 significa alquilo C1-C20, cicloalquilo C3-C8, arilo C6-C10 o arilalquilo formado por grupos alquilo C1-C4 y arilo C6-C10, los restos arilo de R4 pueden estar eventualmente sustituidos, una o varias veces, por (alquil C1-C4) -sulfonilo, alcoxi C1-C4, acilo C1-C4, halógeno, hidroxilo, ciano, nitro, carboxilo o carboxi-alquilo C1-C5, o significa NHR3;
o significa en la que R1, R2, R3 y A tienen los significados definidos previamente;
o en la que R3 y R4 juntos pueden formar un puente etileno y B significa oxígeno o azufre; 10 como compuestos para inhibir o regular la nitrificación.
13. Composición, que contiene las N- (1H-azolil-metil) amidas según las reivindicaciones de 1 a 3 y eventualmente otros inhibidores de nitrificación y/o inhibidores de ureasa en combinación con fertilizantes que contienen grupos amonio y/o amida, sólidos o líquidos.
14. Composición según la reivindicación 13, caracterizada porque las N- (IH-azolil-metil) amidas y los demás inhibidores de nitrificación y/o inhibidores de ureasa eventualmente presentes se emplean en una cantidad total del 0, 01 al 10, 0 por ciento en peso, porcentajes referido ala porción de nitrógeno reducido del fertilizante que contiene grupos amida- y/o amonio.
15. Composición según la reivindicación 14, caracterizada porque las N- (1H-azolil-metil) amidas se emplean en una cantidad del 0, 1 al 3, 0 por ciento en peso.
16. Composición según las reivindicaciones de 13 a 15, caracterizada porque las N- (1H-azolil-metil) amidas se incor
poran a la masa fundida o a la suspensión del fertilizante solas o en combinación con otros aditivos durante el proceso de moldeo y de este modo se hallan repartidas de forma homogénea dentro del fertilizante.
17. Composición según las reivindicaciones de 13 a 15, caracterizada porque las N- (1H-azolil-metil) amidas y even
tualmente otros aditivos se aplican en forma de solución o junto con un agente acondicionador apropiado sobre la 30 superficie de los granulados de fertilizante y eventualmente después se elimina el disolvente por secado.
Patentes similares o relacionadas:
Composición fungicida para uso agrícola y hortícola, del 22 de Julio de 2020, de NIPPON SODA CO., LTD.: Una composición fungicida para su uso agrícola y hortícola, que comprende: un compuesto representado por la fórmula (a-5), **(Ver fórmula)** y […]
Mezclas sinergícas de Bacillus Thuringiensis subsp. kurstaki y de clorantraniliprol para el control de plagas de las plantas, del 6 de Mayo de 2020, de Valent BioSciences LLC: Un procedimiento para controlar una plaga de planta de cultivo seleccionada del grupo que consiste en polilla dorso de diamante (Plutella xylostella), gardama […]
Mezclas fungicidas sinérgicas para el control fúngico del añublo en arroz, del 6 de Mayo de 2020, de DOW AGROSCIENCES LLC: Una mezcla fungicida sinérgica que comprende: una cantidad fungicidamente eficaz de triciclazol: **(Ver fórmula)** y benzovindiflupir.
Compuesto de pirazolona o una sal del mismo, método de preparación del mismo, composición herbicida y uso de la misma, del 29 de Abril de 2020, de Qingdao Kingagroot Chemical Compounds Co., Ltd: Un compuesto de pirazolona de fórmula l o una sal del mismo: **(Ver fórmula)** en donde, R1R2N representa un grupo heterocíclico que contiene nitrógeno, […]
Derivados de semi-carbazonas y tiosemicarbazonas activos como plaguicidas, del 22 de Abril de 2020, de SYNGENTA PARTICIPATIONS AG: Un compuesto de fórmula I, **(Ver fórmula)** en el que, Ar1 y Ar2 son, independientemente uno del otro, fenilo, tienilo, piridilo, pirimidinilo, pirazinilo, piridazinilo, […]
Mezclas plaguicidas que comprenden un compuesto de pirazol, del 25 de Marzo de 2020, de BASF SE: Mezcla plaguicida que comprende como compuestos activos 1) al menos un compuesto A de pirazol seleccionado de los compuestos de formula […]
Procedimiento de tratamiento de enfermedades roya del café, mancha negra de los cítricos, sarna de los cítricos y sigatoka negra del plátano, del 4 de Marzo de 2020, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Un procedimiento de tratamiento de plantas que necesitan control de la enfermedad roya del café, mancha negra de los cítricos, sarna de los […]
Uso de pirrolidonas N-sustituidas para promover la penetración de ingredientes activos agroquímicos, del 4 de Marzo de 2020, de CLARIANT INTERNATIONAL LTD.: Uso de una o varias pirrolidonas N-sustituidas de fórmula (I) **(Ver fórmula)** en donde R es un grupo alquilo saturado lineal o ramificado […]