MÉTODO PARA PRODUCIR CELULAS TRONCALES MESENQUIMALES DERIVADAS DE TEJIDO ADIPOSO, ASÍ COMO LAS CÉLULAS TRONCALES MESENQUIMALES OBTENIDAS POR DICHO MÉTODO.
Método para producir células troncales mesenquimales derivadas de tejido adiposo,
así como las células troncales mesenquimales obtenidas por dicho método.
La presente invención describe un método para producir células troncales mesenquimales derivadas de tejido adiposo obtenido de mamíferos que comprende las fases de obtención de la muestra de tejido adiposo, purificación y fragmentación de la misma; aislamiento de las células troncales mesenquimales; cultivo y expansión in vitro; caracterización y diferenciación de la población celular por inducción adipogénica, osteogénica o condrogénica para promover su diferenciación hacia células de tejido adiposo, óseo o cartilaginoso. La muestra de tejido adiposo se mantiene a temperatura ambiente antes de ser sometida a digestión enzimática, manteniendo la mezcla en reposo y evitando el filtrado. Las células obtenidas, y en particular, las de fenotipo osteogénico pueden utilizarse para regeneración ósea.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201030673.
Solicitante: UNIVERSIDAD DE LEON.
Nacionalidad solicitante: España.
Inventor/es: IGLESIAS MUÑOZ,JAVIER, RAMOS PASCUA,LUIS RAFAEL, SALDAÑA DÍAZ,ANDRÉS, LÓPEZ LAGUNA,MARTA, RODRÍGUEZ-ALTONAGA MARTÍNEZ,JOSÉ ANTONIO, GONZALO ÓRDEN,JOSÉ MANUEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N5/0775 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre mesenquimales; Células madre derivadas de tejido adiposo.
Fragmento de la descripción:
Método para producir células troncales mesenquimales derivadas de tejido adiposo, así como las células troncales mesenquimales obtenidas por dicho método.
Objeto de la invención
Método para producir células troncales mesenquimales derivadas de tejido adiposo, así como las células troncales mesenquimales obtenidas por dicho método. Dicho método comprende las fases de obtención de la muestra de tejido adiposo, purificación y fragmentación de la misma; aislamiento de las células troncales mesenquimales; cultivo y expansión in vitro; y caracterización y diferenciación de la población celular por inducción adipogénica, osteogénica o condrogénica para promover su diferenciación hacia células de tejido adiposo, óseo o cartilaginoso. La muestra de tejido adiposo se mantiene a temperatura ambiente antes de ser sometida a digestión enzimática, manteniendo la mezcla en reposo y evitando el filtrado. Las células obtenidas, y en particular, las de fenotipo osteogénico pueden utilizarse para regeneración ósea.
Campo técnico de la invención
La presente invención se refiere a un método para producir células troncales mesenquimales (ADMSCs) derivadas de tejido adiposo, así como las células troncales mesenquimales obtenidas por dicho método, para su posible utilización en reparación ósea.
Estado de la técnica anterior a la invención
El sistema óseo presenta una gran capacidad regenerativa que, sin embargo, es limitada. Las estrategias terapéuticas actuales en relación con la reparación ósea, cuando es necesaria ante defectos esqueléticos de diferente naturaleza, se refieren al empleo de injertos y sustitutivos óseos, que muestran propiedades particulares y, derivadas de ellas, ventajas e inconvenientes para su uso. La terapia celular y las técnicas de ingeniería tisular se han desarrollado en los últimos años como alternativa a algunas de las limitaciones de aquellos procedimientos. En este contexto, la terapia con células troncales de naturaleza mesenquimal está adquiriendo cada vez más importancia en el tratamiento de diferentes patologías óseas.
Desde que Phemister, en 1947, utilizara la inyección de células troncales mesenquimales de médula ósea (BMMSCs) en pacientes con pseudoartrosis (Phemister MD. Treatment of ununited fractures by onlay bone grafts without screw or tie fixation and without breaking down of the fibrous unión. J Bone Joint Surg, 1947;29:946-60) y, en las décadas posteriores, Burwell definiera la capacidad regenerativa de la médula ósea de la cresta ilíaca (Burwell RG. Studies in the transplantation of bone. VII. The fresh composite homograft-autograft of cancellous bone; an analysis of factors leading to osteogenesis in marrow transplants and in marrow-containing bone grafts. J Bone Joint Surg 1964;46B:110-40), el implante de células mesenquimales para el tratamiento de diferentes tipos de lesiones óseas ha ido adquiriendo cada vez más importancia. Se han ensayado con éxito como tratamiento percutáneo de necrosis óseas y en fracturas; y se continúa investigando para utilizarlas en la reparación de defectos óseos mayores con técnicas de ingeniería tisular. Estas técnicas comprenden la utilización combinada de grandes poblaciones celulares, andamiajes que actúen como vector para las células y factores de crecimiento.
En los últimos años se han descrito nuevos orígenes tisulares a partir de los que poder aislar células troncales mesenquimales con un potencial similar al de la médula ósea. Es el caso de la placenta, el cordón umbilical o el tejido adiposo, siendo éste la alternativa más interesante dada su abundancia y accesibilidad, en contraste con la limitada cantidad de tejido medular que se puede obtener y con la dificultad y morbilidad asociadas a su extracción. Por otra parte, parecen no existir diferencias significativas entre las ADMSCs y las BMMSCs en cuanto a rendimiento de células adherentes, cinética de crecimiento, senescencia celular y capacidad de diferenciación; existiendo incluso investigaciones recientes que afirman que a partir del tejido adiposo se obtiene un mayor número de células madre mesenquimales y con mayor capacidad proliferativa que las que se aíslan de la médula ósea. Algunas publicaciones en relación con la utilización de células de origen adiposo son:
- Zuk P A, Zhu M, Ashjian P, De Ugarte D A, Huang J I, Mizuno H, Alfonso Z C, Fraser J K, Benhaim P, Hedrick M H. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell, 2002, 13:4279-4295.
- Fraser J K, Wulur I, Alfonso Z, Hedrick M H. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol 2006; (24) :150-4;
_ Kern S, Eichler H, Stoeve J, Klüter K, Bieback K. Comparative Analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells 2006; 24:1294-301.
- Zuk P A, Zhu M, Mizuno H, Huang J, Futrell J W, Katz A J, Benhaim P, Lorenz H P, Hedrick M H. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng 2001; 7:211- 28.
En la misma línea, se ha demostrado que las ADMSCs son capaces de adquirir fenotipos de hueso, cartílago, grasa o miocardio, además de piel y neuronas, dependiendo del microambiente que se cree mediante la adición in vitro de determinados factores de crecimiento y proteínas.
Aunque las técnicas de obtención y diferenciación osteoblástica de las ADMSCs han sido bastante estudiadas en los últimos años, la mayoría de los estudios in vitro utilizan células procedentes de lipoaspirados humanos (Dragoo J L, Choi J Y, Lieberman J R, Huang J, Zuk P A, Zhang J, Hedrick M H, Benhaim P. Bone induction by BMP-2 transduced stem cells derived from human fat. J Orthop Res 2003;21:622-9), en tanto que los estudios in vivo lo hacen con animales de experimentación pequeños, fundamentalmente roedores y lagomorfos (Wu L, Wu Y, Lin Y, Jing W, Nie X, Qiao J, Liu L, Tang W, Tian W. Osteogenic differentiation of adipose derived stem cells promoted by overexpression of osterix. Mol Cell Biochem 2 007;301:83-92; Peptan I A, Hong L, Mao J J. Comparison of osteogenic potentials of visceral and subcutaneous adipose-derived cells of rabbits. Plast Reconstr Surg, 2006;117:1462-70).
Son conocidos también algunos estudios relacionados con la necesidad de trabajar con modelos animales de mayor tamaño, más próximos al humano por razones de peso, estructura y capacidad de regeneración ósea (Cancedda R, Giannoni P, Mastrogiacomo M. A tissue engineering approach to bone repair in large animal models and in clinical practice. Biomaterials 2 0 07;28:4240-50; Reichert J C, Saifzadeh S, Wullschleger M E, Epari D R, Schütz M A, Duda G N, Schell H, van Griensven M, Redi H, Hutmacher D W. The challenge of establishing preclinical models for segmental bone defect research. Biomaterials 2009;30:2149-63).
Descripción de la invención
En vista de las circunstancias descritas anteriormente, el objeto de la presente invención es un método para producir células troncales mesenquimales (ADMSCs) derivadas de tejido adiposo para su posible utilización en reparación ósea. El método comprende las fases de obtención del tejido adiposo, purificación y fragmentación, aislamiento, cultivo, caracterización y diferenciación de células troncales de tejido adiposo a otras de tipo adiposo, condrogénicas o osteogénicas que podrían usarse en estudios preclinicos utilizando como modelo experimental mamíferos como por ejemplo ovejas, con las que los estudios realizados hasta la fecha han sido escasos.
Es objeto de la presente invención que las poblaciones celulares aisladas mediante el método descrito, bajo condiciones de cultivo específicas, sean capaces de mostrar características específicas de las células óseas (mineralización de la matriz extracelular), cartilaginosas (morfología condrocítica y síntesis de proteoglicanos ácidos) y adiposas (acumulación intracelular de lípidos), lo que la Sociedad Internacional de Investigación con Células Madre (ISSCR) considera fundamental para que las células troncales mesenquimales sean consideradas como tales.
Para la presente invención se definen las células troncales mesenquimales...
Reivindicaciones:
1. Método para producir células troncales mesenquimales derivadas de tejido adiposo obtenido de mamíferos que comprende las fases de:
a) obtención de la muestra de tejido adiposo, purificación y fragmentación de la misma;
b) aislamiento de las células troncales mesenquimales;
c) cultivo y expansión in vitro;
d) caracterización y diferenciación de la población celular por inducción adipogénica, osteogénica o condrogénica para promover su diferenciación hacia células de tejido adiposo, óseo o cartilaginoso;
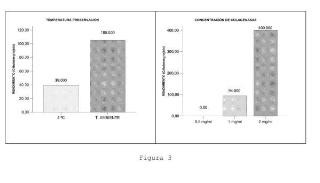
caracterizado porque la muestra de tejido adiposo obtenida se preserva a temperatura ambiente igual o superior a 15ºC, sometiendo la muestra a digestión enzimática con colagenasa y manteniendo la mezcla en reposo.
2. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicación 1, caracterizado porque la muestra de tejido adiposo obtenida se preserva a temperatura ambiente entre 18ºC-22ºC.
3. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores, caracterizado porque la digestión enzimática de la muestra es con una concentración de colagenasa tipo I de 2 mg/ml.
4. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores caracterizado porque el mamífero es no humano.
5. Método para producir células troncales mesenquimales derivadas de tejido adiposo según las reivindicaciones anteriores caracterizado porque el mamífero es una oveja.
6. Método para producir células troncales mesenquimales derivadas de tejido adiposo de mamífero según reivindicaciones anteriores caracterizado porque la muestra de tejido adiposo se obtiene en un único tiempo quirúrgico bajo estrictas condiciones de esterilidad y asepsia.
7. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones 4 y 5 caracterizado porque la muestra de tejido adiposo se obtiene de la cola del mamífero en un único tiempo quirúrgico bajo estrictas condiciones de esterilidad y asepsia.
8. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores caracterizado porque las muestras de tejido adiposo digerido se centrifugan a 2000 rpm y, tras desechar el sobrenadante, la fracción del estroma vascular (SVF) es resuspendida en medio de cultivo de ADMSCs del tipo DMEM suplementado con un 10% de suero bovino fetal, 1% de Penicilina/Estreptomicina, un 1% de Glutamina y 2,5 ng/ml de factor de crecimiento fibroblástico.
9. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores, caracterizado porque las suspensiones celulares obtenidas tras la fase de aislamiento se siembran en pocillos de 2 cm2 a una densidad de 30.000 células/cm2, e incubadas a 37ºC y 5% de CO2 en atmósfera húmeda, sometiéndose después los cultivos a un lavado con PBS para eliminar el componente eritrocitario, quedando en los pocillos únicamente las células ADMSCs capaces de adherirse a ellos; cambiando cada 2-3 días el medio de cultivo y, tripzinizando cultivos una vez alcanzado el estado de preconfluencia.
10. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores caracterizado porque las ADMSCs son diferenciadas hacia células de fenotipo adipocitico, mediante su cultivo en medio adipogénico del tipo DMEM, 10% suero bovino fetal, 1% penicilina/estreptomicina, 1% L-glutamina, 1 μM dexametasona, 0,5 mM IBMX, 10 μM insulina y 200 μM indometacina.
11. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores donde las ADMSCs son diferenciadas hacia células de fenotipo condrogénico mediante su cultivo en medio condrogénico del tipo DMEM, 1% suero bovino fetal, 1% penicilina/estreptomicina, 1% L-glutamina, 50 μg/ml ácido ascórbico, 6,25 μg/ml insulina y 10 ng/ml TGF β1.
12. Método para producir células troncales mesenquimales derivadas de tejido adiposo según reivindicaciones anteriores caracterizado porque las ADMSCs son diferenciadas hacia células de fenotipo osteogénico mediante su cultivo en medio osteogénico del tipo DMEM, 5% suero bovino fetal, 1% penicilina/estreptomicina, 1% L-glutamina, 10 μM dexametasona, 150 mM ácido L-ascórbico y 10 mM β-glicerolfosfato, completando la inducción con la adición al medio de 10 ng/ml de proteína morfogenética 2 (BMP2).
13. Células troncales mesenquimales derivadas de tejido adiposo caracterizadas porque son obtenidas según el método de acuerdo a las reivindicaciones anteriores.
Patentes similares o relacionadas:
Función promotora del crecimiento del cabello de células madre de tamaño pequeño y uso de las mismas, del 6 de Mayo de 2020, de MEDIPOST, CO., LTD.: Una composición para su uso en la terapia de pérdida de cabello para prevenir la pérdida de cabello y estimular el crecimiento del cabello, que comprende: células […]
Terapia con células madre basada en células madre procedentes de tejido adiposo, del 6 de Mayo de 2020, de RIGSHOSPITALET: Una composición que comprende una suspensión de una población sustancialmente homogénea e inmunosupresora de células madre procedentes de tejido adiposo (ASC) humanas adultas […]
Métodos y composiciones para modular la diferenciación de células pluripotenciales, del 1 de Abril de 2020, de SANBIO, INC: Método para restringir el potencial de una célula estromal adherente de médula para diferenciarse en un linaje condrogénico, comprendiendo […]
Composiciones y métodos de células grasas marrones, del 1 de Abril de 2020, de Biorestorative Therapies, Inc: Un método para generar una célula grasa marrón, el método comprende: aislar una célula madre de un tejido graso marrón obtenido; y cultivar la célula […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en hepatocitos, del 26 de Febrero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en hepatocitos, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava a un medio […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en neuronas, del 26 de Febrero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en neuronas, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava a un […]
Método para la producción de célula madre pluripotente inducida a partir de célula madre mesenquimatosa y célula madre pluripotente inducida producida mediante el método, del 12 de Febrero de 2020, de BBHC Co. Ltd: Método para la producción de una célula madre pluripotente inducida, comprendiendo el método: añadir un extracto de Ecklonia cava a un medio […]
Método de proliferación celular y agente farmacéutico para reparación y regeneración de tejido, del 12 de Febrero de 2020, de Sapporo Medical University: Método para hacer crecer células madre mesenquimatosas humanas en una muestra recogida de un sujeto vivo cultivando las células en un medio, comprendiendo […]