Ensayo de diagnóstico, predictivo y de prognosis para el cáncer.
Un método para determinar un protocolo de tratamiento para un sujeto que tiene cáncer,
comprendiendo elmétodo las etapas de:
(a) evaluar el nivel de un primer biomarcador seleccionado de al menos uno de Mcm2 a 7 en una muestra biológica del sujeto; y
(b) evaluar el nivel de un segundo biomarcador seleccionado de al menos uno de geminina, Aurora A, Plk1,y Ki67 en la muestra biológica del sujeto;
en el que la combinación del nivel del primer biomarcador comparado con un valor predeterminado y el nivel delsegundo biomarcador comparado con un valor predeterminado es indicativa del régimen de tratamiento prescritopara el sujeto;
en el que cuando el nivel del primer biomarcador comparado con un valor predeterminado es bajo, y el nivel delsegundo biomarcador comparado con un valor predeterminado es bajo, el protocolo de tratamiento se selecciona deuno o más de:
(i) un control; y
(ii) un tratamiento con agentes quimioterapéuticos no específicos de la fase del ciclo celular;
en el que cuando el nivel del primer biomarcador comparado con un un valor predeterminado es alto, y el nivel delsegundo biomarcador comparado con un valor predeterminado es bajo, el protocolo de tratamiento se selecciona deuno o más de:
(i) un control;
(ii) un tratamiento con agentes específicos de G1 o no específicos de la fase del ciclo celular; y
(iii) un tratamiento con agentes quimioterapéuticos no específicos de la fase del ciclo celular S y G2/M; y
en el que cuando el nivel del primer biomarcador comparado con un un valor predeterminado es alto, y el nivel delsegundo biomarcador comparado con un valor predeterminado es alto, el protocolo de tratamiento se selecciona deuno o más de:
(i) la cirugía; y
(ii) un tratamiento con agentes quimioterapéuticos específicos de la fase del ciclo celular S y G2/M.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2008/003501.
Solicitante: CAMBRIDGE CANCER DIAGNOSTICS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: CROWN POINT ELY CAMBRIDGESHIRE CB7 4AU REINO UNIDO.
Inventor/es: STOEBER,KAI, WILLIAMS,GARETH HAYDEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
PDF original: ES-2395890_T3.pdf
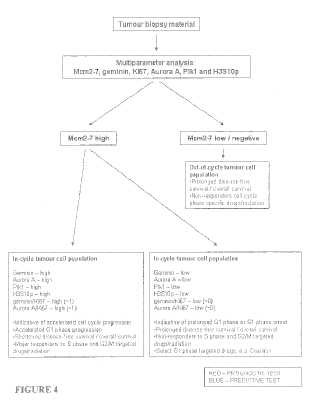
Fragmento de la descripción:
Ensayo de diagnóstico, predictivo y de prognosis para el cáncer
Campo de la invención La presente invención se refiere, en general, al campo del cáncer. En particular, la presente invención se refiere a protocolos de prognosis y de tratamiento del cáncer.
Antecedentes La mayoría de las células del cuerpo humano están presentes en estados no proliferativos, fuera de ciclo, y sólo una población minoritaria está en ciclo activo. Estas células en ciclo están localizadas principalmente en compartimentos amplificadores de células en tránsito y precursoras de tejidos en autorrenovación, tales como el cérvix, el colon o la piel. En contraste, la mayoría de las células funcionales (por ejemplo, hepatocitos) están presentes en en un estado quiescente (G0) , detenido de modo reversible, o se han retirado irreversiblemente del ciclo de división celular mitótica hacia estados diferenciados de fase final (por ejemplo, neuronas, miocitos, o células epiteliales colónicas superficiales) . Los cánceres, por el contrario, se caracterizan por un crecimiento celular incontrolado y, por tanto, contienen una alta proporción de células en ciclo.
Las células responden a mitógenes en su entorno en un momento discreto en G1, denominado punto de restricción. La ausencia de mitógenos no afecta al avance del ciclo celular a través de la fase S, G2 y M hasta que las células vuelven a su ventana sensible en G1. En respuesta a una alta densidad celular o a la privación de mitógenos, las células acumulan un contenido en ADN 2N y salen hacia G0. Las transiciones de fases del ciclo celular están dirigidas por cambios en las parejas de ciclina-CDK. La ciclina D-CDK4, la ciclina D-CDK6, y la ciclina E-CDK2 regulan G0/G1, y son necesarias para la actividad E2F completa. La fase S es iniciada por la ciclina A-CDK2, y la ciclina B-CDK1 regula el avance a través de G2 y la entrada en la mitosis. Lo que distingue a las células en los estados fuera de ciclo de las células dentro del ciclo sigue sin estar aclarado.
El cáncer es un grupo complejo de enfermedades heterogéneas provocadas por la acumulación de mutaciones génicas, que aumentan la actividad de genes reguladores que estimulan la proliferación celular y disminuyen la actividad de proteínas que normalmente la reprimen. La activiciaón de oncogenes estimuladores dominantes o la inactivación de genes supresores de tumores recesivos a través de mutaciones puntuales, amplificación de genes, hipermetilación, translocación, o interacción con oncoproteínas víricas, puede afectar a todos los niveles de las vías de señalización del crecimiento que incluyen mitógenos, receptores de factores del crecimiento mitogénicos, Ras, Raf, ABL, PI3 quinasa AKt corriente arriba de moléculas tales como p16INK4A, Myc, ciclina D, ciclina E, pRB y p53 corriente abajo.
La formación de perfiles de expresión de genes en micromatrices es perfectamente adecuada para el análisis de las complejas alteraciones discontinuas, interactivas y multifactoriales en la expresión génica que caracterizan la tumorigénesis y en la actualidad es un área de investigación intensiva dirigida a la identificación de firmas moleculares exclusivas que puedan aprovecharse para el diagnóstico y la prognosis del cáncer. De manera interesante, las matrices de expresión incluyen una firma de proliferación, genes cuyo patrón de expresión se correlaciona con un grado del tumor (estado de diferenciación) , estado del ciclo celular y tiempos de duplicación. Esta firma de proliferación es uno de los patrones de expresión génica más destacados observados en los conjuntos de datos de tumores, independientemente del tejido del que se derive, e incluye muchos genes regulados por el ciclo celular, tales como E2F1, BUB1, PLK1, ciclicinas E1, D1 y B1.
Por desgracia, la actuación real de las reglas de predicción que emplean la expresión génica no ha resultado ser tan informativa como parecía que iba a a ser en un principio para muchos tipos de tumores, y la lista de genes identificados puede ser muy inestable. Por ejemplo, la mayoría de las reglas predictivas que emplean la expresión génica no han proporcionado una clasificación de prognosis significativamente mejorada para el cáncer de mama cuando se comparan con los criterios clinicopatológicos convencionales, tales como el estado de diferenciación del tumro, el grado de difusión y el índice de proliferación. En efecto, se ha descubierto que muchas de las firmas génicas publicadas que predicen una supervivencia sin metástasis distante en cánceres se correlacionan significativamente con el estado de diferenciación.
La estrategia de micromatrices global para la identificación de firmas de proliferación clínicamente útiles tiene una restricción potencial. En primer lugar, la estrategia de micromatrices en una parte presupone un modelo de tumor de un único compartimento, en el que los cánceres están compuestos de células en crecimiento exponencial en proliferación. Sin embargo, los neoplasmas son muy heterogéneos con respecto al estado del ciclo celular de las células tumorales individuales. Por ejemplo, en tumores de grado bajo bien diferenciados, sólo una fracción muy pequeña de las células tumorales clonogénicas pueden estar en ciclo, y la mayoría ya han ejecutado sus programas de diferenciación y se han retirado irreversiblemente del ciclo hacia un estado diferenciado (compartimento estéril) . Así, los trastornos hiperproliferativos benignos (por ejemplo, hiperplasia) y el crecimiento reparador fisiológico, condiciones patológicas reactivas que contienen un gran número de células mitóticas, pueden tener unas firmas de proliferación mayores que los cánceres bien diferenciados.
En segundo lugar, las células tumorales in vivo también pueden retirarse irreversiblemente del ciclo hacia un estado G0 no proliferativo. En efecto, en muchos tumores, las células no proliferativas son mayoría; es decir, la fracción en crecimiento (la proporción de células proliferativas frente a las células totales) es menor que 0, 5. Esta situación quizás no es sorprendente, porque los tejidos normales están compuestos de elementos mixtos en proliferación y en no proliferación, y un remanente de este comportamiento complejo está arraigado en la mayoría de los cánceres. La presencia de células neoplásicas benignas contaminantes, estroma tumoral, folículos linfoides, infiltrados inflamatorios intra- y peritumorales, y otros tejidos conectivos, tales como vasos sanguíneos, también distorsiona el análisis añadiendo un gran número de células con otras cinéticas complejas del ciclo celular. Por tanto, es probable que la cinética compleja y heterogénea del ciclo celular dentro de tumores individuales dificulte la identificación de firmas de proliferación de micromatrices clínicamente útiles, un problema que también ha restringido el uso de la citometría de flujo en la práctica clínica habitual.
El uso de la citometría de flujo también ha conducido a un impacto limitado, puesto que las muestras clínicas a menudo no son adecuadas para estos análisis. Esto es debido parcialmente a los artefactos de fijación, a cantidades inadecuadas de tejido, y a dificultades en la interpretación debido a poblaciones contaminantes procedentes del estroma reactivo y/o elementos beningnos.
La evaluación de los marcadores de proliferación celular no ha proporcionado previamente ninguna solución de prognosis y predictiva, y los expertos en la técnica han sido escépticos al respecto de que los marcadores de proliferación proporcionen información clínica útil. Existe la creencia de que los parámetros de medición de la proliferación celular proporcionan información objetiva acerca de los tumores, pero a pesar de numerosos estudios hay pocas pruebas directas de que el uso de ciertos marcadores de la proliferación celular son realmente una mejora frenta a la evaluación histológica convencional que se ha empleado de manera óptima. Pocos estudios han tratado la cuestión crítica del valor relativo de los marcadores de proliferación comparados con la estadificación clínica y la clasificación histopatológica convencional.
Aunque la expresión génica se ha aplicado a la predicción del resultado de cánceres, la actuación real de la reglas de predicción que emplean la expresión génica no ha resultado ser tan informativa como parecía que iba a a ser en un principio. Por ejemplo, en la actualidad, la mayoría de las reglas predictivas que emplean la expresión génica no ha proporcionado una clasificación de prognosis significativamente mejorada cuando se compara con los factores de prognosis NPI convencionales en el cáncer de mama. Por tanto, se requiere con urgencia la identificación de nuevos biomarcadores... [Seguir leyendo]
Reivindicaciones:
1. Un método para determinar un protocolo de tratamiento para un sujeto que tiene cáncer, comprendiendo el método las etapas de:
(a) evaluar el nivel de un primer biomarcador seleccionado de al menos uno de Mcm2 a 7 en una muestra biológica del sujeto; y
(b) evaluar el nivel de un segundo biomarcador seleccionado de al menos uno de geminina, Aurora A, Plk1, y Ki67 en la muestra biológica del sujeto;
en el que la combinación del nivel del primer biomarcador comparado con un valor predeterminado y el nivel del segundo biomarcador comparado con un valor predeterminado es indicativa del régimen de tratamiento prescrito para el sujeto;
en el que cuando el nivel del primer biomarcador comparado con un valor predeterminado es bajo, y el nivel del segundo biomarcador comparado con un valor predeterminado es bajo, el protocolo de tratamiento se selecciona de uno o más de:
(i) un control; y
(ii) un tratamiento con agentes quimioterapéuticos no específicos de la fase del ciclo celular;
en el que cuando el nivel del primer biomarcador comparado con un un valor predeterminado es alto, y el nivel del segundo biomarcador comparado con un valor predeterminado es bajo, el protocolo de tratamiento se selecciona de uno o más de:
(i) un control;
(ii) un tratamiento con agentes específicos de G1 o no específicos de la fase del ciclo celular; y
(iii) un tratamiento con agentes quimioterapéuticos no específicos de la fase del ciclo celular S y G2/M; y
en el que cuando el nivel del primer biomarcador comparado con un un valor predeterminado es alto, y el nivel del segundo biomarcador comparado con un valor predeterminado es alto, el protocolo de tratamiento se selecciona de uno o más de:
(i) la cirugía; y
(ii) un tratamiento con agentes quimioterapéuticos específicos de la fase del ciclo celular S y G2/M.
2. El método de la reivindicación 1, que comprende además evaluar el nivel de un tercer biomarcador que es H3S10ph en la muestra biológica de dicho sujeto.
3. El método según la reivindicación 1, en el que la muestra biológica se selecciona del grupo que consiste en biopsia de tumor, tejido, sangre completa, plasma sanguíneo, suero sanguíneo, frotis del cérvix, orina, lavado bronquial, esputo y cepillado del tracto alimentario.
4. El método según la reivindicación 1, en el que el nivel del primer y segundo biomarcador se determina utilizando un método de ensayo inmunológico.
5. El método según la reivindicación 4, en el que el método de ensayo inmunológico se selecciona del grupo que consiste en un análisis de la transferencia por puntos, un análisis de la transferencia por ranuras, RIA, una micromatriz peptídica, y ELISA.
6. El método según la reivindicación 1, en el que el nivel del primer y segundo biomarcador se determina utilizando un método de ensayo con base biológica molecular.
7. El método según la reivindicación 6, en el que el método de ensayo con base biológica molecular se selecciona del grupo que consiste en un análisis de la transferencia Northern, un análisis de la transferencia Southern, un análisis de la transferencia Western, RT-PCR, PCR, ensayos de amplificación basados en la secuencia de ácidos nucleicos (NASBA) , una amplificación mediada por transcripción (TMA) , o una matriz de detección por ordenador.
8. El método según la reivindicación 1, en el que el sujeto tiene un cáncer seleccionado del grupo que consiste en cáncer de mama, cáncer endometrial, cáncer ovárico, cáncer ovárico epitelial, cáncer de pulmón, cáncer de próstata, cáncer de riñòn, cáncer de vejiga, cáncer de la mucosa oral, cáncer esofágico, cáncer del sistema linforreticular, cáncer de cerebro, cáncer genitourinario, cáncer de piel, cáncer de colon, cáncer de estómago, cáncer de vejiga, cáncer del uréter, y cáncer del tracto aereodigestivo.
9. El método según la reivindicación 1, en el que el primer y el segundo biomarcador pueden medirse de modo secuencial o al mismo tiempo.
10. El método según la reivindicación 1, en el que el nivel del primer biomarcador se mide antes de medir el nivel del segundo biomarcador.
11. Un método para determinar una prognosis del avance de un cáncer en un sujeto, comprendiendo dicho método las etapas de:
(a) evaluar el nivel de un primer biomarcador seleccionado de al menos uno de Mcm2-7 en una muestra biológica del sujeto; y
(b) evaluar el nivel de un segundo biomarcador seleccionado de al menos uno de geminina, Aurora A, Plk1, Ki67 y H3s10ph en la muestra biológica del sujeto;
en el que la combinación del nivel del primer biomarcador comparado con un valor predeterminado y el nivel del segundo biomarcador comparado con un valor predeterminado es indicativa del avance del cáncer en el sujeto;
en el que cuando el nivel del primer biomarcador comparado con un valor predeterminado es bajo, y el nivel del segundo biomarcador comparado con un valor predeterminado es bajo, la prognosis del sujeto es indicativa de una probabilidad reducida del avance del cáncer;
en el que cuando el nivel del primer biomarcador comparado con un valor predeterminado es alto, y el nivel del segundo biomarcador comparado con un valor predeterminado es bajo, la prognosis del sujeto es indicativa de una probabilidad reducida del avance del cáncer; y
en el que cuando el nivel del primer biomarcador comparado con un valor predeterminado es alto, y el nivel del segundo biomarcador comparado con un valor predeterminado es alto, la prognosis del sujeto es indicativa de una probabilidad aumentada del avance del cáncer; y
en el que el valor predeterminado para el primer biomarcador es de 30% de células positivas para el primer biomarcador y el valor predeterminado para el segundo biomarcador es de 7% de células positivas para el segundo biomarcador.
12. El método de la reivindicación 11, que comprende además evaluar el nivel de un tercer biomarcador que es H3S10ph en la muestra biológica de dicho sujeto.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]