Alergoides derivados de alérgenos.
Alérgenos modificados que tienen alergenicidad reducida comparado con el correspondiente material alergéniconatural,
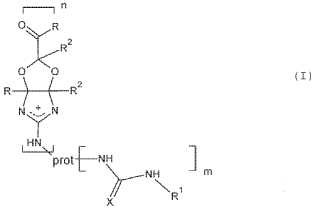
y caracterizados porque todos o una parte de los grupos amina primaria de los restos de lisina y arginina delas moléculas alergénicas se funcionalizan como se muestra en la estructura (I), y porque dichos alérgenosmodificados tienen la siguiente estructura (I):
en la que:
R y R2 se seleccionan independientemente de H, alquilo C1-C5, fenilo, opcionalmente sustituido en orto, meta o paracon un grupo hidroxi, alcoxi C1-C4, halógeno, amino, alquilamino, dialquilamino, mercapto, alquilmercapto C1-C4;X representa O, S o NR3, en el que R3 es H, alquilo con 1-6 átomos de carbono, fenilo o CN;
R1 representa H, alquilo con 1-8 átomos de carbono, fenilo o arilalquilo con hasta 8 átomos de carbono, o alquiloque contiene un anillo heterocíclico;
prot representa el resto de proteína del alérgeno;
n es el número de grupos arginina funcionalizados, y está en el intervalo entre 1 y el número de grupos argininapresentes en el alérgeno;
m es el número de grupos lisina funcionalizados y está en el intervalo entre 1 y el número de grupos lisina presentesen el alérgeno.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2009/054325.
Solicitante: LOFARMA S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIALE CASSALA, 40 20143 MILANO ITALIA.
Inventor/es: FALAGIANI, PAOLO, MISTRELLO, GIOVANNI, RONCAROLO, DANIELA, ZANOTTA, STEFANIA, ZANONI,Dario.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/35 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Alergenos.
- A61K39/36 A61K 39/00 […] › del polen.
- C07K14/415 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de vegetales.
- C07K14/435 C07K 14/00 […] › de animales; de humanos.
PDF original: ES-2384680_T3.pdf
Fragmento de la descripción:
Alergoides derivados de alérgenos La presente invención se refiere a la preparación de alergoides derivados de alérgenos por funcionalización química, con el fin de reducir el riesgo de inducir efectos secundarios cuando se usan como vacunas antialérgicas en la inmunoterapia de las enfermedades alérgicas.
Las enfermedades alérgicas son causadas por una anomalía del sistema inmunitario y son causadas por la producción de anticuerpos particulares de la clase IgE, específicos contra sustancias ubicuas (denominadas con el término alérgenos) , completamente inocuos por sí mismos, como la mayoría de los pólenes, ácaros, los derivados epiteliales, el veneno de himenópteros, esporas fúngicas, y diferentes alimentos. Dichos anticuerpos IgE son capaces de unirse a un receptor específico que está presente en la membrana, por ejemplo en la membrana de los mastocitos de la mucosa, o de los basófilos, y reaccionando posteriormente con los alérgenos a los que están dirigidos son capaces de inducir la liberación de mediadores (entre ellos, histamina) por las células mencionadas antes, cuyos mediadores finalmente son los verdaderos promotores de la reacción alérgica. Los síntomas alérgicos van desde rinitis-conjuntivitis a urticaria, asma, hasta el choque anafiláctico, siendo este último un suceso que puede ser letal.
Estimaciones recientes indican que más de 20 % de la población que vive en países industrializados padece este tipo de enfermedad que, si persiste en el tiempo y si no se trata de forma adecuada, puede determinar un empeoramiento de los síntomas (por ejemplo, aparición de asma después de una rinitis) y de la sensibilización que se puede extender también a otros alérgenos que afectan todavía más a la calidad de vida de aquellos sujetos que la padecen, y hace más compleja la identificación del remedio terapéutico más adecuado para usar en el tratamiento de la misma.
La terapia de hiposensibilización específica (ITS) , a diferencia de la terapia farmacológica, que se limita a intervenir en los síntomas que luego reaparecen en el momento en el que el efecto del fármaco cesa, es la única forma de tratamiento etiológico de las enfermedades alérgicas capaz de incidir positivamente en las causas que determinan la llamada “marcha alérgica” por la activación de algunos mecanismos inmunológicos que son la base del beneficio clínico inducido por la ITS (Clin. Exp. Allergy. 2008; 38: 1074-88. Update on mechanisms of allergen injection immunotherapy. James LK, Durham SR.; Allergy. 2006; 61 Suppl 81: 11-4. Immunological mechanisms of sublingual immunotherapy. Akdis CA, Barlan IB, Bahceciler N, Akdis M.) .
La ITS consiste en la administración de dosis crecientes de extractos normalizados (vacunas) , obtenidos partiendo de la misma sustancia que causa la enfermedad.
De esta forma, se induce progresivamente una especie de “tolerancia inmunológica” en el paciente frente a dicha sustancia, que es mediada por anticuerpos IgG específicos del alérgeno, también denominados “anticuerpos bloqueantes”, que previniendo por un fenómeno de competición que los anticuerpos IgE reaccionen con el alérgeno al que están dirigidos, inhiben el desencadenamiento de la reacción alérgica y por consiguiente inhiben la aparición de los síntomas.
Las vacunas usadas para la ITS están compuestas de una mezcla bastante compleja de proteínas, es decir, 45 glicoproteínas, componentes contra los que se dirigen los anticuerpos IgE específicos que produce un sujeto alérgico.
Aunque se ha demostrado la eficacia terapéutica de la ITS en una serie de estudios clínicos, no carece de riesgos relacionados con reacciones indeseadas también graves (Immunopharmacol Immunotoxicol. 2008; 30: 153-61. Local and systemic reactions occurring during immunotherapy: an epidemiological evaluation and a prospective safetymonitoring study. Ventura MT, Giuliano G, Buquicchio R, Accettura F, Carbonara M.; Immunol. Allergy Clin. North Am. 2007;27: 295-307, Anaphylactic reactions during immunotherapy. Rezvani M, Bernstein DI; Allergy. 2008; 63:
374. Anaphylactic shock because of sublingual immunotherapy overdose during third year of maintenance dose. Blazowski L.) , que se pueden producir después de la administración de la vacuna. Dichas reacciones pueden ir 55 desde reacciones locales limitadas (habones, eritema, picor, etc.) hasta reacciones sistémicas (agravamiento de los síntomas, asma, hasta choque anafiláctico) ; aunque dicho riesgo se ha reducido considerablemente mediante el uso de vacunas de liberación lenta (vacunas retardadas) o vacunas administradas por vías alternativas a la inyección, en cualquier caso limita el uso de la ITS en la terapia de enfermedades alérgicas, aplicada actualmente a un porcentaje pequeño comparado con todos los pacientes alérgicos identificados después de un examen de diagnóstico adecuado.
Las alergias alimentarias también están aumentando mucho. Recientemente, al contrario de lo que se ha reivindicado hasta hace unos pocos años, en los que la única terapia contra estas formas de alergia parecía estar representada por la eliminación del alimento sospechoso de la dieta, cada vez está más establecida la idea en el 65 campo de la alergología, de que la opción de un procedimiento de ITS específico también es adecuado para las formas de alergia alimentaria. Sin embargo, está claro que el uso de alérgenos naturales para la terapia de las formas de alergia alimentaria tendría los mismos límites (riesgo de efectos indeseados) encontrados en la ITS de las formas de alergia respiratoria. De hecho, dichos riesgos pueden incluso exacerbarse, puesto que estas formas de alergia a menudo implican sujetos de edades de pocos meses o pocos años.
En años recientes, se ha centrado la atención en el desarrollo de vacunas que son más eficaces y con un grado de seguridad mayor. En particular, la identificación de procedimientos de modificación química que son más o menos selectivos, dirigidos a reducir el potencial alergénico de las vacunas conservando su potencial inmunógeno todo lo que sea posible, referido a la capacidad para inducir la formación de anticuerpos IgG capaces de reconocer también, cuando se administran al sujeto, los componentes no modificados (naturales) , que son aquellos a los que está expuesto el sujeto alérgico, y determinar el desarrollo de los síntomas específicos, conduce al desarrollo de los llamados alergoides (J. Allergy Clin. Immunol. 1985;76: 397-401. Modified forms of allergen immunotherapy. Grammer LC, Shaughnessy MA, Patterson R.; Int. Arc. hAllergy Appl. Immunol. 1971; 41: 199-215. Preparation and properties of, allergoids, derived from native pollen allergens by mild formalin treatment. Marsh DG) .
El desarrollo de alérgenos también de origen alimentario en forma de alergoides, y su uso en la inmunoterapia de alergias alimentarias específicas puede realmente ser crucial para proporcionar al sujeto alérgico algún tipo de tolerancia inmunológica, evitando así en el sujeto la aparición de esas reacciones que podrían ser potencialmente mortales después de la ingestión inconsciente de cantidades solo mínimas del alérgeno al que es sensible.
El grado de reducción del potencial alergénico de un extracto inducido por modificación química puede ser diferente de acuerdo con el tipo de reactivo que se usa para la modificación y/o el tipo de extracto. Usando cianato potásico como un reactivo “modificador”, se obtienen los derivados llamados carbamilados, que se caracterizan por una alergenicidad reducida y una inmunogenicidad conservada (Allergy. 1996; 51: 8-15. Monomeric chemically modified allergens: immunologic and physicochemical characterization. Mistrello G, Brenna. O, Roncarolo D, Zanoni D, Gentili M, Falagiani P.) .
Sin embargo, debe notarse que, puesto que los extractos sometidos a modificación química con cianato potásico son mezclas de proteínas muy heterogéneas, el grado de modificación determinado por la dosificación del grupo amino está estrictamente relacionado con el tipo de proteína que está presente, y por lo tanto, el dato que se obtiene expresa un valor medio del grado de modificación. De hecho, puede ocurrir que algunas proteínas alergénicas no sufran significativamente el efecto de la modificación con cianato potásico, y por lo tanto conserven la mayor parte de su actividad alergénica. A nivel del extracto modificado, la conservación opcional de la actividad alergénica por un componente del extracto no puede mostrarse. Sin embargo, durante muchos años se han desarrollado... [Seguir leyendo]
Reivindicaciones:
1. Alérgenos modificados que tienen alergenicidad reducida comparado con el correspondiente material alergénico natural, y caracterizados porque todos o una parte de los grupos amina primaria de los restos de lisina y arginina de las moléculas alergénicas se funcionalizan como se muestra en la estructura (I) , y porque dichos alérgenos modificados tienen la siguiente estructura (I) :
en la que:
R y R2 se seleccionan independientemente de H, alquilo C1-C5, fenilo, opcionalmente sustituido en orto, meta o para con un grupo hidroxi, alcoxi C1-C4, halógeno, amino, alquilamino, dialquilamino, mercapto, alquilmercapto C1-C4;
X representa O, S o NR3, en el que R3 es H, alquilo con 1-6 átomos de carbono, fenilo o CN;
R1 representa H, alquilo con 1-8 átomos de carbono, fenilo o arilalquilo con hasta 8 átomos de carbono, o alquilo que contiene un anillo heterocíclico;
prot representa el resto de proteína del alérgeno;
n es el número de grupos arginina funcionalizados, y está en el intervalo entre 1 y el número de grupos arginina presentes en el alérgeno;
m es el número de grupos lisina funcionalizados y está en el intervalo entre 1 y el número de grupos lisina presentes en el alérgeno.
2. Los alérgenos modificados de acuerdo con la reivindicación 1, en los que dicho material alergénico natural sometido a modificación se puede obtener de ácaros, pólenes, epitelio de animales, micofitos, proteínas de origen alimentario, preferiblemente seleccionadas de proteínas de la leche, huevos, cereales, melocotón, manzana, por extracción de las proteínas alergénicas con un disolvente adecuado; o dicho material alergénico natural está compuesto de proteínas purificadas de las materias primas listadas antes; o dicho material alergénico natural se obtiene en una forma recombinante.
5. Los alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en los que X es O o S, y R1 es hidrógeno. 6. Los alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en los que R es fenilo, R1 y R2 son hidrógeno, y X es O o S. 5 7. Un método para obtener alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 6, que comprende las siguientes etapas: a) reacción de carbamilación o tiocarbamilación de todos o una parte de los restos de lisina de una materia prima 10 alergénica natural; b) posteriormente, reacción de todos o una parte de los restos de arginina de dicho material alergénico de la etapa a) con un dialdehído o dicetal. 8. El método de acuerdo con la reivindicación 7, en el que dicha reacción de carbamilación de la etapa a) se lleva a cabo haciendo reaccionar dicho material alergénico natural con cianato potásico a una concentración final de la sal en el intervalo entre 0, 1 M y 1, 5 M, preferiblemente entre 0, 4 M y 0, 8 M, y manteniendo el pH entre 7 y 11, preferiblemente entre 9 y 9, 6; a una temperatura en el intervalo entre la temperatura ambiente y 50 ºC, preferiblemente entre 35 y 40 ºC, durante un tiempo de reacción total en el intervalo entre 12 y 36 horas, preferiblemente entre 16 y 24 horas. 9. El método de acuerdo con la reivindicación 7 u 8, en el que entre dicha etapa a) y dicha etapa b) , el material alergénico natural así modificado se somete a filtración en gel para separar el exceso de reactivo y se equilibra con una disolución salina adecuada. 10. El método de acuerdo con una cualquiera de las reivindicaciones 7 a 9, en el que dicha etapa b) se lleva a cabo por reacción con fenilglioxal, con un exceso molar en el intervalo entre 100 y 1600, preferiblemente entre 400 y 800, durante un periodo de tiempo en el intervalo entre 30 min y 8 h, preferiblemente 4 h, a temperaturas en el intervalo entre 20 y 37 ºC, preferiblemente 25 ºC. 11. Una composición farmacéutica que comprende una dosis eficaz para la inmunoterapia de uno o más alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en combinación con excipientes farmacéuticamente aceptables. 12. Los alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 6, para usar en inmunoterapia específica, en los que dichos alérgenos modificados tienen la capacidad de inducir anticuerpos IgG específicos capaces de reconocer también el correspondiente alérgeno natural, pero menor capacidad de unirse a los anticuerpos IgE específicos. 35 3. Los alérgenos modificados de acuerdo con la reivindicación 1 o 2, en los que el porcentaje medio de grupos amina primaria modificados de las lisinas está en el intervalo entre 75 % y 100 %, preferiblemente aproximadamente 90 %; y el porcentaje medio de los restos de arginina sustituidos está en el intervalo entre 25 y 100 %, preferiblemente aproximadamente 40 %.
40 4. Los alérgenos modificados de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en los que R es fenilo, opcionalmente sustituido en orto, meta o para con un grupo hidroxi, alcoxi C1-C4, halógeno, amino, alquilamino, dialquilamino, mercapto, alquilmercapto C1-C4, y R2 es hidrógeno.
Patentes similares o relacionadas:
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Moléculas de ácido nucleico de Nucampholin para controlar plagas de insectos coleópteros, del 17 de Junio de 2020, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Una molécula de ácido nucleico aislada que comprende un polinucleótido que codifica una molécula de ácido ribonucleico de horquilla (hpARN) con una estructura […]
Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, del 17 de Junio de 2020, de TissueGUARD GmbH: Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, que presentan al menos un punto disociable […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Separación de proteínas objetivo insolubles, del 27 de Mayo de 2020, de AMSILK GMBH: Un método para aislar una proteína de seda objetivo insoluble de una suspensión de células huésped intactas o rotas que comprende las etapas de: a) proporcionar […]
Proteínas recombinantes y sus usos terapéuticos, del 27 de Mayo de 2020, de Bioven 3 Limited: Una proteína recombinante, que comprende: una secuencia polipeptídica inmunogénica que incluye la subunidad B de la toxina del cólera (CT-B) o la subunidad […]
Procedimiento de purificación de G-CSF, del 27 de Mayo de 2020, de MYLAN PHARMACEUTICALS, INC: Procedimiento de purificación de factor recombinante estimulador de colonias de granulocitos (G-CSF), que comprende al menos una cromatografía de intercambio […]