REACTIVOS DE DETECCION DE PROTEINAS Y PROCEDIMIENTOS CON COLORANTES Y DEXTRINAS.
Un procedimiento para detectar y/o cuantificar proteína que comprende poner en contacto una proteína con una solución que comprende:
(a) un colorante que forma complejo con proteína y (b) una o más dextrinas y detectar y/o cuantificar la formación de complejo de colorante/proteína, en el que el procedimiento esadecuado para detectar y/o cuantificar proteína cuando la proteína está en presencia de un detergente o un tensioactivo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2007/050226.
Solicitante: EXPEDEON LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: BUTTON END UNIT 1A HARSTON HARSTON CAMBRIDGE CAMBRIDGESHI REINO UNIDO.
Inventor/es: JONES,Daniel Brian, LANCKRIET,Heikki.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Abril de 2007.
Clasificación Internacional de Patentes:
- G01N33/68A6D
Clasificación PCT:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2355915_T3.pdf
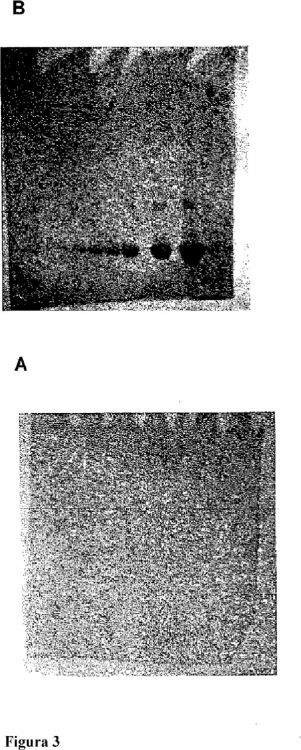
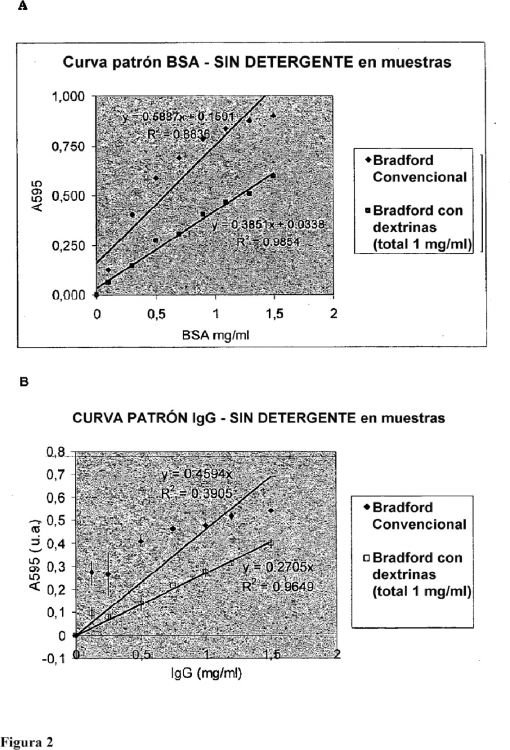
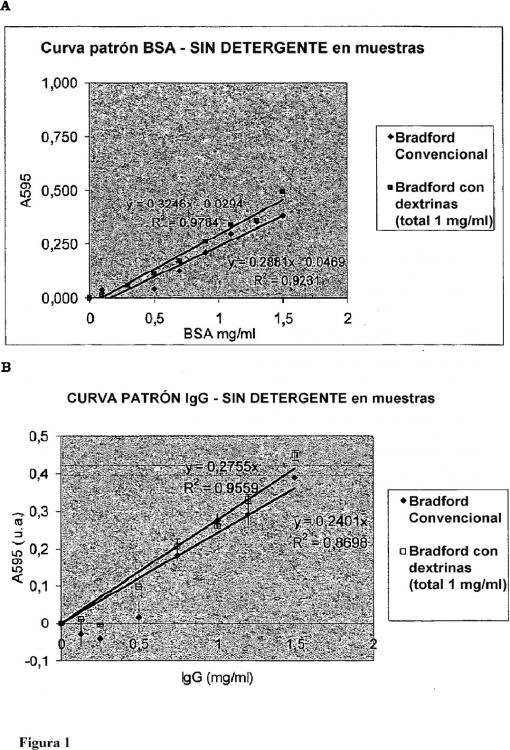
Fragmento de la descripción:
Campo Técnico
La presente invención se refiere a procedimientos para la detección de proteínas y determinación cuantitativa de concentración de proteínas.
Antecedentes de la Técnica
Están disponibles varios procedimientos para la detección de proteínas y la determinación de concentración de una proteína en solución. Estos incluyen procedimientos de unión a colorante, que se conocen bien en la técnica, e implican una reacción no específica en la que un colorante que forma complejo con una proteína se une a la proteína. La formación de un complejo colorante-proteína provoca un cambio en las propiedades ópticas del colorante, de modo que existe un cambio de color proporcional a la cantidad de proteína presente en la muestra. Los colorantes que forman complejo con proteínas usados para la cuantificación de proteínas in vitro incluyen verde de bromocresol (Gindler, Patente de Estados Unidos Nº 3.884.637), HABA y naranja de metilo, pero estos son de uso limitado puesto que se unen casi exclusivamente a albúmina y generalmente no son muy sensibles.
Otros procedimientos para determinar concentración de proteína incluyen el procedimiento de Biuret (Mokrasch y McGilvery, J. Biol. Chem. (1956). 221, p. 909), en el que las estructuras peptídicas que contienen al menos dos engarces peptídicos reaccionan con Cu2+ en solución alcalina para formar un complejo quelado de color violeta.
Lowry y col. (J. Lab. Clin. Med. (1951). 39, 663) emplearon un pre-tratamiento de proteínas con una solución de cobre alcalina, similar al procedimiento de Biuret, seguido de la adición de reactivo de Folin-Ciocalteu (que contiene sales de litio de ácidos fosfotúngstico y fosfomolíbdico). El color producido fue un resultado de la reducción de los ácidos fosfotúngstico y fosfomolíbdico a azul de tungsteno y molibdeno por el complejo de proteína-Cu y por el triptófano y la tirosina de la proteína.
Un inconveniente importante de los procedimientos de Biuret y Lowry es que no pueden tolerar agentes reductores que están presentes con frecuencia en muestras de proteína.
Se ha descrito la formación de complejo colorante/proteína usando Azul Brillante de Coomassie G-250 como colorante que forma complejo con proteínas (Bradford Patente de Estados Unidos Nº 4.023.933). Los colorantes de Azul Brillante de Coomassie se unirán a una amplia diversidad de proteínas. Además, el uso del colorante G-250 en el medio ácido apropiado da como resultado un reactivo de ensayo de proteínas que tiene una sensibilidad aproximadamente 100 veces mayor que las técnicas de unión del colorante convencional y de Biuret y aproximadamente de 3 a 5 veces la del procedimiento de Lowry (Bradford Patente de Estados Unidos Nº 4.023.933). El uso del colorante de Azul Brillante de Coomassie G-250 en el procedimiento desvelado en el documento US 4.023.933, el “Ensayo de Bradford”, tiene muchas ventajas con respecto a procedimientos que emplean otros colorantes, incluyendo alta sensibilidad, que permite el uso de un tamaño de muestra pequeño y utilidad cuando están presentes agentes reductores en una muestra.
El Azul Brillante de Coomassie G-250 existe en dos formas de color diferentes, rojo y azul. La forma azul del colorante está presente en solución neutra y alcalina mientras que la forma roja está presente en solución notablemente ácida (pH 0-1). En solución ácida, el Azul Brillante de Coomassie G250 está presente en equilibrio entre las formas roja y azul; dichas soluciones son parduscas en apariencia. Se cree que puesto que la proteína se une al colorante, el colorante se sitúa en un microambiente diferente y después se protege del medio ácido que proporciona el color rojo al colorante. La fuerza del medio ácido es importante para la sensibilidad del ensayo de proteínas usando colorante de Coomassie, puesto que un aumento en la fuerza del medio ácido provoca una pérdida de sensibilidad del ensayo significativa. El complejo proteína-colorante tiende a agregarse, lo que afecta a la estabilidad del producto de color. La presencia de un agente solubilizante, tal como etanol, tiende a evitar que el complejo proteína-colorante se agregue durante un periodo de tiempo razonable; sin embargo, demasiado etanol da como resultado un cambio notable a la forma azul del colorante, es decir, cambio del ambiente a uno que es menos polar. Se ha postulado que el mecanismo del ensayo es la unión de una forma de carbanión del colorante a un ambiente menos polar de la proteína. Esto quizá explique también el efecto negativo de grandes cantidades de detergente y de acetona en el ensayo, puesto que estos compuestos generalmente son de naturaleza no polar y tenderían a cambiar el ambiente del colorante.
Los principales inconvenientes del ensayo de Bradford son la falta efectiva de estabilidad de color durante periodos prolongados, debido principalmente a la precipitación del complejo proteína-colorante; la incapacidad de mostrar sustancialmente la misma reactividad ante diferentes proteínas; la incapacidad de seguir la ley de Beer; y, de forma más importante, el efecto adverso en el ensayo de detergentes presentes en una muestra (Bradford, M., Anal. Biochem., 72 248-254, 1976 y Patente de Estados Unidos Nº 4.023.933). Pei-Pei Xu, Microchemical Journal 49, 85-90 (1994) se refiere a
45
interferencia por Ciclodextrinas en la Determinación de Proteína por el procedimiento de Bradford. La formación de complejo colorante/proteína también se usa para teñir proteínas en geles, tal como los usados en electroforesis. Por ejemplo, el colorante Azul Brillante de Coomassie G-250 en solución de ácido perclórico se ha usado de este modo (Reisner, A. H. y col. (1975) Anal. Biochem. 64, 509-516).
En la actualidad, están disponibles varias formulaciones basadas en Coomassie comerciales para teñir proteínas en geles después de la separación electroforética. Para muchas aplicaciones electroforéticas, se usan detergentes tales como SDS para facilitar la separación de proteínas. Debido a que los detergentes afectan de forma adversa al cambio de color en la unión de colorantes de Coomassie con la proteína, debe retirarse del detergente por varios procedimientos de lavado, dando como resultado procedimientos de teñido prolongados y complicados.
De este modo una desventaja principal de la detección y cuantificación de proteínas basadas en colorantes, en particular usando reactivos del ensayo de Lowry o colorantes de Coomassie, es la interferencia de detergentes, tensioactivos y otras moléculas anfipáticas.
En consecuencia, existe un deseo para reactivos y procedimientos para la detección y determinación cuantitativa de proteína que tengan una tolerancia mejorada a la presencia de detergentes en las muestras y que tengan una estabilidad de color de proteína-colorante mejorada.
Divulgación de la Invención
Los inventores describen en el presente documento un reactivo para la detección de proteínas que comprende, o consiste en:
(a) un colorante que forma complejo con proteína y
(b) una o más dextrinas.
El colorante que forma complejo con proteínas es un colorante que experimenta típicamente un cambio en las propiedades ópticas en la formación de un complejo proteína-colorante, este puede ser un cambio en los espectros de absorción como sucede con los colorantes de azul brillante de Coomassie™, verde de bromocresol, HABA, naranja de metilo, reactivo de Biuret, reactivos de Biuret con reactivo de Folin-Ciocalteu (reactivos de Lowry); o un cambio en los espectros de emisión, como se produce para los colorantes que forman un complejo de colorante/proteína fluorescente, por ejemplo Naranja de Coomassie™, fluoresceína, Alexofluor, ficoeritrina, Rojo de Texas™.
Se prefiere que el colorante que forma complejo con proteína no comprenda una proteína, preferentemente el colorante que forma complejo con proteína no comprende un anticuerpo o péptido.
El colorante que forma complejo con proteína es preferentemente un colorante de Coomassie, tal como un colorante azul brillante de Coomassie, por ejemplo colorante azul brillante de Coomassie G-250
o colorante azul brillante de Coomassie R-250. Para algunos colorantes que forman complejo con proteína y en particular los colorantes de Coomassie, se requiere un pH bajo para conseguir el cambio necesario en las propiedades ópticas de la formación de complejo proteína/colorante.
Los inventores describen adicionalmente en el presente... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para detectar y/o cuantificar proteína que comprende poner en contacto una proteína con una solución que comprende:
(a) un colorante que forma complejo con proteína y
(b) una o más dextrinas
y detectar y/o cuantificar la formación de complejo de colorante/proteína,
en el que el procedimiento esadecuado para detectar y/o cuantificar proteína cuando la proteína está en presencia de un detergente o un tensioactivo.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que la proteína está en presencia de un detergente.
3. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 2 en el que la proteína está en solución o la proteína se proporciona en un soporte.
4. Un procedimiento de acuerdo con la reivindicación 3 en el que el soporte es un gel (por ejemplo un gel de poliacrilamida o gel de agarosa), sol, placa de cromatografía, papel de filtro, membrana de nitrocelulosa o resina.
5. Un procedimiento de acuerdo con la reivindicación 4 en el que el soporte es un gel de poliacrilamida o gel de agarosa y la proteína se ha sometido a separación usando un campo eléctrico, por ejemplo por electroforesis.
6. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 3 a 5 en el que el soporte comprende un detergente y/o en el que el contacto se realiza en presencia de un detergente.
7. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 1 a 6 en el que la detección y/o cuantificación comprende detectar un cambio en los espectros de absorción o emisión del complejo de colorante/proteína.
8. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 1 a 7 en el que la detección y/o cuantificación comprende detectar un cambio de color, por ejemplo midiendo la absorbancia, de forma adecuada mediante un procedimiento espectrofotométrico, por ejemplo a una longitud de onda en el intervalo de aproximadamente 400 a aproximadamente 700 nm.
9. Un procedimiento de acuerdo con la reivindicación 8 en el que el colorante que forma complejo con proteína es azul brillante de Coomassie G-250 y la absorbancia se mide a una longitud de onda de aproximadamente 595 nm.
10. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 1 a 9 en el que la cuantificación se realiza midiendo la absorbancia a lo largo del tiempo.
11. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 7 a 10 en el que la absorbancia o emisión medida se compara con un valor patrón, conjunto patrón de valores o curva patrón.
12. El procedimiento de una cualquiera de las reivindicaciones 1 a 11, que comprende adicionalmente proporcionar un soporte que comprende proteína, antes de la etapa de puesta en contacto.
13. El uso de una o más dextrinas para mejorar la formación de un complejo de colorante que se une a proteína/proteína en presencia de un detergente.
14. El uso de una o más dextrinas para reducir la interferencia de un detergente en la formación de un complejo de colorante de unión a proteína/proteína en presencia de un detergente.
15. El uso de la reivindicación 13 ó 14 en el que la dextrina se proporciona como un reactivo que comprende un colorante que forma complejo con proteína y una o más dextrinas.
16. Uso de acuerdo con la reivindicación 15 en el que el reactivo es un concentrado de reactivo.
17. Un uso de acuerdo con cualquiera de las reivindicaciones 15 ó 16 en el que el reactivo comprende adicionalmente un ácido con una pKa de 4 o menor.
18. Uso de acuerdo con cualquiera de las reivindicaciones 15 a 17 en el que reactivo comprende adicionalmente un agente solubilizante.
19. Uso de acuerdo con cualquiera de las reivindicaciones 15 a 18 en el que el colorante que forma complejo con proteína no comprende una proteína.
20. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 19 en el que el colorante es un colorante de Coomassie, por ejemplo un colorante azul brillante de Coomassie, tal como G-250.
21. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 20 en el que la concentración de dextrina está en el intervalo de aproximadamente 0,01 a aproximadamente 200 mg/ml.
22. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 21 en el que la concentración de dextrina está en el intervalo de aproximadamente 0,5 a aproximadamente 50 mg/ml.
23. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 22 en el que el colorante está presente en una concentración en el intervalo de aproximadamente 0,001% a aproximadamente 0,1% (p/v).
24. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 23 en el que el reactivo puede diluirse, en el que típicamente la relación de reactivo a diluyente está en el intervalo de aproximadamente
1:1 a aproximadamente 1:60.
25. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 24 que comprende un ácido con una pKa de 4 o menor, teniendo preferentemente el ácido una pKa en el intervalo de aproximadamente 1 a aproximadamente 3.
26. Uso de acuerdo con la reivindicación 25 en el que el ácido es un ácido seleccionado de un ácido fosfórico, un ácido fosforoso (fosfónico), ácido periódico, ácido selénico, ácido maleico, ácido oxálico, ácido dicloroacético y ácido Nitrilotris (metilen) trifosfónico y en el que el ácido está presente a una concentración de aproximadamente 4% a aproximadamente 20% (p/v).
27. Uso de acuerdo con cualquiera de las reivindicaciones 15 a 26 en el que la dextrina o dextrinas se selecciona(n) de una dextrina lineal, ciclodextrina, cicloamilosa y derivados de las mismas.
28. Uso de acuerdo con cualquiera de las reivindicaciones 15 a 27 en el que el reactivo comprende uno o más alcoholes, en el que el uno o más alcoholes se selecciona(n) de etanol, metanol y propanol y en el que la concentración de alcohol es de aproximadamente 0,1% a aproximadamente 10% v/v.
29. Uso de acuerdo con cualquiera de las reivindicaciones 15 a 28 en el que el reactivo comprende un detergente.
30. Uso de acuerdo con una cualquiera de las reivindicaciones 15 a 29 en el que el reactivo se proporciona como un sistema de múltiples partes.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]