PURIFICACIÓN DE VACUNAS CONJUGADAS DE PROTEÍNA-POLISACÁRIDO MEDIANTE ULTRAFILTRACIÓN CON SOLUCIONES DE SULFATO DE AMONIO.
Procedimiento para la separación de polisacárido no enlazado a partir de vacunas conjugadas de proteína-polisacárido en una mezcla de conjugado de proteína-polisacárido y polisacárido no enlazado,
comprendiendo dicho procedimiento la adición de cantidades de saturación de una solución salina a la mezcla seguido de la filtración de la mezcla a través de una membrana semipermeable
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06025470.
Solicitante: CONNAUGHT LABORATORIES.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: DISCOVERY DRIVE SWIFTWATER, PA 18370 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MCMASTER,RONALD,P.
Fecha de Publicación: .
Fecha Solicitud PCT: 16 de Diciembre de 1999.
Clasificación Internacional de Patentes:
- A61K39/095 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Neisseria.
- A61K39/385 A61K 39/00 […] › Haptenos o antígenos, unidos a soportes.
Clasificación PCT:
- A61K39/09 A61K 39/00 […] › Streptococcus.
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K39/385 A61K 39/00 […] › Haptenos o antígenos, unidos a soportes.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07K14/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Corynebacterium (G).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
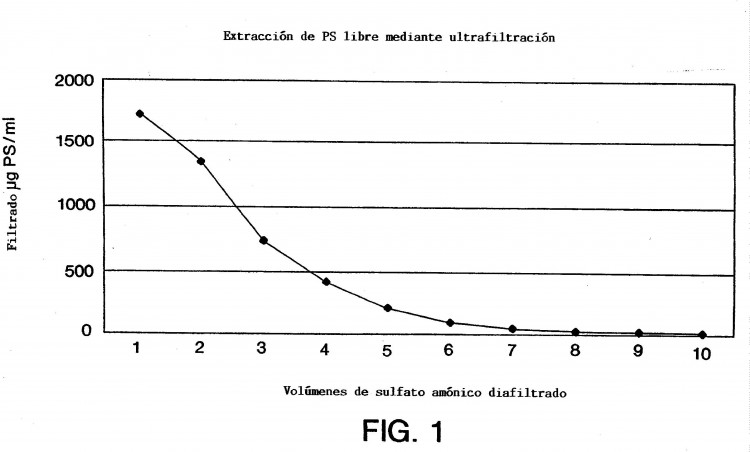
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a la separación de polisacárido no enlazado a partir de vacunas conjugadas de proteína-polisacárido utilizando el procedimiento de ultrafiltración, conteniendo la solución de diafiltración niveles de saturación de sulfato de amonio.
En la presente solicitud se hace referencia a diversas publicaciones. La referencia completa de dichas publicaciones se encuentra en el lugar donde se citan, o al final de la memoria, inmediatamente antes de las reivindicaciones. Estas publicaciones se refieren al estado de la técnica a la que pertenece la presente invención; sin embargo, no existe admisión de que cualquiera de estas publicaciones pertenezca efectivamente a la técnica anterior.
ANTECEDENTES DE LA INVENCIÓN
En los últimos años, se han desarrollado diversas vacunas conjugadas de proteína-polisacárido para su utilización en la protección contra infecciones bacterianas. Una vacuna de este tipo, la vacuna conjugada Haemophilus influenzae tipo B, ha demostrado ser bastante eficaz en la protección contra la enfermedad Haemophilus influenzae tipo B (Santosham, M., 1993). Las vacunas conjugadas de polisacárido-proteína se preparan enlazando covalentemente polisacáridos capsulares bacterianos purificados a moléculas de proteína utilizando una diversidad de procedimientos químicos. Una vez completadas las reacciones de conjugación, se separan las moléculas de polisacárido sin reaccionar de los conjugados de polisacárido-proteína utilizando un amplio espectro de técnicas de separación. Las técnicas que han demostrado ser más eficaces a efectos de purificar los conjugados de polisacáridoproteína incluyen la cromatografía de filtración por gel, la cromatografía de interacción hidrofóbica, la ultracentrifugación, la extracción líquido-líquido y la precipitación/fraccionamiento con sulfato de amonio.
La razón del interés en desarrollar vacunas conjugadas es que dichas vacunas son capaces de provocar una respuesta inmune antipolisacárido específica que protege contra la enfermedad. Estas vacunas conjugadas de polisacárido protegen contra patógenos que contienen un caparazón exterior de polisacárido. Estas vacunas han demostrado ser eficientes en la protección de recién nacidos y niños pequeños contra la enfermedad. La razón de que estas vacunas sean eficaces en las poblaciones más jóvenes se debe a la conversión de los polisacáridos capsulares bacterianos purificados, que se clasifican como antígenos independientes de las células T, en antígenos tipo células T cuando se enlazan covalentemente a determinadas moléculas de proteína. Los antígenos de células T son capaces de provocar una respuesta inmune que puede estimularse mediante una vacunación subsiguiente, permitiendo establecer un nivel de protección en el sujeto vacunado. Normalmente, estos antígenos de células T proporcionan una inmunidad a largo plazo contra la enfermedad. Los polisacáridos capsulares bacterianos purificados son capaces de provocar una respuesta inmune en personas adultas, pero dicha respuesta inmune puede tener una duración limitada, particularmente en las poblaciones jóvenes. Generalmente, la respuesta inmune en poblaciones jóvenes es muy baja, y se considera que no presenta un nivel protector. Generalmente, las vacunaciones subsiguientes con polisacárido no dan lugar a una respuesta de anticuerpos mayor o estimulada, ya que no hay ayuda por parte de células T o anticuerpos de memoria. Por esta razón, no se ha recomendado la utilización de las vacunas de polisacárido en recién nacidos y en niños menores de 2 años.
Generalmente, en la preparación de vacunas conjugadas de polisacárido-proteína se llevan a cabo etapas para separar el polisacárido no enlazado de estas preparaciones, dado que el polisacárido no enlazado no aporta ningún beneficio al sujeto vacunado. Además, se ha llevado a cabo un esfuerzo más intenso para desarrollar vacunas bien caracterizadas con un grado de pureza mayor en vistas a su aprobación.
OBJETIVOS Y SUMARIO DE LA INVENCIÓN
La ultrafiltración, tal como la diálisis, se basa en el principio de separar moléculas según el tamaño utilizando una membrana semipermeable con un intervalo definido de tamaños de poro. La ultrafiltración se utiliza ampliamente en la purificación de proteínas y polisacáridos a efectos de concentrar las moléculas de proteína y de polisacárido y a efectos de modificar la composición de la solución tampón. La ultrafiltración también se utiliza en la purificación de polisacáridos y proteínas a efectos de eliminar solutos de peso molecular bajo en estas soluciones de muestra. Esta técnica procedural se aplica rutinariamente en pequeños experimentos de laboratorio y en etapas de proceso a escala de fabricación.
El objetivo de la presente invención es dar a conocer un procedimiento de separación de polisacárido no reaccionado o no enlazado de preparaciones de conjugados de polisacárido-proteína basadas en la diferencia del tamaño molecular. El tamaño molecular del polisacárido no reaccionado o no enlazado, aunque es relativamente grande y está comprendido entre 1.000 y 50.000 Daltons, es mucho menor que el tamaño molecular de las moléculas de conjugado de polisacárido-proteína, que está comprendido entre 100.000 y 1.000.000 Daltons. Al desarrollar este procedimiento para la purificación de conjugados de polisacárido-proteína, la presente invención proporciona la oportunidad de aumentar fácilmente al tamaño industrial las preparaciones de reacción.
La invención da a conocer un procedimiento para la separación de polisacárido no enlazado a partir de vacunas conjugadas de proteína-polisacárido en una mezcla de conjugado de proteínapolisacárido y polisacárido no enlazado, comprendiendo dicho procedimiento la adición de solución de sulfato de amonio a la mezcla, de tal modo que el sulfato de amonio esté presente en la mezcla en un nivel superior al 40% de saturación, seguida de la filtración de la mezcla a través de una membrana semipermeable contra un tampón que contiene sulfato de amonio en un nivel superior al 40% de saturación.
Las formas de realización preferidas del procedimiento según la invención se definen en las reivindicaciones 2 a 10.
Las moléculas de polisacárido y de proteína no se comportan igual con respecto a su facilidad de atravesar membranas semipermeables. Una razón de ello es que los polisacáridos existen como distribuciones de peso molecular, mientras que generalmente las proteínas tienen un tamaño molecular definido. Las proteínas existen en solución como estructuras de tipo perla, mientras que los polisacáridos pueden adoptar una diversidad de conformaciones (por ejemplo, de espirales), o pueden existir en forma de estructuras aleatorias de tipo cuerda. Como consecuencia de las diversas formas geométricas que los polisacáridos pueden adoptar en solución, algunos polisacáridos pueden atravesar membranas semipermeables más fácilmente que otros. La composición química de la membrana semipermeable puede ser de naturaleza hidrofóbica (por ejemplo, poliéter sulfona) o hidrofílica (por ejemplo, celulosa regenerada). La composición química de la membrana semipermeable puede influenciar la facilidad con la que las proteínas y polisacáridos atraviesan los poros. Los polisacáridos con un tamaño molecular comprendido entre 1 y 50.000 pueden atravesar membranas semipermeables con tamaños de poro cuyo límite de tamaño molecular sea de 30.000 utilizando solución 0,15 M de cloruro sódico como tampón de diafiltración. Cuando se somete una mezcla del mismo polisacárido y conjugados de polisacárido-proteína a las mismas condiciones experimentales de ultrafiltración, muy poco polisacárido no enlazado atravesará la membrana semipermeable. Sin embargo, cuando se cambia el tampón de diafiltración hasta el 40% (de saturación) de sulfato de amonio, el polisacárido no enlazado atraviesa libremente los poros de la membrana.
El sulfato de amonio no modifica el tamaño de los poros de la membrana. El nivel de saturación juega un papel importante a la hora de permitir que el polisacárido no enlazado atraviese libremente la membrana semipermeable. Por debajo del 40% (de saturación), muy poco polisacárido no enlazado atraviesa la membrana. Sin embargo, por encima del 40% (de saturación), el polisacárido se eluye libremente a través de los poros de la membrana. La presente invención no requiere que el conjugado de polisacárido-proteína se separe de la solución por precipitación para que funcione. El procedimiento funciona igualmente bien tanto...
Reivindicaciones:
1. Procedimiento para la separación de polisacárido no enlazado a partir de vacunas conjugadas de proteína-polisacárido en una mezcla de conjugado de proteína-polisacárido y polisacárido no enlazado, comprendiendo dicho procedimiento la adición de cantidades de saturación de una solución salina a la mezcla seguido de la filtración de la mezcla a través de una membrana semipermeable.
2. Procedimiento según la reivindicación 1, en el que la membrana semipermeable es hidrofóbica.
3. Procedimiento según la reivindicación 2, en el que la membrana hidrofóbica está compuesta por poliéter sulfona.
4. Procedimiento según la reivindicación 3, en el que la membrana de poliéter sulfona presenta un límite de peso molecular de 30.000.
5. Procedimiento según la reivindicación 1, en el que la membrana semipermeable es hidrofílica.
6. Procedimiento según la reivindicación 5, en el que la membrana hidrofílica está compuesta por celulosa regenerada.
7. Procedimiento según la reivindicación 6, en el que la celulosa regenerada presenta un límite de peso molecular de 30.000.
8. Procedimiento según la reivindicación 1, en el que la solución salina está compuesta por sulfato de amonio.
9. Procedimiento según la reivindicación 8, en el que el sulfato de amonio está presente en un nivel comprendido entre 20 y 60% de saturación.
10. Procedimiento según la reivindicación 1, en el que la proteína es toxoide diftérico.
11. Procedimiento según la reivindicación 1, en el que el polisacárido es polisacárido capsular procedente de bacterias seleccionadas de entre el grupo constituido por Streptococcus pneumoniae serotipos 1, 3, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F y Neisseria meningitidis serogrupos A, C, W-135 e Y.
Patentes similares o relacionadas:
DERIVADOS DE OLIGOSACÁRIDOS SINTÉTICOS COMO VACUNA CONTRA BORDETELLA PERTUSSIS, del 2 de Julio de 2020, de INSTITUTO FINLAY DE VACUNAS: La presente invención proporciona fragmentos de oligosacáridos sintéticos provenientes del pentasacárido terminal del lipooligosacárido de Bordetella pertussis, un método […]
Proteínas recombinantes y sus usos terapéuticos, del 27 de Mayo de 2020, de Bioven 3 Limited: Una proteína recombinante, que comprende: una secuencia polipeptídica inmunogénica que incluye la subunidad B de la toxina del cólera (CT-B) o la subunidad […]
Bacterias mutantes para la producción de módulos generalizados para antígenos de membrana, del 13 de Mayo de 2020, de GLAXOSMITHKLINE BIOLOGICALS SA: Un procedimiento para preparar vesículas a partir de una bacteria gramnegativa en el que al menos una proteína que contiene un dominio catalítico LytM se inactiva […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Proteínas de fusión y vacunas de combinación, del 26 de Febrero de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunogénica que comprende una proteína de fusión de fórmula I: (X)m-(R1)n-A-(Y)o-B-(Z)p (fórmula I) en la que X es un péptido señal o MHHHHHH (SEQ […]
Glucoconjugado de oligosacárido procedente de LOS con la toxina tosferínica de Bordetella pertussis y su aplicación en la profilaxis y el tratamiento de infecciones causadas por Bordetella pertussis, del 4 de Noviembre de 2019, de Siec Badawcza Lukasiewicz - PORT Polski Osrodek Rozwoju Technologii: Un método para preparar un glucoconjugado que comprende un oligosacárido (OS) procedente de LOS o su fragmento y la toxina tosferínica (PT) de B. pertussis en donde el método […]
Composiciones y métodos para mejorar la inmunogenicidad de los conjugados de polisacárido-proteína, del 23 de Octubre de 2019, de Kanvax Biopharmaceuticals Ltd: Un conjugado de polisacárido-proteína que comprende una proteína transportadora quimérica y un antígeno polisacárido, en donde la proteína […]
Composición de vacuna que comprende polisacáridos capsulares naturales conjugados de N. Meningitidis, del 24 de Julio de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: Una composición inmunogénica que comprende polisacáridos capsulares de N. meningitidis de los serogrupos A, C, W135 e Y, en donde cada polisacárido […]