PRODUCCIÓN RECOMBINANTE DE PROTEÍNAS DE UNIÓN A HEPARINA.
Un proceso para recuperar una proteína de unión a heparina a partir de un cultivo de células procarióticas,
en el que dicha proteína de unión a heparina es el factor de crecimiento endotelial vascular (VEGF) que se une a heparina, comprendiendo el proceso las etapas de: (a) aislar dicha proteína de unión a heparina del periplasma de dicho cultivo de células procarióticas; (b) desnaturalizar dicha proteína de unión a heparina en una primera disolución tamponada que comprende un agente caotrópico y un agente reductor; (c) incubar dicha proteína de unión a heparina en una segunda disolución tamponada que comprende un agente caotrópico y un agente polianiónico sulfatado, en el que dicho agente polianiónico sulfatado es sulfato de dextrano o sulfato de sodio, durante un tiempo y en condiciones tales que ocurra el replegamiento de dicha proteína de unión a heparina; y (d) recuperar dicha proteína de unión a heparina, en el que hay un aumento de aproximadamente 2 a 5 veces en la proteína de unión a heparina replegada en comparación con la incubación sin agente polianiónico sulfatado
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/062320.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY SOUTH SAN FRANCISCO, CA 94080-4990 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CLELAND, JEFFREY, L., BUTLER, MICHELLE, D., WINKLER, MARJORIE, E., SCHMELZER, CHARLES, H., KAHN,David W, PIZARRO,Shelly.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Diciembre de 2006.
Clasificación PCT:
- C07K14/52 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Citoquinas; Linfoquinas; Interferones.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359883_T3.pdf



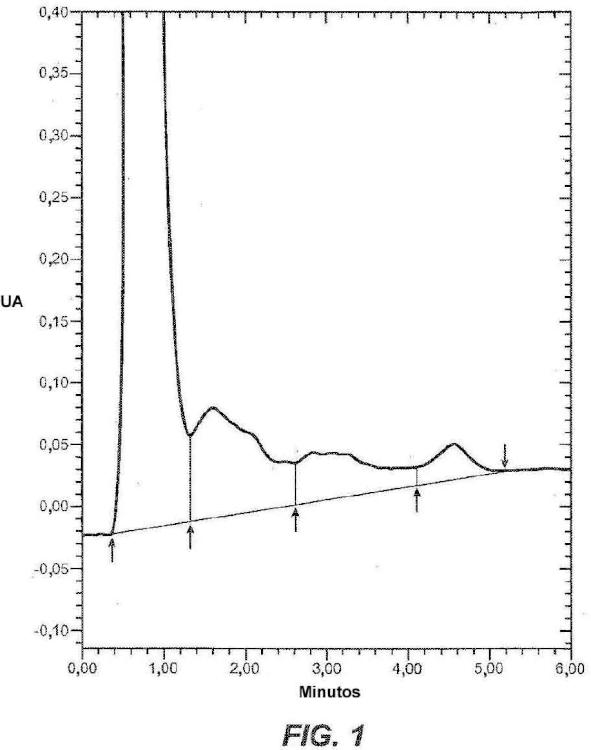
Fragmento de la descripción:
Solicitud relacionada
Esta solicitud reivindica la prioridad y el beneficio de la solicitud provisional de EE.UU. nº de serie 60/753.615, presentada el 22 de diciembre de 2005, y de la solicitud provisional de EE.UU. nº de serie 60/807.432, presentada el 14 de julio de 2006.
Campo de la invención
Esta invención se refiere a procedimientos para la obtención de proteínas de unión a heparina producidas en cultivo celular. La invención incluye procedimientos para recuperar y purificar proteínas de unión a heparina replegadas que se han producido en células hospedadoras eucarióticas y están presentes en estas células, típicamente en el espacio periplasmático o intracelular. Las proteínas de unión a heparina producidas en células hospedadoras procarióticas pueden encontrarse también como proteínas solubles o una mezcla de proteínas solubles e insolubles.
Antecedentes
Es conocido que una gran variedad de polipéptidos biológicamente activos de origen natural se unen a heparina. Dichos polipéptidos de unión a heparina incluyen citocinas tales como factor de plaquetas 4 e IL-8 (Barber y col., (1972) Biochim. Biophys. Acta, 286:312-329; Handin y col., (1976) J. Biol. Chem., 251: 4273-422; Loscalzo y col., (1985) Arch. Biochem. Biophys. 240: 446-455; Zucker y col., (1989) Proc. Natl. Acad. Sci. USA, 86: 7571-7574; Talpas y col., (1991) Biochim. Biophys. Acta, 1078:208-218; Webb y col., (1993) Proc. Natl. Acad. Sci. USA, 90: 7158-7162), factores de crecimiento de unión a heparina (Burgess y Maciag, (1989) Annu. Rev. Biochem., 58: 576-606; Klagsbrun, (1989) Prog. Growth Factor Res., 1: 207-235) tales como factor de crecimiento epidérmico (EGF); factor de crecimiento derivado de plaquetas (PDGF); factor de crecimiento de fibroblastos básico (bFGF); factor de crecimiento de fibroblastos ácido (aFGF); factor de crecimiento endotelial vascular (VEGF) y factor de crecimiento de hepatocitos (HGF) (Liu y col., (1992) Gastrointest. Liver Physiol. 26: G642-G649) y selectinas tales como L-selectina, E-selectina y P-selectina (Norgard-Sumnicht y col., (1993) Science, 261: 480-483). Véase también Muñoz y Linhardt., (2004) Arterioscler. Thromb. Vasc. Biol., 24: 1549-1557.
La publicación internacional nº WO 95/07097 describe formulaciones de proteínas de unión a heparina que incluyen factores de crecimiento de unión a heparina tales como VEGF, con heparina nativa purificada u otros compuestos polianiónicos para uso terapéutico. Se ha mostrado que los oligosacáridos derivados de heparina y diversos otros compuestos polianiónicos estabilizan la conformación activa de los factores de crecimiento de unión a heparina (Barzu y col., (1989) J. Cell. Physiol. 140: 538-548; Dabora y col., (1991) J. Biol. Chem. 266: 23627-23640) y se ha empleado la cromatografía de afinidad por heparina en diversos esquemas de purificación (véase, en general, la publicación internacional nº WO 96/02562).
Muchas de las proteínas de unión a heparina de origen mamífero se han producido mediante tecnología recombinante y son clínicamente relevantes (Muñoz y Linhardt, (2004) Arterioscler. Thromb. Vasc. Biol., 24: 1549-1557; Favard y col. (1996) Diabetes and Metabolism 22(4): 268-73; Matsuda y col., (1995) J. Biochem. 118(3): 643-9; Roberts y col., (1995) Brain Research 699(1): 51-61). Por ejemplo, el VEGF es un potente mitógeno para células endoteliales vasculares. Es también conocido como factor de permeabilidad vascular (VPF). Véase Dvorak y col., (1995) Am. J. Pathol. 146: 1029-39. El VEGF desempeña papeles importantes tanto en vasculogénesis, el desarrollo de los vasos embrionarios, como en angiogénesis, el proceso de formación de nuevos vasos sanguíneos a partir de los preexistentes. Véanse, por ejemplo, Ferrara, (2004) Endocrine Reviews 25(4): 581-611; Risau y col., (1988) Dev. Biol. 125: 441-450; Zachary, (1998) Intl. J. Biochem. Cell. Bio. 30: 1169-1174; Neufeld y col., (1999) FASEB J. 13: 9-22; Ferrara (1999) J. Mol. Med. 77: 527-543 y Ferrara y Davis-Smyth, (1997) Endocrin. Rev. 18: 4-25. Las aplicaciones clínicas para el VEGF incluyen aquellas en que está indicado el crecimiento de nuevos lechos capilares como, por ejemplo, en la promoción de la curación de heridas (véase, por ejemplo, la publicación internacional nº WO 91/02058 y de expediente de agente nº P2358R1, titulada "Curación de heridas " presentada el 16 de junio de 2006), en la promoción del crecimiento y reparación de tejido, por ejemplo, hepático (véase, por ejemplo, el documento W02003/0103581), óseo (véase, por ejemplo, el documento WO2003/094617), etc. Véase también Ferrara, (2004) Endocrine Reviews 25(4): 581-611.
Típicamente, se producen proteínas recombinantes terapéuticamente relevantes en una variedad de organismos hospedadores. La mayoría de proteínas puede expresarse en su forma nativa en hospedadores eucarióticos tales como células CHO. El cultivo de células animales requiere generalmente tiempos de crecimiento prolongados para conseguir la máxima densidad celular y consigue en última instancia una menor densidad celular que los cultivos de células procarióticas (Cleland, J. (1993) ACS Symposium Series 526, “Protein Folding: In Vivo and In Vitro”, American Chemical Society). Adicionalmente, los cultivos de células animales requieren a menudo medios caros que contienen componentes de crecimiento que pueden interferir con la recuperación de la proteína deseada. Los sistemas de expresión de hospedador bacteriano proporcionan una alternativa económica para la producción a escala de fabricación de proteínas recombinantes. Existen numerosas patentes de EE.UU. sobre la expresión bacteriana genérica de proteínas recombinantes, incluyendo las patentes de EE.UU. nº 4.565.785, 4.673.641, 4.795.706 y 4.710.473. Es una ventaja importante del procedimiento de producción la capacidad de aislar fácilmente el producto a partir de los componentes celulares mediante centrifugación o microfiltración. Véanse, por ejemplo, Kipriyanov y Little, (1999) Molecular Biotechnology, 12: 173-201 y Skerra y Pluckthun, (1988) Science, 240: 1038-1040.
Se han recuperado y purificado factores de crecimiento de unión a heparina recombinantes tales como factor de crecimiento de fibroblastos ácido, factor de crecimiento de fibroblastos básico y factor de crecimiento endotelial vascular a partir de una serie de fuentes incluyendo bacterias (Salter D.H. y col., (1996) Labor. Invest. 74(2): 546-556 (VEGF); Siemeister y col., (1996) Biochem. Biophys. Res. Commun. 222(2): 249-55 (VEGF); Scrofani y col., (2001) J. Microbiol. Biotechnol. 11(4): 543-551 (VEGF); Cao y col., (1996) J. Biol. Chem. 261(6): 3154-62 (VEGF); Yang y col., (1994) Gaojishu Tongxun, 4:28-31 (VEGF); Anspach y col., (1995) J. Chromatogr. A 711(1): 129-139 (aFGF y bFGF); Gaulandris (1994) J. Cell. Physiol. 161(1): 149-59 (bFGF); Estape y Rinas (1996) Biotech. Tech. 10(7): 481-484 (bFGF); McDonald y col., (1995) FASEB
J. 9(3): A410 (bFGF)). Sin embargo, los sistemas de expresión bacteriana tales como E. coli carecen de la maquinaria celular para facilitar el replegamiento apropiado de las proteínas, y generalmente no dan como resultado la secreción de proteínas grandes en los medios de cultivo. Las proteínas recombinantes expresadas en células hospedadoras bacterianas se encuentran a menudo como cuerpos de inclusión consistentes en masas densas de proteína reducida parcialmente plegada y plegada erróneamente. De esta forma, la proteína recombinante es generalmente inactiva. Por ejemplo, la forma activa predominante del VEGF es un homodímero de dos polipéptidos de 165 aminoácidos (VEGF-165). En esta estructura, cada subunidad contiene 7 pares de enlaces disulfuro intracatenarios y dos pares adicionales que afectan al ligamiento covalente de las dos subunidades (Ferrara y col., (1991) J. Cell. Biochem. 47: 211-218). La conformación nativa incluye un dominio fuertemente básico que se ha mostrado que se une fácilmente a heparina (Ferrara y col. (1991) supra). La dimerización covalente de VEGF es necesaria para una unión a receptor y actividad biológica eficaces (Pötgens y col., (1994) J. Biol. Chem. 269: 32879-32885; Claffey y col., (1995) Biochim. et Biophys. Acta 1246: 1-9). El producto bacteriano contiene potencialmente varios intermedios plegados erróneamente y con puentes disulfuro desorganizados.
Adicionalmente, el replegamiento produce a menudo dímeros, trímeros y multímeros plegados erróneamente y ligados por disulfuro (Morris y col., (1990) Biochem. J., 268: 803-806; Toren y col., (1988) Anal. Biochem., 169:287-299). Este fenómeno de asociación es muy común durante el replegamiento... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para recuperar una proteína de unión a heparina a partir de un cultivo de células procarióticas, en el que dicha proteína de unión a heparina es el factor de crecimiento endotelial vascular (VEGF) que se une a heparina, comprendiendo el proceso las etapas de:
(a) aislar dicha proteína de unión a heparina del periplasma de dicho cultivo de células procarióticas;
(b) desnaturalizar dicha proteína de unión a heparina en una primera disolución tamponada que comprende un agente caotrópico y un agente reductor;
(c) incubar dicha proteína de unión a heparina en una segunda disolución tamponada que comprende un agente caotrópico y un agente polianiónico sulfatado, en el que dicho agente polianiónico sulfatado es sulfato de dextrano o sulfato de sodio, durante un tiempo y en condiciones tales que ocurra el replegamiento de dicha proteína de unión a heparina; y
(d) recuperar dicha proteína de unión a heparina, en el que hay un aumento de aproximadamente 2 a 5 veces en la proteína de unión a heparina replegada en comparación con la incubación sin agente polianiónico sulfatado.
2. El proceso de la reivindicación 1, en el que el VEGF es VEGF165.
3. El proceso de la reivindicación 1, en el que el sulfato de dextrano es de entre aproximadamente 3.000 Da y 10.000 Da.
4. El proceso de la reivindicación 1, en el que el sulfato de dextrano es de entre aproximadamente 8.000 y 10.000 Da.
5. El proceso de la reivindicación 1, en el que dichas primera y segunda disoluciones tamponadas comprenden HEPPS pH 8.0.
6. El proceso de la reivindicación 1, en el que la concentración de sulfato de sodio está entre aproximadamente 50 y 500 mM.
7. El proceso de la reivindicación 1, en el que dicha segunda disolución tamponada comprende adicionalmente
(i) un agente reductor;
(ii) un detergente no iónico; y
(iii) arginina y/o lisina.
8. El proceso de la reivindicación 7, en el que el agente reductor de la segunda disolución tamponada comprende una combinación de cisteína y DTT.
9. El proceso de la reivindicación 1, en el que dicha etapa de recuperación (d) comprende
(i) poner en contacto secuencialmente dicha proteína de unión a heparina replegada con un soporte cromatográfico de hidroxiapatito, un primer soporte cromatográfico de interacción hidrófoba, un soporte cromatográfico catiónico y un segundo soporte cromatográfico de interacción hidrófoba, y eluir selectivamente la proteína de unión a heparina de cada soporte, o
(ii) poner en contacto secuencialmente dicha proteína de unión a heparina con un soporte de intercambio catiónico, un soporte cromatográfico de interacción hidrófoba y un soporte cromatográfico de intercambio iónico, y eluir selectivamente la proteína de unión a heparina de cada soporte.
10. El proceso de la reivindicación 9(i), en el que dichos primer y segundo soportes cromatográficos de interacción hidrófoba se seleccionan del grupo constituido por resinas de butil-, propil-, octil- y arilagarosa.
11. El proceso de la reivindicación 9(i), en el que dicho primer soporte cromatográfico de interacción hidrófoba es un soporte de butilagarosa y dicho segundo soporte cromatográfico de interacción hidrófoba es una resina de soporte de fenilagarosa.
12. Un procedimiento para recuperar una proteína de unión a heparina a partir de un cultivo de células procarióticas, en el que dicha proteína de unión a heparina es el factor de crecimiento
endotelial vascular (VEGF) que se une a heparina, comprendiendo el procedimiento las etapas de:
(a) aislar dicha proteína de unión a heparina del periplasma de dicho cultivo de células procarióticas;
(b) desnaturalizar dicha proteína de unión a heparina aislada en una primera disolución 5 tamponada que comprende un agente caotrópico y un agente reductor;
(c) incubar dicha proteína de unión a heparina desnaturalizada en una segunda disolución tamponada que comprende un agente caotrópico y un agente polianiónico sulfatado, en el que el agente polianiónico sulfatado es sulfato de dextrano o sulfato de sodio, durante un tiempo y en condiciones tales que ocurra el replegamiento de dicha proteína de unión a heparina, en el que hay un aumento de aproximadamente 2-5 veces de la proteína de unión a heparina replegada recuperada en comparación con incubar sin agente polianiónico sulfatado; y
(d) poner en contacto secuencialmente dicha proteína de unión a heparina replegada con (i) un soporte cromatográfico de hidroxiapatito, un primer soporte cromatográfico de interacción hidrófoba y un segundo soporte cromatográfico de interacción hidrófoba, y eluir selectivamente la proteína de unión a heparina de cada soporte; o (ii) un soporte de intercambio catiónico, un soporte cromatográfico de interacción hidrófoba y un soporte cromatográfico de intercambio iónico, y eluir selectivamente la proteína de unión a heparina de cada soporte.
Patentes similares o relacionadas:
Proteína de unión a vitamina D desglicosilada de manera selectiva (Gcmaf) y colecalciferol (calciol) así como procedimiento de preparación, del 26 de Febrero de 2020, de HG Pharma GmbH: Complejo dimerico de proteina de union a vitamina D desglicosilada de manera selectiva (GcMAF) y colecalciferol (calciol).
Polipéptidos de acción prolongada y métodos para producirlos y administrarlos, del 4 de Diciembre de 2019, de OPKO Biologics Ltd: Un polipéptido que comprende una actividad biológica, dicho polipéptido comprende un péptido de interés, un solo péptido carboxilo terminal (CTP) de gonadotropina coriónica unido […]
Ácidos nucleicos de unión a SDF-1 y el uso de los mismos, del 6 de Noviembre de 2019, de NOXXON PHARMA AG: Una molécula de ácido nucleico L- de unión a SDF-1 para uso en terapia, en donde la terapia comprende influir en la migración de las células, de este […]
Agentes de unión selectiva antagonistas de proteína que se une a osteoprotegerina, del 16 de Octubre de 2019, de AMGEN INC.: Un anticuerpo monoclonal o uno de sus dominios que se unen a antígeno que comprende uno o más cambios de aminoácido en una o más de las CDR1, […]
Diagnóstico y tratamiento de la enfermedad inflamatoria del intestino y del síndrome del intestino irritable, del 11 de Septiembre de 2019, de TLA Targeted Immunotherapies AB: Un reactivo de unión capaz de unirse específicamente a un marcador de monocitos CD14+HLA-DRhi seleccionado de CCR9, para su uso en el tratamiento de la enfermedad inflamatoria […]
Fusocinas que implican citocinas con afinidades de unión al receptor fuertemente reducidas, del 11 de Septiembre de 2019, de VIB VZW: Una composición que comprende una proteína de fusión que comprende al menos dos citocinas, donde las citocinas son XCL1 e IFNα2, y donde IFNα2 comprende […]
Agentes antagonistas de unión selectivos de la proteína de unión a osteoprotegerina, del 3 de Julio de 2019, de AMGEN INC.: Un anticuerpo o dominio de unión a antígeno que comprende una cadena ligera y una cadena pesada, donde la cadena pesada comprende una secuencia […]
Composición que contiene ARN para el tratamiento de enfermedades tumorales, del 26 de Junio de 2019, de CureVac AG: Composición que contiene ARN para su uso en el tratamiento o la profilaxis de enfermedades tumorales y/o cancerosas, donde la composición que contiene […]