HEMOGLOBINAS PEGILADAS NO HIPERTENSIVAS Y SUS PROCEDIMIENTOS DE PREPARACIÓN.
Una molécula de hemoglobina (Hb) no hipertensiva que tiene de seis a siete cadenas de PEG,
en la que dos de dichas cadenas de PEG están unidas a la Cys-93(ß) de la Hb, y el resto de cadenas de PEG están unidas a grupos tiol introducidos en ε-H2 de la Hb
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/040407.
Solicitante: ALBERT EINSTEIN COLLEGE OF MEDICINE OF YESHIVA UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1300 MORRIS PARK AVENUE CHANIN BUILDING BRONX NEW YORK 10461 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ACHARYA,Seetharama,A, MANJULA,Belur,N.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Diciembre de 2003.
Clasificación Internacional de Patentes:
- C07K14/805 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hemoglobinas; Mioglobinas.
Clasificación PCT:
- A61K38/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- A61K38/42 A61K 38/00 […] › Hemoglobinas; Mioglobinas.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
Clasificación antigua:
- A61K38/16 A61K 38/00 […] › Péptidos que tienen más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2360215_T3.pdf


Fragmento de la descripción:
La presente invención se refiere a una hemoglobina modificada y a los procedimientos para preparar la misma.
Antecedentes de la invención
La hemoglobina (Hb) es el constituyente principal de los eritrocitos que transportan oxígeno desde los pulmones a través del cuerpo. Cuando está contenida en los glóbulos rojos, Hb se encuentra como una estructura tetramérica compuesta por dos oxígenos unidos a dímeros αβ teniendo cada uno un peso molecular de aproximadamente 32 Kd. Cada subunidad α y β de cada dímero tiene una cadena de proteína y una molécula hemo. Se conocen las secuencias de las cadenas de proteínas α y β. Hb es un sustituto de la sangre potencialmente útil para transfusiones, y se ha propuesto como reactivo para atrapar óxido nítrico en los choques sépticos, y para modular la oxigenación del tejido durante la radioterapia contra el cáncer. La tecnología de ADN recombinante ha dado también como resultado la generación de Hb modificada con afinidades por el oxígeno moduladas según las necesidades especiales de las aplicaciones terapéuticas individuales.
La vasoactividad de la Hb acelular, es decir, la constricción de arteriolas y capilares, cuando se infunden con disoluciones de Hb acelulares purificadas, o Hb reticuladas intramolecularmente, ha sido el impedimento principal para el desarrollo de portadores de oxígeno basados en Hb (Savitzsky y col. 1978, SLoan y col. 1999, Saxena y col. 1999). Se ha atribuido la vasoactividad al efecto secuestrante de NO de la Hb (Doharty y col. 1998). Se han propuesto dos enfoques moleculares, que son muy distintos entre sí en un intento de superar la actividad secuestrante de NO de la Hb. El primer enfoque es el enfoque del ADN recombinante, que ha intentado reducir la actividad secuestrante de la Hb respecto del óxido nítrico modificando la actividad de unión del NO mediante mutagénesis sitioespecífica de la Hb de la bolsa hemo distal (Eich y col, 1996). El segundo enfoque es el enfoque químico, en el que el tamaño molecular de la Hb se aumenta mediante oligomerización, lo que reducirá o inhibirá de manera posiblemente completa la extravasación de Hb desde el espacio vascular al espacio intersticial (Hess y col. 1978, Thomas y col. 1993, Muldoon y col. 1996, Macdonal y col. 1994, Furchgott 1984, Kilbourn y col. 1994). Sin embargo, el enfoque que aumenta el tamaño será satisfactorio únicamente si la vasoactividad de Hb está mediada esencialmente como resultado de la extravasación. Aunque el aumento de tamaño mediado por la oligomerización de Hb ha mostrado cierta reducción en la vasoactividad de Hb, no se ha generado una solución de Hb no hipertensiva ya sea mediante tecnología de ADN recombinante ya sea mediante el enfoque de aumento de tamaño que implica la oligomerización de la Hb usando un reactivo bifuncional de molécula pequeña. Una excepción es el producto oligomerizado de la Hb (Matheson y col. 2002), que tiene un tamaño molecular muy superior a 300 kDa y un radio molecular promedio de 24 nm, y que se encontró que no era hipertensivo y se encontró que no se extravasaba. Sin embargo, la mayoría de los productos oligomerizados actualmente en la etapa de ensayo clínico tienen un peso molecular en el intervalo de 200 a 250 kDa.
La demostración de que la Hb PEGilada de Enzon, que transporta diez copias de cadenas de PEG-5000 unidas a Hb en sus grupos amino α y ∈ no es hipertensiva ha estimulado la investigación en el campo de los sustitutos de la sangre (Rolfs y col. 1998). La actividad de unión a NO de las Hb reticuladas intratetraméricamente, las Hb oligomerizadas y las Hb PEGiladas (Winslow y col., 1998, Vandegriff y col., 1997) no muestra una correlación directa con sus 'efectos hipertensores'. De esta manera, la reducción de la 'actividad hipertensora' no parece ser una correlación directa de, tanto la actividad de unión del NO de la preparación como del tamaño molecular de la preparación. Pero las Hb PEGiladas presentan un nivel de vasoactividad considerablemente inferior en comparación con la Hb oligomerizada. La PEG-Bv-Hb de Enzon que transporta 10 copias de PEG-5000 no presentó prácticamente ningún 'efecto hipertensor'. Vandegriff y col (1998) han señalado que la PEG-Bv-Hb presentó viscosidad y presión oncótica elevadas en comparación con las de las muestras oligomerizadas de Hb. El radio molecular de la Bv-Hb PEGilada de Enzon calculado a partir de la presión oncótica fue considerablemente más grande (15 nm) que el de las Hb oligomerizadas y el radio molecular calculado no es consistente con su masa molecular calculada de 114.000 daltons (Vandegriff y col. 1998). Según esto, se ha teorizado que se debería aumentar el tamaño de la Hb hasta un radio molecular de aproximadamente 15 nm, y esto debería estar acompañado por un considerable aumento en la viscosidad y en la presión oncótica para generar una disolución de Hb no hipertensiva (Winslow, 1999).
En la Hb pegilada de Enzon no hipertensiva, las cadenas de PEG-5000 se unen a los grupos amino α y ∈-amino de las cadenas PEG de Hb de bovino mediante enlaces isopeptídicos. El enlace covalente de PEG está acompañado por la pérdida de la carga positiva neta de los grupos amino derivatizados. En un estudio reciente, se demostró que la modificación monofuncional de la rHb1.1 con glutaraldehído, disminuye la vasoactividad de Hb en algún grado, aunque la oligomerización de rHb1.1 reduce la vasoactividad de Hb en un grado mayor. De esta manera, en la comprensión de la base molecular de la neutralización de la vasoactividad de la Hb mediante PEGilación, necesita considerarse el papel potencial de la modificación de la carga superficial de la Hb que acompaña a la PEGilación.
Para exponer la correlación entre la perturbación de la carga superficial de la Hb resultante de la PEGilación con la generación de Hb no hipertensiva, se han desarrollado nuevos enfoques relacionados con la conservación de la PEGilación de la Hb, es decir, la modificación de la Hb mediante PEG sin alterar la carga superficial de la Hb (Acharya y col. 1996). Se ha usado la elevada reactividad y selectividad de PEG-maleimida respecto de la Cys-93(β) de Hb en condiciones oxidantes para preparar Hb PEGilada homogénea que transporta dos copias de cadenas PEG por tetrámero. Se han generado tres diferentes preparaciones de PEG-HbA que transportan dos copias de PEG-5K,
o PEG-10K o PEG-20K. Se han correlacionado los cambios en el volumen molecular (volumen hidrodinámico), el radio molecular, la viscosidad, y la presión oncótica de la Hb con la masa de PEG unido covalentemente a Hb; y se han correlacionado todas estas propiedades moleculares con el efecto hipertensor. Aunque la viscosidad y la presión oncótica de (PEG20K)2-Hb es comparable a la de la PEG-Bv-Hb de Enzon, una molécula de Hb no hipertensiva, esta Hb PEGilada fue vasoactiva. De esta manera, no se puede conseguir resolver el problema de la vasoactividad dotando sencillamente la molécula de un aumento de la viscosidad, presión osmótica y el volumen molecular (volumen hidrodinámico).
Sumario de la invención
La presente invención proporciona una Hb modificada que tiene un volumen molecular aumentado, elevada viscosidad, elevada presión oncótica, elevada afinidad por el O2, no es hipertensiva y resuelve también el problema de la vasoactividad. Adicionalmente, se puede preparar la Hb modificada de la presente invención en un procedimiento sencillo, flexible y muy eficaz, que hace que la producción de la Hb modificada de la presente invención sea económica.
Más particularmente, la presente invención proporciona una molécula de hemoglobina (Hb) que tiene seis ± una cadenas de PEG, en la que dos de dichas cadenas de PEG se unen a la Cys-93(β) de la Hb, y el resto de cadenas de PEG se unen a grupos tiol introducidos en ∈-H2 de la Hb.
La presente invención proporciona también un procedimiento para preparar una molécula de hemoglobina (Hb) modificada, comprendiendo las etapas de: (a) hacer reaccionar la Hb con un exceso de 8-15 veces de iminotiolano para formar Hb tiolada; y (b) hacer reaccionar la Hb tiolada con un exceso de 16-30 veces de PEG funcionalizado con un resto maleimida, para formar la Hb modificada.
Finalmente, la presente invención proporciona una molécula de Hb modificada preparada según el procedimiento anterior.
Breve descripción de las figuras
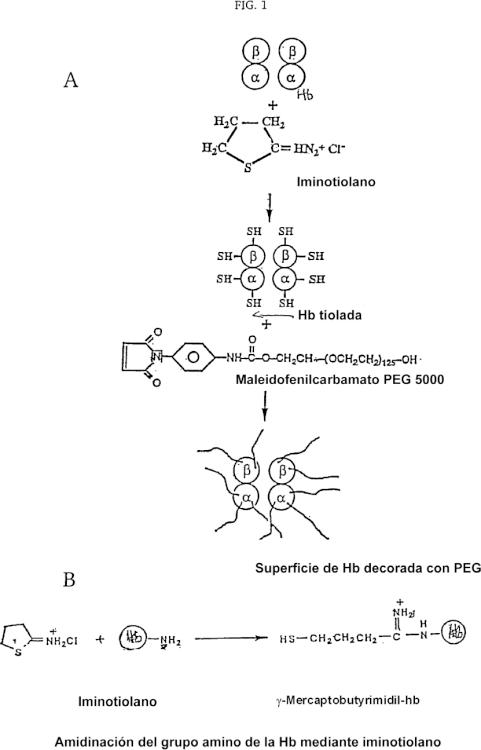
La Figura 1 proporciona una representación esquemática de la PEGilación de Hb basada en la química de la maleimida mediada por tiolación dependiente de iminotiolano. A: representa gráficamente... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de hemoglobina (Hb) no hipertensiva que tiene de seis a siete cadenas de PEG, en la que dos de dichas cadenas de PEG están unidas a la Cys-93(β) de la Hb, y el resto de cadenas de PEG están unidas a grupos tiol introducidos en ε-H2 de la Hb.
2. La molécula de hemoglobina de la reivindicación 1, en la que cada cadena de PEG tiene un peso molecular de 3000-10.000 daltons.
3. La molécula de hemoglobina de la reivindicación 1 o 2, en la que cada cadena de PEG tiene un peso molecular de 5000 daltons.
4. La molécula de hemoglobina de cualquiera de las reivindicaciones 1-3, en la que cada cadena de PEG está unida a la Hb mediante un enlace succinimidilo.
5. Un procedimiento para preparar una molécula de hemoglobina (Hb) no hipertensiva modificada para tener de seis a siete cadenas de PEG, que comprende las etapas de:
(a) hacer reaccionar la Hb con un exceso de 8-15 veces de iminotiolano para formar Hb tiolada;
(b) hacer reaccionar la Hb tiolada con un exceso de 16-30 veces de PEG funcionalizado con un resto maleimida, para formar la Hb modificada que tiene de seis a siete cadenas de PEG; y
(c) aislar la Hb modificada que tiene de seis a siete cadenas de PEG.
6. El procedimiento de la reivindicación 5, en el que la Hb se hace reaccionar con un exceso de 9-12 veces de iminotiolano en la etapa (a).
7. El procedimiento de la reivindicación 5 o 6, en el que la Hb se hace reaccionar con un exceso de 10 veces de iminotiolano en la etapa (a).
8. El procedimiento de cualquiera de las reivindicaciones 5-7, en el que la Hb tiolada se hace reaccionar con un exceso de 18-22 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
9. El procedimiento de cualquiera de las reivindicaciones 5-8, en el que la Hb tiolada se hace reaccionar con un exceso de 20 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
10. El procedimiento de la reivindicación 5, en el que la Hb se hace reaccionar con un exceso de 9-12 veces de iminotiolano en la etapa (a), y la Hb tiolada se hace reaccionar con un exceso de 18-22 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
11. El procedimiento de la reivindicación 5, en el que la Hb se hace reaccionar con un exceso de 9-12 veces de iminotiolano en la etapa (a), y la Hb tiolada se hace reaccionar con un exceso de 20 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
12. El procedimiento de la reivindicación 5, en el que la Hb se hace reaccionar con un exceso de 10 veces de iminotiolano en la etapa (a), y la Hb tiolada se hace reaccionar con un exceso de 18-22 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
13. El procedimiento de la reivindicación 5, en el que la Hb se hace reaccionar con un exceso de 10 veces de iminotiolano en la etapa (a), y la Hb tiolada se hace reaccionar con un exceso de 20 veces de PEG funcionalizado con un resto maleimida en la etapa (b).
14. El procedimiento de cualquiera de las reivindicaciones 5-13 en el que el PEG tiene un peso molecular de 3.000-10.000 daltons.
15. El procedimiento de cualquiera de las reivindicaciones 5-14 en el que el PEG tiene un peso molecular de
5.000 daltons.
Patentes similares o relacionadas:
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Solución conservante para hemoproteína, y procedimiento de estabilización de hemoproteína, del 29 de Abril de 2020, de EIKEN KAGAKU KABUSHIKI KAISHA: Un procedimiento de estabilización de una hemoproteína, en el que se hace coexistir un ácido disulfónico o una de sus sales en una muestra que comprende una […]
MEDICAMENTO ÚTIL COMO SUSTITUTO SANGUÍNEO PARA TRATAR, A LA VEZ, LA ANEMIA AGUDA POR PÉRDIDA DE SANGRE Y LA INFECCIÓN BACTERIANA EN MAMÍFEROS, del 27 de Febrero de 2020, de UNIVERSIDAD AUSTRAL DE CHILE: La presente invención se refiere al uso de la hemoglobina extracelular aislada de purificada de un anélido nativo de Chile, preferentemente de la especie […]
Secreción de polipéptidos que contienen hemo, del 19 de Febrero de 2020, de Impossible Foods Inc: Método de producción de un polipéptido que contiene hemo seleccionado del grupo que consiste en una leghemoglobina, una eritrocruorina, una hemoglobina no simbiótica, […]
Elementos reguladores distales de bcl11a como dianas para la reinducción de la hemoglobina fetal, del 12 de Abril de 2019, de THE CHILDREN'S MEDICAL CENTER CORPORATION: Un método para producir una célula progenitora hematopoyética que tiene disminución del ARNm o la expresión proteica de BCL11A, el método comprende […]
Procedimiento para retirar hemoglobina no modificada de soluciones de hemoglobina reticulada que incluyen hemoglobina polimérica con aparato de tratamiento térmico de corta duración a altas temperaturas, del 21 de Febrero de 2018, de Billion King International Limited: Un procedimiento para la preparación de una composición farmacéutica que contenga un portador de oxígeno altamente purificado y termoestable, incluyendo […]
Composiciones hemoactivas y procedimientos para su fabricación y uso, del 10 de Enero de 2018, de FUSION MEDICAL TECHNOLOGIES, INC.: Material hemoactivo seco que comprende: un polímero biológicamente compatible reticulado que forma un hidrogel cuando se expone a la sangre; y un polímero […]
Composiciones de hemoglobina y métodos de uso, del 12 de Abril de 2017, de Boston Therapeutics, Inc: Un método para producir una molécula híbrida de hemoglobina, útil para formar un sustituto de sangre estable, a partir de hemoglobina contenida en una solución […]