ANTICUERPOS DIRIGIDOS CONTRA EPHA2 COMO UN DIAGNÓSTICO DE CÁNCER.
Un procedimiento in vitro de detección de la presencia de células cancerosas metastásicas en una población de células seleccionada que comprende:
ensayar al menos una porción de la población de células seleccionada respecto a la expresión en exceso de la EphA2, en el que la expresión en exceso es indicativa de la presencia de una célula cancerosa metastásica en la población de células seleccionada
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2000/022669.
Solicitante: PURDUE RESEARCH FOUNDATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1291 CUMBERLAND AVENUE WEST LAFAYETTE, IN 47906 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KINCH, MICHAEL, SCOTT, KILPATRICK, KATHERINE E., ZANTEK,NICOLE,DODGE.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Agosto de 2000.
Fecha Concesión Europea: 6 de Octubre de 2010.
Clasificación Internacional de Patentes:
- C07K16/32 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra productos de traducción de oncogenes.
- G01N33/574V
Clasificación PCT:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
Clasificación antigua:
- C12Q1/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357296_T3.pdf

Fragmento de la descripción:
Campo de la invención
La presente invención se refiere al diagnóstico de una enfermedad metastásica. Más concretamente, la presente invención se refiere a reactivos que pueden detectar una tirosina cinasa específica de células epiteliales. Más 5 concretamente, la presente invención se refiere a reactivos que se unen a la tirosina cinasa de células epiteliales y al uso de estos reactivos para el diagnóstico de cáncer.
Antecedentes y resumen de la invención
La metástasis de células cancerosas requiere capacidad celular para 1) separarse de un tumor primario, 2) migrar e invadir tejidos locales, 3) translocar a lugares lejanos del cuerpo (a través de la linfa o la sangre), 4) colonizar un lugar 10 extraño y 5) crecer y sobrevivir en este entorno extraño. Todos estos comportamientos están relacionados con las adhesiones celulares. Las adhesiones celulares controlan las interacciones físicas de las células con su microentorno. Las adhesiones celulares también inician señales que dictan el crecimiento, muerte y diferenciación de las células tumorales.
Se sabe que diversas células cancerosas, incluyendo las células de cáncer de mama, presentan una adhesión celular alterada. En comparación con los epitelios de mama normales, las células epiteliales de mama humanas 15 transformadas han disminuido los contactos célula-célula y aumentado las interacciones con la matriz extracelular circundante. Estos cambios facilitan una mayor separación y migración de células cancerosas lejos de las colonias celulares y están directamente relacionados con la alteración de la fosforilación de la tirosina de las proteínas de la membrana celular. La fosforilación de la tirosina es una potente forma de transducción de señales celulares y se cree que la alteración de los niveles de fosforilación de la tirosina es importante para la invasividad de las células tumorales. Por 20 tanto, la regulación de la fosforilación de la tirosina representa un objetivo prometedor para la intervención terapéutica frente al cáncer metastásico. La fosforilación de la tirosina está controlada por las tirosina cinasas de la membrana celular y se sabe que, en las células cancerosas metastásicas, se produce una mayor expresión de las tirosina cinasas.
La identificación de una mayor expresión de las tirosina cinasas de la membrana celular ayudaría en el diagnóstico y tratamiento de las enfermedades metastásicas. Una de tales tirosina cinasas es la EphA2. Miembro de la 25 familia Eph de tirosina cinasas conocidas como efrinas, la EphA2 es un receptor transmembrana de la tirosina cinasa con un ligando unido a la célula. Aunque se clonaron hace una década, véase Lindberg, R.A. y Hunter, T., "cDNA Cloning and Characterization of Eck, an Epithelial Cell Receptor Protein-tyrosine Kinase in the Eph/elk Family of Protein Kinases," Mol. Cell. Biol. 10 (12), 6316-6324 (1990), se sabe bastante poco sobre la función de la EphA2, en gran parte debido a que, en el pasado, los anticuerpos específicos de EphA2 han sido difíciles de generar. 30
El documento de Zantek y col. (Noviembre, 1998), Mol. Biol. Cell vol. 9 (supl.), página 134A, desvela que, en los epitelios de mama, la EphA2 se expresa, fosforilada y enriquecida en los contactos célula-célula en células normales; no se expresa en células cancerosas poco invasivas; está expresada y no fosforilada en las ondulaciones de la membrana en células metastásicas.
Para facilitar la investigación sobre la EphA2, se ha desarrollado un procedimiento mejorado para generar un 35 panel de anticuerpos monoclonales específicos de proteínas fosforiladas en la tirosina. Usando este procedimiento, se ha generado una multiplicidad de anticuerpos monoclonales que reconocen la EphA2. Estos anticuerpos se han usado para mostrar que la EphA2 está expresada en exceso en células metastásicas de mama, pulmón, colon y próstata. Debido a que la EphA2 se expresa de forma diferente en células normales y metastásicas, los anticuerpos específicos de EphA2 son útiles en el diagnóstico de una enfermedad metastásica. Los anticuerpos producidos por un hibridoma concreto 40 reconocen un epítopo intracelular de la EphA2 y han mostrado que son muy específicos al unirse a la EphA2.
Por tanto, un aspecto de la presente invención es un procedimiento según las reivindicaciones 1 y 34. También se desvela un procedimiento para generar anticuerpos que reconocen epítopos intracelulares de la EphA2. Otro aspecto de la presente invención es el uso de anticuerpos específicos de EphA2 en el diagnóstico de una enfermedad metastásica. También se desvela un reactivo diagnóstico específico para detectar la EphA2, cualquier fragmento de la misma o ADN o 45 ARN que codifican la proteína la EphA2. Un aspecto adicional de la presente invención es un kit que comprende un anticuerpo capaz de unirse específicamente a un epítopo de la EphA2 y que sirve para detectar la unión anticuerpo-EphA2.
Serán evidentes características adicionales de la presente invención para los expertos en la materia tras el estudio de la siguiente descripción detallada de realizaciones preferidas que son ejemplos del mejor modo de llevar a cabo la invención como se considera actualmente. 50
Breve descripción de los dibujos
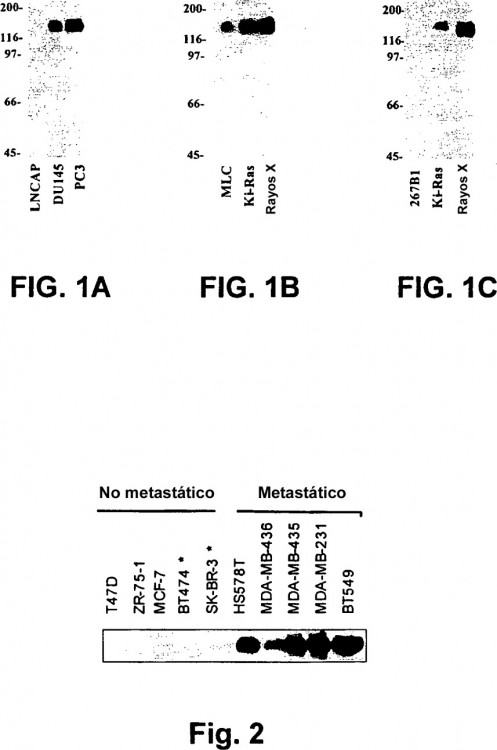
las figs. 1A-C muestran una serie de transferencias western que muestran la expresión de la EphA2 en líneas celulares derivadas de células humanas de próstata;
la fig. 1A es una transferencia western que muestra la expresión de la EphA2 en diversas líneas de células
cancerosas de próstata humanas;
la fig. 1B es una transferencia western que muestra la expresión de la EphA2 en la línea de células epiteliales prostáticas humanas MLC y la expresión en esa línea celular tras su transformación mediante el oncogén K-Ras o irradiación de rayos X;
la fig. 1C es similar a la Fig. 1B, excepto porque muestra la expresión en la línea de células epiteliales prostáticas 5 humanas 267B1 y la expresión en esa línea celular tras su transformación mediante el oncogén K-Ras o irradiación de rayos X;
la fig. 2 es una transferencia western que muestra la expresión de la EphA2 en diversas líneas de células epiteliales de mama humanas;
las figs. 3A-B muestran la localización de la EphA2 en las membranas celulares de diversas líneas de células 10 epiteliales de mama, como se observa mediante microscopía de inmunofluorescencia;
la fig. 3A muestra la localización de la EphA2 en sitios de adhesión celular en células MCF-10A normales; y
la fig. 3B muestra la redistribución de la EphA2 en células malignas.
Descripción detallada de la invención
Se han aislado anticuerpos específicos de EphA2 mediante un procedimiento mejorado. El procedimiento usado 15 está diseñado para una mayor sensibilidad y diversidad de hibridomas sensibles. Según este procedimiento, las proteínas fosforiladas en la tirosina de células epiteliales humanas transformadas con Ras se aíslan por cromatografía de afinidad usando anticuerpos específicos de fosfotirosina existentes. Las proteínas fosforiladas en la tirosina se usan entonces como un inmunogen para producir anticuerpos monoclonales. Se inyectan cantidades en bajas dosis de proteínas fosforiladas en la tirosina cerca de los ganglios linfáticos, días alternos, durante un periodo de diez días (la estrategia de RIMMS). Las 20 células B de los ganglios linfáticos congestionados se aíslan y fusionan entonces con un mieloma que expresa en exceso Bcl-2, para minimizar la apoptosis tras la fusión. Este procedimiento tiene como resultado mayor diversidad, especificidad y rentabilidad de producción de hibridomas. Los hibridomas se criban primero para identificar aquellos hibridomas que producen anticuerpos capaces de distinguir células cancerosas normales y malignas. Hasta la fecha, se han identificado al menos 450 de tales hibridomas. 25
Se han seleccionado los hibridomas que son específicos de EphA2. El uso de la estrategia de RIMMS ha dado como resultado la producción de diversos anticuerpos monoclonales que se unen específicamente a la EphA2. De los cuatro primeros hibridomas caracterizados, dos reconocen epítopos independientes de la EphA2. El primero, D7, reconoce un epítopo intracelular. El segundo, B2D6, se une a un epítopo extracelular. El D7 ha demostrado ser muy específico para un epítopo intracelular de la EphA2 y esta especificidad proporciona gran parte de la... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento in vitro de detección de la presencia de células cancerosas metastásicas en una población de células seleccionada que comprende:
ensayar al menos una porción de la población de células seleccionada respecto a la expresión en exceso de la EphA2, en el que la expresión en exceso es indicativa de la presencia de una célula cancerosa metastásica en la población de células 5 seleccionada.
2. El procedimiento de la reivindicación 1, que comprende además determinar el estado de una enfermedad metastásica en la población de células.
3. El procedimiento in vitro de la reivindicación 1, que comprende
(a) incubar las células con 10
(i) un reactivo capaz de unirse específicamente a la EphA2; o
(ii) un reactivo capaz de unirse específicamente a un ARN que codifica al menos una porción de una proteína EphA2 para posibilitar la unión del reactivo a la EphA2 o al ARN;
(b) detectar el reactivo que se une a la EphA2 o al ARN; y
(c) detectar la expresión en exceso de la EphA2, en el que la expresión en exceso de la EphA2 es indicativa de la 15 presencia de células metastásicas o potencialmente metastásicas en la población de células.
4. El procedimiento de la reivindicación 3, que comprende además lisar al menos una porción de la población de células antes de la incubación con el reactivo.
5. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el reactivo es un anticuerpo.
6. El procedimiento de la reivindicación 5, en el que el anticuerpo es capaz de unirse específicamente a un epítopo 20 intracelular de la EphA2.
7. El procedimiento de la reivindicación 5 ó 6, en el que el anticuerpo es producido por la línea celular de hibridomas D7.
8. El procedimiento de la reivindicación 5, en el que el anticuerpo es capaz de unirse específicamente a un epítopo extracelular de la EphA2. 25
9. El procedimiento de la reivindicación 8, en el que el anticuerpo es producido por la línea celular del hibridoma B2D6.
10. El procedimiento de una cualquiera de las reivindicaciones 5 a 9, en el que el reactivo se marca con al menos un marcador detectable y la etapa de detección incluye detectar el marcador.
11. El procedimiento de la reivindicación 10, en el que el marcador detectable se selecciona del grupo constituido por 30 un marcador fluorescente, un marcador quimioluminiscente, un marcador bioluminiscente, un marcador enzimático, un marcador cromogénico y un radiomarcador.
12. El procedimiento de las reivindicaciones 3 a 11, en el que la etapa de detección incluye un procedimiento de diagnóstico seleccionado del grupo constituido por ensayos ELISA y citometría de flujo.
13. El procedimiento de una cualquiera de las reivindicaciones 5 a 11, en el que las etapas de incubación y detección 35 comprenden metodología de transferencia western.
14. El procedimiento de la reivindicación 13, que comprende además las etapas de proporcionar un segundo anticuerpo que tiene especificidad por la fosfotirosina y transferencia western con el segundo anticuerpo.
15. El procedimiento de la reivindicación 3, en el que la unión con el reactivo proporciona un complejo de unión que comprende una célula completa. 40
16. El procedimiento de la reivindicación 15, en el que detectar la unión con el reactivo comprende someter el complejo de unión a tinción inmunohistoquímica.
17. El procedimiento de la reivindicación 3, que comprende además la etapa de fijar las células a un porta y la etapa de detección comprende tinción inmunofluorescente.
18. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende 45 células seleccionadas del grupo constituido por células de mama, células de riñón, células de próstata, células de pulmón y
células de colon.
19. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende células epiteliales.
20. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende células seleccionadas del grupo constituido por células cancerosas de mama, células cancerosas de riñón, células 5 cancerosas de próstata, células cancerosas de pulmón y células cancerosas de colon.
21. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende células cancerosas epiteliales.
22. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que las células cancerosas metastásicas comprenden células seleccionadas del grupo constituido por células cancerosas de mama, células 10 cancerosas de riñón, células cancerosas de próstata, células cancerosas de pulmón y células cancerosas de colon.
23. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que las células cancerosas metastásicas comprenden células cancerosas epiteliales.
24. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende células de una biopsia tisular. 15
25. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la población de células comprende células de una biopsia tisular de mama o próstata.
26. El procedimiento de una cualquiera de las reivindicaciones 1 ó 23, en el que la población de células comprende células de un fluido corporal.
27. El procedimiento de la reivindicación 26, en el que las células se recogen de un fluido corporal seleccionado del 20 grupo constituido por sangre, plasma, líquido cefalorraquídeo, saliva y orina.
28. El procedimiento de la reivindicación 1, en el que ensayar la población de células comprende incubar al menos una porción de la población de células cancerosas con un reactivo capaz de unirse a la EphA2 para posibilitar la unión del reactivo a la EphA2; y detectar la unión al reactivo.
29. El procedimiento de la reivindicación 28, en el que el reactivo es un anticuerpo. 25
30. El procedimiento de la reivindicación 29, en el que el anticuerpo es producido por el hibridoma D7 o B2D6.
31. Uso de un anticuerpo capaz de unirse específicamente a un epítopo de la EphA2 y medios para detectar dicha unión anticuerpo-epítopo para detectar la presencia de células metastásicas en un población de células.
32. El uso de la reivindicación 31, en el que el medio para detectar la unión anticuerpo-epítopo es un marcador unido al anticuerpo. 30
33. El uso de la reivindicación 31 ó 32, que comprende además un anticuerpo que tiene especificidad por la fosfotirosina.
34. Un procedimiento para distinguir entre cánceres metastásicos y no metastásicos, que comprende determinar la expresión de la EphA2 con anticuerpos dirigidos contra EphA2, en el que la expresión en exceso de la EphA2 indica que el cáncer es metastásico y la ausencia de expresión de la EphA2 indica que el cáncer es no metastásico. 35
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Anticuerpos contra HER2 biespecíficos, del 1 de Julio de 2020, de MEDIMMUNE, LLC: Un anticuerpo anti-HER2 biespecifico que comprende un primer dominio de union a antigeno de inmunoglobulina y un segundo dominio de union a antigeno de inmunoglobulina, […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo anti-CD3 que es un anticuerpo biespecífico, en donde el anticuerpo biespecífico comprende un brazo anti-CD3 que comprende un primer dominio de unión que […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo biespecífico que comprende un brazo anti-CD3 que comprende un primer dominio de unión que comprende (a) un dominio VH que comprende una secuencia de aminoácidos […]
Inmunotoxinas de unión a CD20 para inducir la internalización celular y procedimientos que usan las mismas, del 6 de Mayo de 2020, de MOLECULAR TEMPLATES, INC: Una proteína de unión a CD20 que comprende: a) una región de unión a CD20 que comprende una región de unión de tipo inmunoglobulina: (i) capaz […]
Células NK-92 que expresan CAR como agentes terapéuticos celulares, del 6 de Mayo de 2020, de CHEMOTHERAPEUTISCHES FORSCHUNGSINSTITUT GEORG-SPEYER-HAUS: Una célula o línea celular NK-92 específica de ErbB2, que contiene un vector lentiviral que codifica un receptor de antígeno quimérico que comprende […]
Moléculas de fusión anticuerpos-mutante de interferón modificadas, del 6 de Mayo de 2020, de ImmunGene, Inc: Una molécula de fusión genéticamente modificada que comprende un anticuerpo antígeno asociado a tumor (AAT) (Ab) unido a una molécula mutante de interferón alfa (IFN-α), […]
Proteínas que comprenden regiones efectoras de la subunidad A de la toxina Shiga próximas al extremo amino terminal y regiones de unión de tipo inmunoglobulina de reconocimiento celular capaces de unirse específicamente a HER2/neu/ErbB2, del 6 de Mayo de 2020, de MOLECULAR TEMPLATES, INC: Proteína citotóxica que comprende: a) una región de unión de tipo inmunoglobulina que comprende uno o más polipéptidos y es capaz de unirse específicamente a […]