VEHICULO BIOADHESIVO PARA LAS MUCOSAS DE LIBERACION RETARDADA PARA LA ADMINISTRACION DE PRINCIPIOS ACTIVOS.
Un procedimiento para la preparación de un vehículo bioadhesivo para las mucosas de liberación retardada que comprende:
a) mezclar, como mínimo, un principio activo con un alquilsulfato de metal alcalino y un diluyente; b) humectar la citada mezcla con un aglutinante; c) secar y calibrar la citada mezcla; d) granular la citada mezcla para formar gránulos primarios; e) mezclar los citados gránulos primarios con, como mínimo, un polímero bioadhesivo y con, como mínimo, un polímero de liberación sostenida y con, como mínimo, un agente de compresión y f) comprimir la mezcla citada en e)
Tipo: Resumen de patente/invención. Número de Solicitud: W07001662IB.
Solicitante: BIOALLIANCE PHARMA.
Nacionalidad solicitante: Francia.
Dirección: 49, BOULEVARD DU GENERAL MARTIAL VALIN,75015 PARIS.
Inventor/es: COSTANTINI,DOMINIQUE, LEMARCHAND,CAROLINE.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A61K31/4178 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensados y conteniendo otros heterociclos, p. ej. pilocarpina, nitrofurantoína.
- A61K31/4468 A61K 31/00 […] › teniendo un átomo de nitrógeno unido directamente en posición 4, p. ej. cleboprida, fentanil.
- A61K31/522 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. hipoxantina, guanina, aciclovir.
- A61K9/00M18D
Clasificación PCT:
- A61K31/4178 A61K 31/00 […] › no condensados y conteniendo otros heterociclos, p. ej. pilocarpina, nitrofurantoína.
- A61K31/4468 A61K 31/00 […] › teniendo un átomo de nitrógeno unido directamente en posición 4, p. ej. cleboprida, fentanil.
- A61K31/522 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. hipoxantina, guanina, aciclovir.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
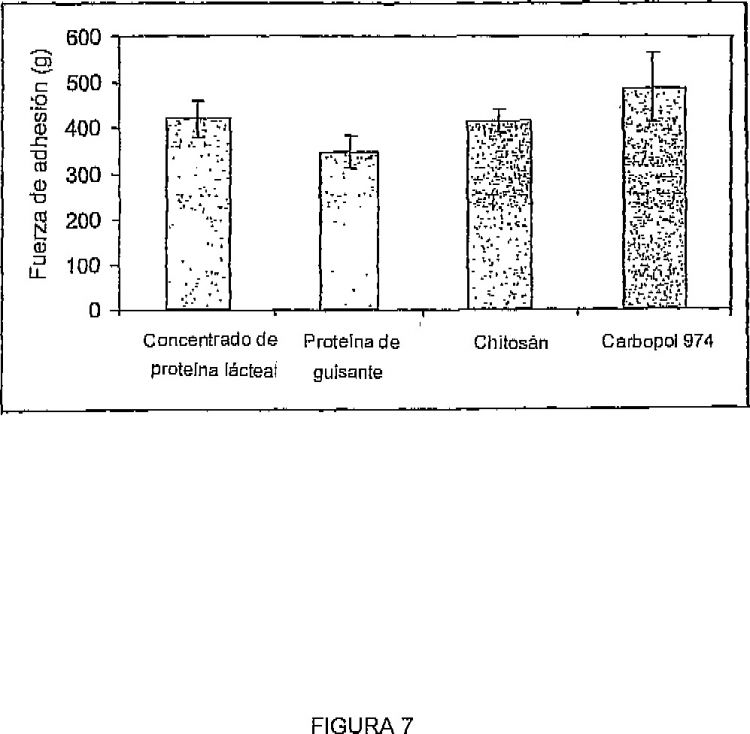
Fragmento de la descripción:
Vehículo bioadhesivo para las mucosas de liberación retardada para la administración de principios activos.
1. Campo de la invención
La presente invención se refiere a un vehículo bioadhesivo de liberación retardada para la liberación prolongada y controlada de un principio activo que se puede utilizar sobre las superficies de las mucosas. También se describen un procedimiento para la fabricación del sistema bioadhesivo, un procedimiento para la administración de un ingrediente activo a un mamífero, así como procedimientos para tratar, curar o prevenir distintas dolencias médicas.
2. Antecedentes de la invención y técnica anterior relacionada
Las membranas mucosas son recubrimientos de origen ectodérmico, cubiertas de epitelio y que están implicadas en la absorción y la secreción. Recubren distintas cavidades corporales que se encuentran expuestas al medioambiente exterior así como órganos internos, tales como las fosas nasales, los labios, las orejas, la zona genital, el tracto digestivo y el ano. Las partes del cuerpo que contienen membranas mucosas incluyen la mayor parte del tracto respiratorio y todo el tracto gastrointestinal, así como la vagina, el cuello del útero, el clítoris, el recubrimiento del glande y el interior del prepucio. Muchas de las membranas mucosas anteriormente mencionadas segregan mucosidad, que es un coloide viscoso que contiene enzimas antisépticas tales como lisozimas e inmunoglobulinas y está constituida por mucinas y sales inorgánicas suspendidas en agua.
Uno de los problemas asociados con un sistema bioadhesivo de administración de fármaco para las membranas mucosas es que la naturaleza lubricante de las membranas mucosas permite que la sustancia activa se limpie o se diluya, lo que reduce la biodisponibilidad del fármaco de forma que el fármaco administrado no trata de forma eficaz la dolencia médica a la que se está enfrentando. Otro problema es que en la cavidad oral, el hecho de comer, beber y hablar y la constante reposición de la saliva a menudo afecta a la administración de la sustancia activa.
Los sistemas bioadhesivos de administración en la mucosa oral también son bien conocidos en la técnica y se usan para tratar diversas dolencias médicas. Estos sistemas de administración están hechos en general de carbómeros solubles en agua o de polímeros insolubles que pueden contener almidón de maíz como desintegrante y/o lactosa como diluyente o aglutinante. En general, la administración del principio activo tiene lugar durante un periodo de menos de 11 horas. Así, en estos sistemas de administración de fármacos el vehículo se tiene que sustituir, como mínimo, dos veces al día.
Por ejemplo, la patente de EE.UU. Nº 5.643.603 describe una composición de un vehículo bioadhesivo de administración sostenida para la administración de un fármaco, composición que se hace a partir de una mezcla de almidón pregelatinizado y un polímero sintético tal como ácido poliacrílico, hidroxietilcelulosa, carboximetilcelulosa, PVA, PVP y PEG (95%) y un fármaco (entre el 0,1 y el 5%). Este bioadhesivo se puede adherir a la mucosa o a los dientes y se estimó que administraba el fármaco durante un periodo de siete horas.
En la patente de EE.UU. Nº 6.248.358 se da a conocer otra forma de un comprimido de bioadhesivo en la que el ingrediente activo se protege del agua y del medio ambiente que lo rodea. Este comprimido contiene entre el 5 y el 50% en peso de hidroxipropilmetilcelulosa, entre el 0,5 y el 25% en peso de almidón de maíz, entre el 1 y el 50% en peso de lactosa, entre el 0,5 y el 10% en peso de policarbofil entrecruzado insoluble en agua y entre el 1 y el 75% en peso de carbomer o de carbomer 974P. Este comprimido hidratado de liberación sostenida puede administrar el ingrediente activo al torrente sanguíneo a través de la cavidad vaginal o bucal del paciente.
En la patente de EE.UU. Nº 6.303.147 se describe una forma farmacéutica bioadhesiva sólida, que tiene entre el 0,001 y el 10% de un ingrediente activo, entre el 80 y el 98% de almidón pregelatinizado, entre el 1 y el 10% de un polímero formador de matriz hidrófila tal como ácido poliacrílico, carbomer, hidroxietilcelulosa, HPMC, carboximetilcelulosa, PVA o mezclas de estos polímeros hidrófilos, entre el 0,2 y el 5% de estearil fumarato de sodio y entre el 0 y el 1% de un deslizante. Se puede usar para administración por vía bucal, nasal, rectal o vaginal. El tiempo de adhesión de estos comprimidos es de aproximadamente nueve horas.
La patente de EE.UU. Nº 6.916.485 tal como se publica como el documento US 2003/0108603 A1 describe un sistema terapéutico bioadhesivo de liberación prolongada que contiene entre 10 y 2.000 mg de ingrediente activo, el 50% en peso de proteínas naturales, como mínimo el 20% en peso de concentrado de proteína láctea, entre el 10 y el 20% en peso de un polímero hidrófilo, un excipiente para compresión tal como almidón de maíz, lactosa o poliol y entre el 3,5 y el 10% en peso de alquilsulfato de metal alcalino. Este sistema es un comprimido mucoadhesivo para administración a la mucosa.
Todas y cada una de las patentes concedidas anteriores utilizan almidón de maíz como desintegrante o agentes que juegan un papel en la liberación prolongada del ingrediente activo. Además, todas y cada una de estas patentes dan a conocer en sus formulaciones el uso de lactosa como diluyente o como aglutinante. Las patentes de EE.UU. números 5.643.603, 6.303.147 y 6.916.485 dan a conocer la administración del principio activo entre 7 y 13 horas.
Sin embargo, muchas personas presentan intolerancia a la lactosa o son alérgicas al maíz. Por consiguiente, en esta población de personas es imposible usar sistemas de administración a la mucosa que contengan lactosa o maíz.
Por otra parte, en muchos de los sistemas bioadhesivos de liberación retardada mencionados anteriormente, la formulación de principios activos poco solubles o insolubles en medios acuosos es difícil. Diversas categorías de agentes medicinales tales como antivirales, analgésicos, antiinflamatorios, antibióticos y antisépticos tienen componentes que son difíciles de formular y de administrar debido a su baja solubilidad o a su insolubilidad en medios acuosos. Un ejemplo de un antiséptico con baja solubilidad acuosa es el yodo, que cristaliza cuando se pone en agua. Otro ejemplo de un analgésico insoluble que es difícil de formular es fentanilo base. Numerosos agentes antivirales e inmunosupresores tales como aciclovir también son difíciles de formular, tienen mala penetración percutánea y presentan complicaciones que surgen debido a la administración por vía intramuscular a un pH fuertemente alcalino de 10-11.
Por ejemplo, la absorción por vía oral de aciclovir es muy variable, con una biodisponibilidad que varía entre el 15% y el 30%. En pacientes bajo tratamiento sistémico, el régimen es de comprimidos de 200 mg administrados cinco veces al día. Además, después de la administración sistémica de aciclovir por vía oral, en la saliva se encuentran concentraciones pico de aciclovir en el extremo inferior del 50% de la dosis inhibitoria del virus del herpes simple 1. El tratamiento local con aciclovir en forma crema también es malo debido a la mala absorción percutánea. Esta crema se debe aplicar, como mínimo, 5 veces al día durante un periodo de 5 días.
Los pacientes que estén siendo tratados de enfermedades malignas o de VIH tienen complicaciones orales adicionales asociadas con su enfermedad en particular, debido a la inmunosupresión. Por ejemplo, algunas de las manifestaciones orales más comunes en personas que están infectadas por el SIDA incluyen infecciones bacterianas tales como enfermedad periodontal, infecciones por hongos tales como la candidiasis, infecciones virales tales como el virus de Epstein-Barr, leucoplaquia oral vellosa, virus del herpes simple 1, virus varicella-zoster, virus del papiloma humano, citomegalovirus, neoplasmas tales como sarcoma de Kaposi y linfoma y otras lesiones orales que incluyen úlceras orales y agrandamiento de las glándulas salivares. El dolor oral puede estar asociado con cada una de estas complicaciones.
Asimismo, las personas que están sometidas a quimioterapia y a radiación de cabeza/cuello también tienen complicaciones orales que incluyen mucositis, infección, disfunción de las glándulas salivares, disfunción del sentido del gusto, infecciones virales, por hongos y bacterianas, xerostomía y mucositis gastrointestinal causadas por las modificaciones secundarias experimentadas en la cavidad oral. En aproximadamente...
Reivindicaciones:
1. Un procedimiento para la preparación de un vehículo bioadhesivo para las mucosas de liberación retardada que comprende:
2. El procedimiento según la reivindicación 1, en el que el citado, como mínimo, un principio activo es un principio activo hidrosoluble y en el que el citado, como mínimo, un diluyente es un diluyente insoluble.
3. El procedimiento según la reivindicación 1 ó la reivindicación 2, en el que el citado, como mínimo, un principio activo es un principio activo insoluble y en el que el citado, como mínimo, un diluyente es un diluyente hidrosoluble.
4. El procedimiento según una cualquiera de las reivindicaciones 1 a 3, en el que el aglutinante es polivinilpirrolidona.
5. El procedimiento según una cualquiera de las reivindicaciones 1 a 4, en el que el, como mínimo, un polímero bioadhesivo comprende proteínas naturales seleccionadas entre el grupo de proteínas naturales lácteas, carbomer, alginato, chitosán, goma de xantano, hidroxipropilcelulosa, alcohol polivinílico, carboximetilcelulosa, hidroxipropilmetilcelulosa, hidroxietilcelulosa, hialuronato de sodio, polímeros acrílicos y mezclas de los mismos.
6. El procedimiento según una cualquiera de las reivindicaciones 1 a 5, en el que el, como mínimo, un polímero de liberación sostenida es un polímero de celulosa o un derivado de un polímero de celulosa.
7. El procedimiento según la reivindicación 6, en el que el citado polímero de celulosa es hipromelosa.
8. El procedimiento según una cualquiera de las reivindicaciones 1 a 7, en el que el citado, como mínimo, un principio activo se selecciona entre: un antiviral, un antifúngico, un analgésico, un anestésico, un antálgico, un antiemético, un agente estimulador de la producción salival, un antiséptico, un antiinflamatorio, un antibiótico y mezclas de los mismos.
9. El procedimiento según la reivindicación 8, en el que el, como mínimo, un principio activo se encuentra asociado con un principio activo adicional seleccionado entre: un antiviral, un antifúngico, un analgésico, un anestésico, un antálgico, un antiemético, un agente estimulador de la producción salival, un antiséptico, un antiinflamatorio, un antibiótico y mezclas de los mismos.
10. Un vehículo bioadhesivo para las mucosas de liberación retardada que se puede obtener mediante el procedimiento de la reivindicación 1, que comprende entre 10 y 200 mg de un agente antiviral seleccionado entre el grupo de aciclovir, valaciclovir, ganciclovir y zidovudina, entre el 1 y el 75% en peso de celulosa microcristalina, entre el 2 y el 10% en peso de laurilsulfato de sodio y entre el 0,5 y el 5% en peso de polivinilpirrolidona y entre el 10 y el 40% en peso de, como mínimo, un polímero bioadhesivo seleccionado entre el grupo de proteínas naturales lácteas y mezclas de los mismos y entre el 10% y el 40% en peso de hipromelosa.
11. El vehículo bioadhesivo para las mucosas de liberación retardada según la reivindicación 10, en el que el citado antiviral es aciclovir.
12. El vehículo bioadhesivo para las mucosas de liberación retardada según la reivindicación 11, en el que el citado aciclovir se encuentra presente en una cantidad de entre 10 y 500 mg en el citado vehículo.
13. El vehículo bioadhesivo para las mucosas de liberación retardada según la reivindicación 11, en el que el citado aciclovir se encuentra presente en una cantidad de entre 50 y 100 mg en el citado vehículo.
14. El vehículo bioadhesivo para las mucosas de liberación retardada según una cualquiera de las reivindicaciones 11 a 13, en el que el citado vehículo está desprovisto de lactosa y de almidón de maíz.
15. El vehículo bioadhesivo para las mucosas de liberación retardada según una cualquiera de las reivindicaciones 11 a 14, en el que el, como mínimo, un principio activo se encuentra asociado con, como mínimo, dos principios activos adicionales seleccionados entre: un antiviral, un antifúngico, un analgésico, un anestésico, un antálgico, un antiemético, un agente estimulador de la producción salival, un antiséptico, un antiinflamatorio, un antibiótico y mezclas de los mismos.
16. Uso del vehículo bioadhesivo para las mucosas de liberación retardada según la reivindicación 10 para la fabricación de un medicamento para tratar enfermedades de las mucosas.
17. Uso según la reivindicación 16, en el que las enfermedades de las mucosas son enfermedades bucales.
18. Uso según la reivindicación 17, en el que las enfermedades bucales se seleccionan entre: complejo de herpes simple 1 (HSV-1), herpes genital (HSV-2), mucositis oral, candidiasis oral, leucoplaquia oral vellosa, úlceras orales, alteraciones de las glándulas salivares, flora oral alterada (flora bacteriana disminuida), disfunción del sentido del gusto, periodontitis, xerostomía, mucositis gastrointestinal que causa cambios secundarios en el estado oral que incluyen inflamación, dolor intacto y local durante la higiene y durante el régimen alimenticio.
19. Uso del vehículo bioadhesivo para las mucosas de liberación retardada según la reivindicación 11 para la fabricación de un medicamento para tratar complejo de herpes simple 1 (HSV-1), herpes genital (HSV-2), virus varicella zoster (VZV, por sus siglas en inglés), virus de Epstein-Barr, virus del herpes humano 8, gripe aviar, paperas, VIH, virus respiratorio sincitial, gripe, infecciones por el virus parainfluenza y citomegalovirus.
Patentes similares o relacionadas:
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivado de amina cíclica y utilización farmacéutica del mismo, del 20 de Mayo de 2020, de TORAY INDUSTRIES, INC.: Derivado de amina cíclica representado por una fórmula general (I) o sal aceptable farmacológicamente del mismo: **(Ver fórmula)** en la que n representa 1, […]
Compuestos con actividad antitumoral, del 8 de Abril de 2020, de AB SCIENCE: Un compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde: R1 es un grupo alquilo; R4 es un grupo alcoxi […]
Medicamentos para el tratamiento o la prevención de enfermedades fibróticas, del 25 de Marzo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: 3-Z-[1-(4-(N-((4-metil-piperazin-1-il)-metilcarbonil)-N-metil-amino)-anilino)-1-fenil-metilen]-6-metoxicarbonil-2- indolinona, los tautómeros, los diastereómeros,…
Compuestos espirocíclicos, del 26 de Febrero de 2020, de Recurium IP Holdings, LLC: Un compuesto de fórmula (I): **(Ver fórmula)** donde: R1 se selecciona del grupo que consiste en hidrógeno, un alquilo opcionalmente sustituido, un […]
Formulación compuesta, que comprende un comprimido esferoidal de múltiples unidades (MUST) encapsulado en una cápsula dura y un método para preparar el mismo, del 19 de Febrero de 2020, de HANMI PHARM. CO., LTD.: Una formulación compuesta de cápsula dura, que comprende dos o más principios farmacéuticamente activos, en donde cada principio farmacéuticamente […]
Derivado de amina cíclica y utilización farmacéutica del mismo, del 15 de Enero de 2020, de TORAY INDUSTRIES, INC.: Derivado de amina cíclica representado por una fórmula general (I) o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** en el que A representa […]
Métodos y composiciones farmacéuticas para tratar la rabdomiólisis, del 1 de Enero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un compuesto seleccionado del grupo que consiste en antagonistas de TLR9 e inhibidores de la expresión de TLR9 para su uso en el tratamiento de la rabdomiólisis […]