PRODUCCION DE UNA PROTEINA DE FUSION TNFR-IG.
Método para producir una proteína de fusión del receptor de factor de necrosis tumoral con inmunoglobulina (TNFR-Ig) en un cultivo celular de producción a gran escala,
que comprende las etapas siguientes:
proporcionar un cultivo celular que comprende:
unas células de mamíferos que contienen un gen que codifica TNFR-Ig, gen el cual es expresado en la condición de cultivo celular; y
un medio que contiene glutamina y que tiene una característica del medio seleccionada de entre el grupo que consiste en: (i) una cantidad acumulativa de aminoácidos por volumen unitario mayor que alrededor de 70 mM, (ii) una relación molar de glutamina acumulativa a asparagina acumulativa menor que alrededor de 2, (iii) una relación molar de glutamina acumulativa a aminoácidos totales acumulativos menor que alrededor de 0,2, (iv) una relación molar de iones inorgánicos acumulativos a aminoácidos totales acumulativos entre alrededor de 0,4 y 1, (v) una cantidad acumulativa combinada de glutamina y asparagina por volumen unitario mayor que alrededor de 16 mM, y sus combinaciones;
mantener dicho cultivo en una fase de crecimiento inicial en un primer conjunto de condiciones de cultivo durante un primer período de tiempo suficiente para permitir que dichas células se reproduzcan hasta una densidad celular viable en un intervalo de alrededor de 20%-80% de la densidad celular viable posible máxima si dicho cultivo se mantuviese en el primer conjunto de condiciones de cultivo;
cambiar por lo menos una de las condiciones de cultivo, de forma que se aplique un segundo conjunto de condiciones de cultivo;
mantener dicho cultivo durante un segundo período de tiempo en el segundo conjunto de condiciones y durante un segundo período de tiempo de forma que TNFR-Ig se acumule en el cultivo celular
Tipo: Resumen de patente/invención. Número de Solicitud: W05030439US.
Solicitante: WYETH RESEARCH IRELAND LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: LITTLE CONNELL,NEWBRIDGE KILDARE.
Inventor/es: DRAPEAU,DENIS, LUAN,YEN-TUNG, MERCER,JAMES,R, WANG,WENGE, LASKO,DANIEL R.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07K14/715B
- C12P21/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00).
- C12P21/02 C12P […] › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Clasificación PCT:
- C12N15/62 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
- C12P21/02 C12P 21/00 […] › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Fragmento de la descripción:
Producción de una proteína de fusión TNFR-Ig.
Solicitud relacionada
La presente solicitud reivindica la prioridad de la solicitud de patente provisional nº 60/605.379, presentada el 27 de agosto de 2004.
Antecedentes de la invención
Las proteínas y polipéptidos se han hecho cada vez más importantes como agentes terapéuticos. En la mayoría de los casos, las proteínas y polipéptidos terapéuticos se producen en cultivo celular, a partir de células que se han manipulado mediante ingeniería y/o se han seleccionado para producir niveles inusualmente elevados de la proteína o polipéptido particular de interés. El control y la optimización de las condiciones del cultivo celular son críticamente importantes para la producción comercial con éxito de proteínas y polipéptidos.
Muchas proteínas y polipéptidos producidos en cultivo celular se obtienen en un proceso discontinuo o discontinuo alimentado, en el que las células se cultivan durante un período de tiempo, y después el cultivo se termina y la proteína o polipéptido producido se aísla. La cantidad y calidad últimas de la proteína o polipéptido producido pueden verse afectadas considerablemente por las condiciones del cultivo celular. Por ejemplo, los procesos tradicionales de cultivo discontinuo y discontinuo alimentado a menudo dan como resultado la producción de productos de desecho metabólicos que tienen efectos perjudiciales sobre el crecimiento celular, la viabilidad, y la producción o estabilidad de la proteína o polipéptido de interés. Aunque se han realizado esfuerzos para mejorar la producción de proteínas y polipéptidos en procesos de cultivo
Adicionalmente, se ha realizado un esfuerzo significativo en el desarrollo de medios definidos (es decir, medios obtenidos a partir de componentes individuales conocidos y que carecen de suero u otros subproductos animales) para uso en el cultivo de células, particularmente células de mamíferos. Las características de crecimiento celular pueden ser muy diferentes en medios definidos, en contraste con los medios derivados de suero. Existe una necesidad particular de desarrollar
Sumario de la invención
La presente invención proporciona un sistema mejorado para la producción a gran escala de proteínas y/o polipéptidos en cultivo celular. Por ejemplo, la presente invención proporciona métodos de cultivo a escala comercial (por ejemplo, 500 l o más) que utilizan un medio caracterizado por uno o más de: i) una cantidad acumulativa de aminoácidos por volumen unitario mayor que alrededor de 70 mM; ii) una relación molar de glutamina acumulativa a asparagina acumulativa menor que alrededor de 2; iii) una relación molar de glutamina acumulativa a aminoácidos totales acumulativos menor que alrededor de 0,2; iv) una relación molar de iones inorgánicos acumulativos a aminoácidos totales acumulativos entre alrededor de 0,4 y 1; o v) una cantidad acumulativa combinada de concentración de glutamina y asparagina por volumen unitario mayor que alrededor de 16 mM. El experto ordinario en la materia entenderá que "acumulativa", como se usa anteriormente, se refiere a la cantidad total de un componente o componentes particulares añadidos a lo largo del cultivo celular, incluyendo componentes añadidos al comienzo del cultivo y componentes añadidos posteriormente. En ciertas formas de realización preferidas de la invención, es deseable minimizar las "alimentaciones" del cultivo a lo largo del tiempo, de forma que es deseable maximizar las cantidades presentes inicialmente. Por supuesto, los componentes del medio se metabolizan durante el cultivo, de forma que los cultivos con las mismas cantidades acumulativas de componentes dados tendrán diferentes niveles absolutos si esos componentes se añaden a diferentes
Según la presente invención, el uso de tal medio permite niveles elevados de producción de proteínas, y reduce la acumulación de ciertos factores indeseables, tales como amonio y/o lactato.
Un experto ordinario en la materia entenderá que las formulaciones de medios de la presente invención engloban tanto medios definidos como no definidos. En ciertas formas de realización preferidas de la presente invención, el medio de cultivo es un medio definido en el que la composición del medio es conocida y controlada.
En ciertas formas de realización preferidas de la presente invención, los métodos de cultivo incluyen cambiar el cultivo desde un primer conjunto de condiciones de cultivo a un segundo conjunto de condiciones de cultivo, de forma que se logra un cambio metabólico de las células. En algunas formas de realización, este cambio se lleva a cabo cuando el cultivo ha alcanzado alrededor de 20-80% de su densidad celular máxima. En algunas formas de realización, el cambio implica cambiar la temperatura (o intervalo de temperaturas) a la que se mantiene el cultivo. Como alternativa o adicionalmente, la presente invención proporciona métodos ajustados de forma que, tras alcanzar un pico, los niveles de lactato y/o de amonio en el cultivo disminuyen con el tiempo. En otras formas de realización, el cambio implica
Los cultivos celulares de la presente invención se pueden suplementar opcionalmente con nutrientes y/u otros componentes del medio, incluyendo hormonas y/u otros factores de crecimiento, iones particulares (tales como sodio, cloruro, calcio, magnesio, y fosfato), tampones, vitaminas, nucleósidos o nucleótidos, oligoelementos (compuestos inorgánicos presentes habitualmente a concentraciones finales muy bajas), aminoácidos, lípidos, o glucosa u otra fuente de energía. En ciertas formas de realización de la presente invención, puede ser beneficioso suplementar los medios con inductores químicos tales como hexametilenbis(acetamida) ("HMBA") y butirato de sodio ("NaB"). Estos suplementos opcionales se pueden añadir al comienzo del cultivo, o se pueden añadir más tarde a fin de reponer los nutrientes agotados, o por otra razón. En general, es deseable seleccionar la composición inicial del medio para minimizar la suplementación según la presente invención. Según la presente invención, se pueden monitorizar diversas condiciones de cultivo, incluyendo pH, densidad celular, viabilidad celular, niveles de lactato, niveles de amonio, osmolaridad, o título del polipéptido o proteína expresado.
Breve descripción de los dibujos
La Figura 1 muestra una comparación del Medio 1 y Medio 2 en matraces de agitación usando células anti-GDF-8.
La Figura 2 muestra el crecimiento celular y la viabilidad de células anti-GDF-8 en Medio 1.
La Figura 3 muestra el crecimiento celular de cultivos de células anti-GDF-8 en condiciones de cultivo de control y sin alimentación de glutamina.
La Figura 4 muestra la viabilidad celular de cultivos de células anti-GDF-8 en condiciones de cultivo de control y sin alimentación de glutamina.
La Figura 5 muestra los niveles de amonio de cultivos de células anti-GDF-8 en condiciones de cultivo de control y sin alimentación de glutamina.
La Figura 6 muestra los niveles de lactado de cultivos de células anti-GDF-8 en condiciones de cultivo de control y sin alimentación de glutamina.
La Figura 7 muestra el título de anti-GDF-8 en condiciones de cultivo de control y sin alimentación de glutamina.
La Figura 8 muestra la densidad celular de cultivos de células anti-GDF-8 en condiciones de cultivo de control y de alimentación desprovista de glutamina.
La Figura 9 muestra la viabilidad celular de cultivos de células anti-GDF-8 en condiciones de cultivo de control y de alimentación desprovista de glutamina.
La Figura 10 muestra los niveles de amonio de cultivos de células anti-GDF-8 en condiciones de cultivo de control y desprovisto de glutamina.
La Figura 11 muestra los niveles de lactato de cultivos de células anti-GDF-8 en condiciones de cultivo de control y desprovisto de glutamina.
La Figura 12 muestra el título de anti-GDF-8 en condiciones de cultivo de control y desprovisto de glutamina.
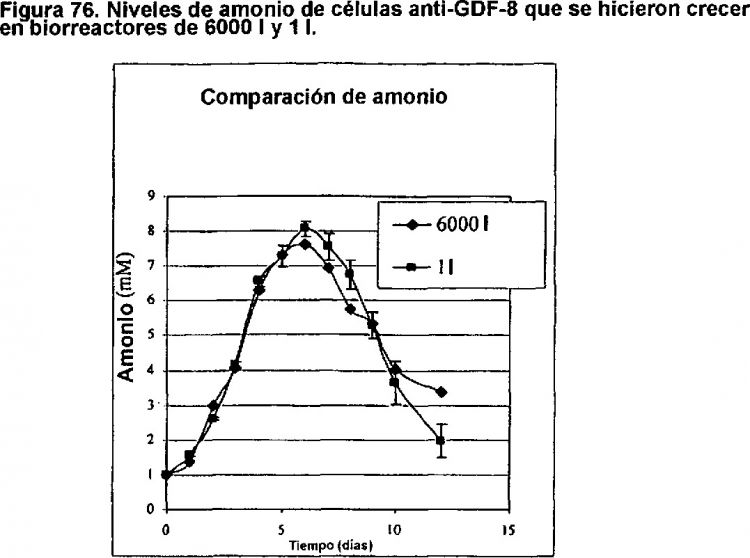
La Figura 13 muestra la respuesta a la dosis de hierro de células anti-GDF-8...
Reivindicaciones:
1. Método para producir una proteína de fusión del receptor de factor de necrosis tumoral con inmunoglobulina (TNFR-Ig) en un cultivo celular de producción a gran escala, que comprende las etapas siguientes:
2. Método según la reivindicación 1, en el que dicho medio contiene una relación molar de glutamina acumulativa a asparagina acumulativa menor que aproximadamente 2; y
dicho medio tiene dos características del medio seleccionadas de entre el grupo que consiste en: (i) un medio que contiene una cantidad acumulativa de aminoácidos por volumen unitario mayor que alrededor de 70 mM, (iii) una relación molar de glutamina acumulativa a aminoácidos totales acumulativos menor que aproximadamente 0,2, (iv) una relación molar de iones inorgánicos acumulativos a aminoácidos totales acumulativos entre aproximadamente 0,4 y 1, (v) una cantidad acumulativa combinada de glutamina y asparagina por volumen unitario mayor que aproximadamente 16 mM, y sus combinaciones.
3. Método según la reivindicación 1, en el que dicha condición de cultivo celular en dicha etapa de cambio de por lo menos una de las condiciones de cultivo se selecciona de entre el grupo que consiste en: (i) temperatura, (ii) pH, (iii) osmolalidad, (iv) nivel de inductor químico, y sus combinaciones.
4. Método según la reivindicación 1, en el que la concentración inicial de glutamina de dicho medio es menor o igual a 10 mM.
5. Método según la reivindicación 1, en el que la concentración inicial de glutamina de dicho medio es menor o igual a 4 mM.
6. Método según la reivindicación 1, en el que la cantidad acumulativa total por volumen unitario de glutamina de dicho medio es menor o igual a 10 mM.
7. Método según la reivindicación 1, en el que la cantidad acumulativa total por volumen unitario de glutamina de dicho medio es menor o igual a 4 mM.
8. Método según la reivindicación 1, en el que la glutamina sólo se proporciona en el medio inicial al comienzo del cultivo celular.
9. Método según la reivindicación 1, en el que la densidad inicial de dichas células de mamíferos es por lo menos 2 x 105 células/ml.
10. Método según la reivindicación 1, en el que la densidad inicial de dichas células de mamíferos es por lo menos 2 x 106 células/ml.
11. Método según la reivindicación 1, en el que la etapa de alimentación comprende alimentar por lo menos aproximadamente 1.000 l de un cultivo.
12. Método según la reivindicación 1, en el que la etapa de alimentación comprende alimentar por lo menos aproximadamente 10.000 l de un cultivo.
13. Método según la reivindicación 1, en el que dicho primer conjunto de condiciones comprende un primer intervalo de temperatura que es aproximadamente 30 a 42 grados Celsius.
14. Método según la reivindicación 1, en el que dicho primer conjunto de condiciones comprende un primer intervalo de temperatura que es aproximadamente 37 grados Celsius.
15. Método según la reivindicación 1, en el que dicho segundo conjunto de condiciones comprende un segundo intervalo de temperatura que es aproximadamente 25 a 41 grados Celsius.
16. Método según la reivindicación 1, en el que dicho segundo conjunto de condiciones comprende un segundo intervalo de temperatura que es aproximadamente 29 a 35 grados Celsius.
17. Método según la reivindicación 1, en el que dicho segundo conjunto de condiciones comprende un segundo intervalo de temperatura que es aproximadamente 31 grados Celsius.
18. Método según la reivindicación 1, que comprende además una segunda etapa de cambio subsiguiente a dicho primer cambio de por lo menos una de las condiciones de cultivo, que comprende cambiar por lo menos una de las condiciones de cultivo de forma que se aplique al cultivo un tercer conjunto de condiciones.
19. Método según la reivindicación 18, en el que la segunda etapa de cambio comprende cambiar por lo menos una condición de cultivo seleccionada de entre el grupo que consiste en: (i) temperatura, (ii) pH, (iii) osmolalidad, (iv) nivel de inductor químico, y sus combinaciones.
20. Método según la reivindicación 18, en el que dicho tercer conjunto de condiciones comprende un tercer intervalo de temperatura que es aproximadamente 27 a 37 grados Celsius.
21. Método según la reivindicación 1, en el que dicho primer período de tiempo está entre 1 y 7 días.
22. Método según la reivindicación 1, en el que dicho primer período de tiempo es aproximadamente 4 días.
23. Método según la reivindicación 1, en el que el total de dicho primer período de tiempo y dicho segundo período de tiempo es por lo menos 5 días.
24. Método según la reivindicación 1, en el que, en la etapa de mantener dicho cultivo durante un segundo período de tiempo, el nivel de lactato disminuye después hasta que el nivel de lactato en el cultivo alcanza un nivel máximo.
25. Método según la reivindicación 1, en el que, en la etapa de mantener dicho cultivo durante un segundo período de tiempo, el nivel de amonio disminuye después hasta que el nivel de amonio en el cultivo alcanza un nivel máximo.
26. Método según la reivindicación 1, en el que dicha cantidad total de dicha TNFR-Ig producida es por lo menos 1,5 veces mayor que la cantidad de TNFR-Ig producida en condiciones de otro modo idénticas en un medio de otro modo idéntico que carece de dicha característica del medio.
27. Método según la reivindicación 1, en el que dicha cantidad total de dicha TNFR-Ig producida es por lo menos 2 veces mayor que la cantidad de TNFR-Ig producida en condiciones de otro modo idénticas en un medio de otro modo idéntico que carece de dicha característica del medio.
28. Método según la reivindicación 1, en el que dicho cultivo celular se proporciona además con componentes suplementarios.
29. Método según la reivindicación 28, en el que dichos componentes suplementarios se proporcionan a múltiples intervalos.
30. Método según la reivindicación 28, en el que dichos componentes suplementarios se seleccionan de entre el grupo que consiste en hormonas y/u otros factores de crecimiento, iones particulares (tales como sodio, cloruro, calcio, magnesio, y fosfato), tampones, vitaminas, nucleósidos o nucleótidos, oligoelementos (compuestos inorgánicos presentes habitualmente a concentraciones finales muy bajas), aminoácidos, lípidos, o glucosa u otra fuente de energía.
31. Método según la reivindicación 1, en el que dicho cultivo no se suplementa con componentes adicionales durante la producción de dicha TNFR-Ig.
32. Método según la reivindicación 1, en el que la glutamina se sustituye por glicilglutamina en dicho cultivo.
33. Método según la reivindicación 1, en el que la cantidad total acumulativa de histidina, isoleucina, leucina, metionina, fenilalanina, triptófano, tirosina, y prolina, por volumen unitario en dicho medio es mayor que aproximadamente 25 mM.
34. Método según la reivindicación 1, en el que la cantidad total acumulativa de histidina, isoleucina, leucina, metionina, fenilalanina, triptófano, tirosina, y prolina, por volumen unitario en dicho medio es mayor que aproximadamente 35 mM.
35. Método según la reivindicación 1, en el que dicho medio tiene una característica del medio seleccionado de entre el grupo que consiste en:
36. Método según la reivindicación 1, en el que la cantidad total acumulativa de serina por volumen unitario en dicho medio es mayor que aproximadamente 10 mM.
37. Método según la reivindicación 1, en el que la cantidad total acumulativa de asparagina por volumen unitario en dicho medio es mayor que aproximadamente 8 mM.
38. Método según la reivindicación 1, en el que la cantidad total acumulativa de asparagina por volumen unitario en dicho medio es mayor que aproximadamente 12 mM.
39. Método según la reivindicación 1, en el que la cantidad total acumulativa de fósforo por volumen unitario en dicho medio es mayor que aproximadamente 5 mM.
40. Método según la reivindicación 1, en el que la cantidad total acumulativa de glutamato por volumen unitario en dicho medio es menor que aproximadamente 1 mM.
41. Método según la reivindicación 1, en el que la cantidad total acumulativa de pantotenato de calcio por volumen unitario en dicho medio es mayor que aproximadamente 20 mg/l.
42. Método según la reivindicación 1, en el que la cantidad total acumulativa de nicotinamida por volumen unitario en dicho medio es mayor que aproximadamente 25 mg/l.
43. Método según la reivindicación 1, en el que la cantidad total acumulativa de piridoxina y piridoxal por volumen unitario en dicho medio es mayor que aproximadamente 35 mg/l.
44. Método según la reivindicación 1, en el que la cantidad total acumulativa de riboflavina por volumen unitario en dicho medio es mayor que aproximadamente 2,0 mg/l.
45. Método según la reivindicación 1, en el que la cantidad total acumulativa de hidrocloruro de tiamina por volumen unitario en dicho medio es mayor que aproximadamente 35 mg/l.
46. Método según la reivindicación 1, en el que dicho medio comprende un medio que contiene glutamina y que tiene una característica del medio seleccionada de entre el grupo que consiste en:
47. Método para producir TNFR-Ig en un cultivo celular de producción a gran escala, que comprende las etapas siguientes:
48. Método según la reivindicación 47, en el que dicho medio tiene características del medio de:
49. Método según cualquiera de las reivindicaciones 1-2 ó 46-48, en el que:
50. Método según la reivindicación 1 ó 47, en el que la TNFR-Ig producida se aísla y/o se purifica para uso como o en la preparación de fármacos.
Patentes similares o relacionadas:
Método para preparar una disolución acuosa que contiene medio de cultivo y agente quelante, del 22 de Julio de 2020, de Kyowa Kirin Co., Ltd: Método para preparar una disolución acuosa que presenta una filtrabilidad de membrana mejorada que comprende un medio de cultivo, en el que el medio de […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Métodos para controlar la producción de proteasas, del 1 de Julio de 2020, de ROAL OY: Una célula hospedadora que comprende al menos un gen cromosómico inactivado en donde el gen cromosómico inactivado comprende una secuencia de ácido nucleico que codifica un […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Proceso para la purificación de daptomicina, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina que comprende: a) someter a la daptomicina a condiciones en las que una solución micelar de daptomicina se forma alterando el pH; y […]
Lipopéptidos de alta pureza, micelas de lipopéptidos y procesos para preparar los mismos, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina a partir de moléculas o agregados de alto peso molecular, en donde la daptomicina se proporciona en forma micelar, dicho […]
Métodos para ajustar los niveles de producción de carotenoides y composiciones en géneros de Rhodosporidium y Rhodotorula, del 15 de Abril de 2020, de TEMASEK LIFE SCIENCES LABORATORY LIMITED: Un método para ajustar el nivel de producción y la composición de carotenoides en un huésped fúngico que comprende: (a) manipular genéticamente […]