METODO PARA EL DIAGNOSTICO SEROLOGICO DE LA ENFERMEDAD DE PARKINSON.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200501201.
Solicitante: UNIVERSIDAD DE GRANADA
UNIVERSIDAD DE JAEN.
Nacionalidad solicitante: España.
Provincia: GRANADA.
Fecha de Solicitud: 6 de Mayo de 2005.
Fecha de Publicación: .
Fecha de Concesión: 18 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C12Q1/37 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › peptidasa o proteinasa.
- G01N33/52 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Utilización de compuestos o de composiciones para investigaciones colorimétricas, espectrofotométricas o fluorométricas, p. ej. utilización de cintas de papel indicador.
Clasificación PCT:
Fragmento de la descripción:
Método para el diagnóstico serológico de la enfermedad de Parkinson.
Sector de la técnica
Diagnóstico Clínico.
Estado de la técnica
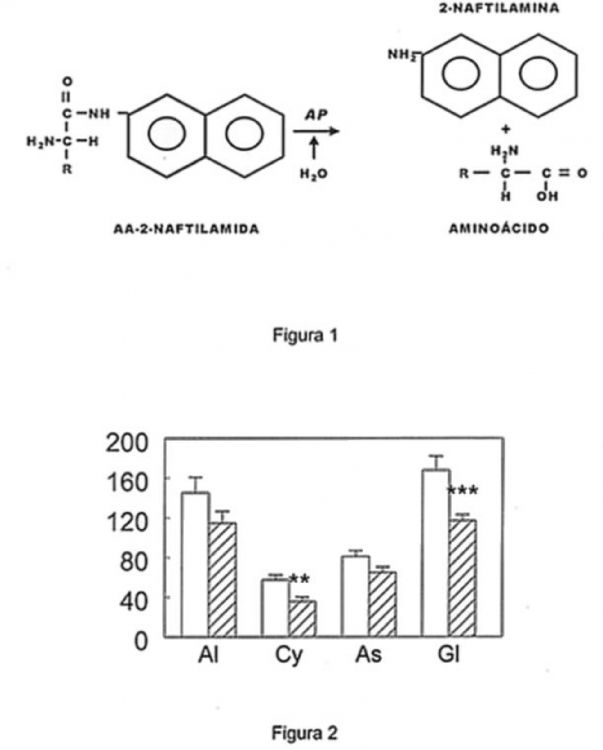
Los enzimas proteolíticos son aquellos que catalizan la hidrólisis de los enlaces peptídicos. El término es básicamente sinónimo a los de proteasas, proteinasas y peptidasas, si bien este último se aplica preferentemente a aquellos enzimas que utilizan péptidos (breves cadenas de aminoácidos) como sustratos. Estos enzimas se suelen dividir en dos grupos: exopeptidasas y endopeptidasas. Los primeros hidrolizan enlaces próximos (uno o dos residuos) a los extremos de la cadena polipeptídica, mientras que las endopeptidasas actúan preferentemente sobre enlaces alejados de los extremos de dicha cadena. Debido a la amplia especificidad de substrato de muchos de estos enzimas y a la aparición de proteinasas que forman parte de complejos multicatalíticos (proteasomas), se tiende a agrupar a estos enzimas de acuerdo con su actividad más que a definirlas por sus características estructurales, ya que un mismo enzima puede actuar sobre diferentes substratos (Figura 1).
Las exopeptidasas que requieren un grupo alfa-amino libre de los péptidos se denominan aminopeptidasas (AP) si liberan aminoácidos individuales, dipeptidil aminopeptidasas, si liberan dipéptidos, y tripeptidil aminopeptidasas si liberan cadenas de tipéptidos. Además, las exopeptidasas que requieren un grupo carboxílico terminal no sustituido de los péptidos se denominan carboxipeptidasas, si liberan aminoácidos libres y dipeptidil carboxipeptidasas si liberan dipéptidos intactos.
Los nombres dados a la mayoría de las AP se basan frecuentemente en sus preferencias o requerimientos por un particular aminoácido N-terminal. Por ejemplo, un enzima que muestre su más alta tasa de hidrólisis sobre enlaces donde la alanina sea el aminoácido N-terminal se denominaría alanil aminopeptidasa (o alanina aminopeptidasa). Similarmente, los nombres aplicados a las carboxipeptidasas que liberan aminoácidos se utilizan para identificar sus requerimientos o preferencias por un residuo C-terminal.
Nuestro equipo de investigación ha observado que los niveles séricos de ciertas aminopeptidasas se alteran de manera significativa en pacientes con enfermedad de Parkinson. Estos enzimas tienen funciones reguladoras sobre diversos péptidos circulantes y además pueden ser útiles para el diagnóstico de enfermedades del sistema nervioso central. A continuación se describen algunas de ellos.
Alanina aminopeptidasa (AlaAP) (EC 3.4.11.14) (aminopeptidasa M). Cataliza la liberación de aminoácidos N-terminales de dipéptidos, tripéptidos, oligopéptidos y diferentes aminoacil-2-naftilamidas (arilamidas), con preferencia por derivados de la alanina, metionina, fenilalanina y en menor medida, otros aminoácidos. Se encuentra en gran cantidad de tejidos y fluidos corporales y su pH óptimo es de 7.4. Varios isoenzimas órgano-específicos se localizan en suero. La mayoría de la actividad circulante se cree que procede del hígado, mientras que la actividad encontrada en orina, parece que tiene su origen en el riñón. Sus niveles séricos están elevados en ciertas patologías, como adenocarcinoma de colon y páncreas, síndrome nefrótico y también en el embarazo. Su actividad aumenta también significativamente en enfermedades hepato-biliares. Además la AlaAP puede hidrolizar bradicinina, encefalinas y también ha sido descrita como actividad angiotensinasa. La AlaAP está elevada durante la infancia y disminuye después de la pubertad. Sus valores son mayores en hombres que en mujeres y se ha descrito que su actividad se incrementa con el consumo de alcohol, drogas y tabaco.
Cistina aminopepidasa (CysAP) (EC 3.4.11.3) hidroliza los enlaces peptídicos entre una cistina N-terminal y el residuo adyacente. En el caso de la oxitocina, su presunto sustrato fisiológico, el residuo adyacente es la tirosina. Por la acción de éste enzima se destruye la actividad biológica de esta hormona neurohipofisaria. Exhibe una amplia especificidad sobre diferentes aminoacil-2-naftilamidas. Es insensible a la bestatina y a aminoácidos hidrofóbicos, a diferencia de otras AP séricas. Se ha localizado exclusivamente en el plasma de mujeres embarazadas y en la placenta humana y de otros primates. Sin embargo, el suero fetal y el fluido amniótico están libres de esta actividad enzimática. Sólo se han encontrado trazas en sangre de mujeres no embarazadas y ninguna en sangre de hombres. La placenta es una fuente rica en enzimas, pero la cistinil aminopeptidasa es una de las pocas relativamente específicas de este tejido. Se cree que estos niveles elevados de CysAP son los responsables de prevenir un comienzo prematuro de las contracciones uterinas mediante la destrucción de la oxitocina. En los embarazos anormales, el aumento de la actividad de CysAP es a menudo inadecuado y errático. Cada vez se piensa más que la medida de actividad de CysAP sérica en mujeres embarazadas durante el curso de su embarazo puede servir como indicador de la función feto-placentaria y su desarrollo, y que esta medida podría reemplazar otros métodos laboriosos que requieren la determinación de estrógenos totales urinarios o de pregnandiol. En este sentido, la aspartato aminopeptidasa, que también posee actividad angiotensinasa, muestra un descenso significativo en casos de pre-eclampsia. También se ha descrito que la CysAP aumenta en sueros de mujeres con adenocarcinoma ovárico, pero esto no está del todo demostrado. Hay que indicar además, que se ha descrito la actuación de la CysAP sobre la vasopresina neurohipofisaria, aunque también podríamos sugerir su actuación sobre otros péptidos cuyo residuo N-terminal es la cistina, como es el caso de las endotelinas.
Glutamato aminopeptidasa (GluAP) (EC 3.4.11.7) (aminopeptidasa A) (angiotensinasa A). Cataliza específicamente la hidrólisis de residuos no sustituidos de Glutamil- y Aspartil-2-naftilamidas y de péptidos. Se inhibe por agentes quelantes como EDTA y EGTA así como por amastatina. También la inhiben Zn2+, Ni2+, Cu2+ y Hg2+. Es activada por Mn2+ y Ca2+ y ligeramente por Mg2+ y su pH óptimo es de 7.5. Se encuentra en suero y diferentes órganos de animales y es probablemente la aminopeptidasa responsable de la rápida destrucción de la angiotensina II. El incremento de la angiotensinasa observado durante el embarazo puede atribuirse probablemente al aumento de la síntesis de este enzima por la placenta. La aminopeptidasa A parece estar fundamentalmente unida a membrana y muy distribuida en tejidos corporales pero es especialmente abundante a nivel renal. La única aminopeptidasa que ha sido descrita como específica para aminoácidos dicarboxílicos es la GluAP y no hidroliza derivados de arilamidas que contengan aminoácidos diferentes al glutámico o al aspártico, siendo esta actividad extensible a las angiotensinas naturales.
Aspartato aminopeptidasa (AspAP) (EC 3.4.11.-) (angiotensinasa). Cataliza la hidrólisis del aminoácido N-terminal de péptidos y arilamidas, siempre que éste sea un aminoácido dicarboxílico. Los restos aspartilos son hidrolizados más rápidamente que los restos glutamilos y no afecta a otros aminoácidos. Tiene un pH óptimo de actuación, de 7.5 y es activada por Mn2+, pero, a diferencia de la GluAP, no se afecta por Ca2+, ni es inhibida por EDTA. Al igual que la GluAP, la AspAP parece ser un enzima fundamentalmente unido a membrana y muy abundante a nivel renal. Su rápida acción sobre los residuos de ácido aspartilos N-terminales de los péptidos sugiere, al igual que la GluAP, una posible función fisiológica en la degradación de la angiotensina II y su conversión en angiotensina III. Pero además, la AspAP tiene el potencial de actuar sobre residuos de Asp amino-terminales de péptidos diferentes a la Ang II, como podrían ser el octapéptido colecistocinina (26-33) o el tetrapéptido colecistocinina (26-29). Por último, como señalábamos anteriormente, la aspartato aminopeptidasa muestra un descenso significativo en casos de pre-eclampsia.
Los enzimas proteolíticos gozan de un interés muy extendido entre la comunidad científica debido a que pueden ser utilizados como herramientas muy valiosas desde diversos puntos de vista. Para los químicos y clínicos, las proteasas son herramientas o sondas para estudiar la estructura de las proteínas, o para relacionarlas con procesos patológicos. Para los bioquímicos o fisiólogos, su interés se dirige hacia el estudio de las propiedades intrínsecas de éstos enzimas y para el...
Reivindicaciones:
1. Método de diagnóstico de enfermedades neurodegenerativas que utiliza la determinación de la actividad de aminopeptidasas séricas para el diagnóstico caracterizado por utilizar aminoacil-2-naftilamidas como reactivos de diagnóstico.
2. Método de diagnóstico de enfermedades neurodegenerativas caracterizado por utilizar aminoacil-2-naftilamidas como reactivos de diagnóstico mediante la detección de la fluorescencia de la 2-naftilamina liberada por la acción hidrolítica de aminopeptidasas.
3. Método de diagnóstico de enfermedades neurodegenerativas según reivindicaciones anteriores, caracterizado porque una disolución en dimetilsulfóxido del sustrato empleado, debidamente suplementada, se mezcla con la cantidad apropiada de suero o plasma a analizar, incubando a una temperatura de entre 20º y 40ºC un tiempo adecuado, tras el cual se detiene la reacción por adición de buffer acetato.
4. Kit de diagnóstico serológico de la enfermedad de Parkinson que comprende los siguientes componentes:
- a. Aminoacil-2-naftilamidas
- b. Albúmina bovina
- c. Ditiotreitol (DTT)
- d. Cloruro cálcico (Ca Cl2)
- e. Cloruro de manganeso (Mn Cl2)
- f. Tampón Fosfato 50 mM (pH 7.4)
- g. Tampón Tris HCl 50 mM (pH 6)
- h. Tampón Tris HCl 50 mM (pH 7.4)
- i. Tampón acetato 0.1 M (pH 4.2).
Patentes similares o relacionadas:
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Método para producir un nuevo Factor C recombinante, método para mitigar la inhibición de la reacción en ensayos de endotoxina, y método para medir endotoxina, del 5 de Febrero de 2020, de SEIKAGAKU CORPORATION: Un método para mitigar una inhibición de reacción en ensayo de endotoxina en presencia de un ion salino, comprendiendo el método: mezclar […]
Deshidrogenasa y toxina de Clostridium difficile como un biomarcador, del 18 de Diciembre de 2019, de TECHLAB, INC.: Un método para medir una cantidad de C. difficile en una muestra fecal, el método que comprende: medir cuantitativamente un nivel de lactoferrina, […]
Procedimientos de medición de la actividad del factor D y la potencia de los inhibidores del factor D, del 11 de Diciembre de 2019, de F. HOFFMANN-LA ROCHE AG: Un procedimiento de medición de la actividad del factor D en una muestra, que comprende realizar un ensayo de medición basado en proximidad, en el que el […]
Inducción apoptótica selectiva en células cancerosas incluyendo la activación de procaspasa-3, del 2 de Octubre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: Un compuesto de fórmula ZZ:**Fórmula** en donde n= 1 o 2; R, independientemente de otra R, es hidrógeno, halógeno, alilo o grupo alquilo que tiene de 1 […]
Ensayos de actividad de endopeptidasa redirigida basados en inmunología, del 2 de Octubre de 2019, de ALLERGAN, INC.: Método para detectar actividad endopeptidasa redirigida, comprendiendo el método las etapas de: a) tratar una célula de una línea celular establecida […]
Ensayos de actividad de serotipo A de toxina botulínica de base inmunológica, del 24 de Julio de 2019, de ALLERGAN, INC.: Método de detección de actividad de NTBo/A en un mamífero, que comprende las etapas de: a. tratar una célula de una línea celular establecida que expresa SNAP-25 con una muestra […]
Hemocultivo del mismo día con microscopia digital, del 3 de Julio de 2019, de Accelerate Diagnostics, Inc: Un método, que comprende las etapas de: a) introducir un medio de cultivo, un agente lítico y una enzima de escisión de desechos celulares en una muestra de sangre, […]