PROCEDIMIENTO PARA LA RESOLUCION DE HOMOCITEINA-TIOLACTONA.
Un procedimiento para preparar homocisteína-?-tiolactona enantioméricamente pura,
que comprende la resolución óptica de la homocisteína-?-tiolactona (HCT) racémica
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07004341.
Solicitante: EDMOND PHARMA S.R.L..
Nacionalidad solicitante: Italia.
Dirección: VIA G. B. GRASSI 15,20157 MILANO.
Inventor/es: NICOLA, MASSIMO, GATTI, PIER ANDREA, ZACCHE,MATTEO.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Marzo de 2007.
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D333/36 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 333/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de azufre como único heteroátomo del ciclo. › Atomos de nitrógeno.
Clasificación PCT:
- C07D333/36 C07D 333/00 […] › Atomos de nitrógeno.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Procedimiento para la resolución de homociteína-tiolactona.
Campo de la invención
La presente invención se refiere a la preparación de 1,4-tiolactona del ácido 2-amino-4-mercaptobutírico enantioméricamente pura.
Descripción
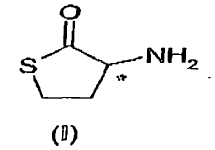
La 1,4-tiolactona del ácido 2-amino-4-mercaptobutírico, habitualmente denominada homocisteína-?-tiolactona (en lo sucesivo indicada como HCT) I:
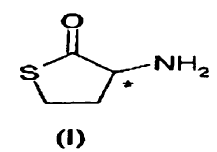
contiene un átomo de carbono quiral, indicado con un *, y por lo tanto existe en forma de dos enantiómeros diferentes, el enantiómero R y el S. El racemato está disponible en el comercio y normalmente se vende en forma de su sal de hidrocloruro.
Un primer procedimiento conocido para preparar HCT enantioméricamente pura comprende la desmetilación de la metionina enantioméricamente pura, para obtener la homocisteína enantioméricamente pura y después cerrar el anillo de lactona, obteniéndose así la HCT enantioméricamente pura. Este procedimiento es costoso y difícil de realizar en una escala industrial.
Otro procedimiento para preparar HCT enantioméricamente pura se describe en los documentos JP 2001-199980 y JP 2000-351776, en los que se hace reaccionar la HCT racémica con un ácido enantioméricamente puro para formar 2 amidas diastereoisómeras; después los diastereoisómeros se separan y la amida se hidroliza para obtener el enantiómero deseado de la HCT. Este procedimiento también presenta muchos inconvenientes porque la separación se realiza en 3 etapas y la escisión de una amida es una reacción difícil. Además, usa reactivos costosos y los rendimientos son bajos.
Por lo tanto, es necesario un procedimiento mejor de resolución de enantiómeros de la HCT.
Descripción de la invención
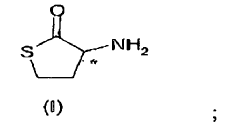
Ahora se ha encontrado que la homocisteína-?-tiolactona se puede preparar por resolución óptica de la homocisteína-?-tiolactona racémica
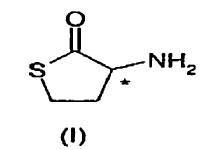
con un ácido orgánico quiral, en el que un isómero se recupera como una sal diastereoisómera con el ácido orgánico y el otro isómero que queda en las aguas madre se somete a racemización con una cantidad catalítica de un aldehido aromático y se somete de nuevo a resolución óptica con el mismo ácido orgánico quiral.
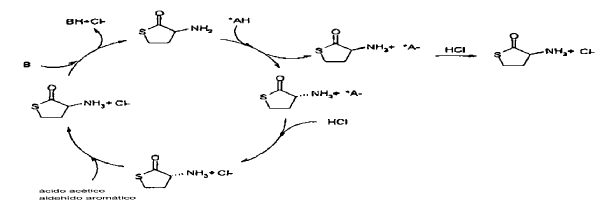
De forma más detallada, la invención comprende 2 realizaciones principales: una primera (denominada procedimiento 1 en los ejemplos), en la que la sal diastereoisómera que queda en las aguas madre primero se aísla y después se racemiza con una cantidad catalítica de un aldehído aromático para proporcionar así homocisteína-?-tiolactona racémica que se somete de nuevo a resolución óptica, y una segunda, más ventajosa (denominada el procedimiento 2 en los ejemplos), en la que la resolución óptica se lleva a cabo en presencia de una cantidad catalítica de un aldehído aromático, de modo que una de las dos sales diastereoisómeras precipita y la otra que queda en las aguas madre racemiza. En lo sucesivo, la expresión "aguas madre" indica la disolución de la que precipita el diastereoisómero menos soluble.
De forma más detallada, la primera realización comprende las siguientes etapas:

El disolvente usado para la precipitación de la disolución de HCT racémica de la etapa a), es un disolvente o una mezcla de disolventes seleccionados de agua, alcoholes, tales como metanol, etanol, propanol, isopropanol y otros disolventes orgánicos adecuados, por ejemplo acetona o tetrahidrofurano. Los ácidos orgánicos quirales enantioméricamente puros adecuados para llevar a cabo la etapa b) son, por ejemplo, ácido dibenzoiltartárico, ácido ditoluoiltartárico, ácido mandélico, ácido tartárico, ácido canforsulfónico, ácido ascórbico, ácido málico, ácido piroglutámico, ácido aspártico, ácido quínico, siendo el más preferido el ácido ditoluoiltartárico y el ácido mandélico. Cuando es necesario calentar la disolución, con el fin de hacer precipitar la sal diastereoisómera menos soluble, la temperatura varía de acuerdo con el disolvente y se puede subir a la temperatura de reflujo. La HCT enantioméricamente pura recuperada de la etapa d) se convierte preferiblemente en la sal de hidrocloruro por disolución en acetona y adición de cloruro de hidrógeno, hasta precipitación completa del hidrocloruro de HCT.
La disolución de partida de HCT se puede preparar disolviendo el hidrocloruro de HCT racémico disponible en el comercio, en uno o más de los disolventes mencionados antes, y añadiendo una base orgánica o inorgánica, tal como trietilamina o hidróxidos de metales alcalinos. También se usa la misma base para la etapa h).
Como se ha indicado antes, los agentes de resolución preferidos son el ácido ditoluoiltartárico y el ácido mandélico, puesto que permiten obtener rendimientos en el intervalo de 70 a 80 por ciento basado en la cantidad teórica del enantiómero deseado.
Cuando se usa el ácido ditoluoiltartárico, el procedimiento se lleva a cabo disolviendo el hidrocloruro de HCT en metanol y añadiendo ácido ditoluoiltartárico a temperatura ambiente. A la disolución resultante se añade una cantidad estequiométrica de trietilamina, de modo que el hidrocloruro de trietilamina y la sal diastereoisómera más soluble permanecen en la disolución, mientras que la sal diastereoisómera menos soluble precipita. El precipitado se recoge por filtración y se purifica más por tratamiento en acetona a temperatura ambiente. Después de filtración, el dibenzoiltartrato de HCT se suspende otra vez en acetona y se añade ácido clorhídrico hasta completar la precipitación del hidrocloruro de HCT enantioméricamente puro.
Cuando se usa en cambio ácido mandélico como agente de resolución, el hidrocloruro de HCT se suspende en acetona y se añade una cantidad estequiométrica de trietilamina. El hidrocloruro de trietilamina se separa por filtración y se añade ácido mandélico al filtrado (que contiene HCT en forma de base libre), hasta precipitación completa de la sal diastereoisómera menos soluble. El precipitado se recoge por filtración, y después se suspende de nuevo en acetona y se acidifica con ácido clorhídrico hasta precipitación del hidrocloruro de HCT enantioméricamente puro.
El aldehído aromático usado en la etapa f) se selecciona de salicilaldehído, m-hidroxi-benzaldehído, p-hidroxi-benzaldehído, o- anisaldehído, m-anisaldehído, p-anisaldehído, siendo preferido el salicilaldehído; se requiere calentamiento con el fin de realizar la racemización. Después de 1-12 horas, dependiendo de la temperatura, la disolución se enfría hasta precipitación completa del hidrocloruro de HCT racémico, el cual se recoge por filtración y se lava con acetona, y después se somete de nuevo al procedimiento de resolución.
Esta primera realización se puede representar como en el siguiente esquema 1:
Esquema 1
Reivindicaciones:
1. Un procedimiento para preparar homocisteína-?-tiolactona enantioméricamente pura, que comprende la resolución óptica de la homocisteína-?-tiolactona (HCT) racémica
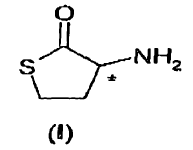
con un ácido orgánico quiral, en el que un isómero se recupera como una sal diastereoisómera con el ácido orgánico y el otro isómero que queda en las aguas madre se somete a racemización con una cantidad catalítica de un aldehído aromático seleccionado de salicilaldehído, m- hidroxi-benzaldehído, p-hidroxi-benzaldehído, o-anisaldehído, m- anisaldehído, p-anisaldehído, y se somete de nuevo a resolución óptica con el mismo ácido orgánico quiral.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que la sal diastereoisómera que queda en las aguas madre primero se aísla y después se racemiza con una cantidad catalítica del aldehído aromático, para así proporcionar homocisteína-?-tiolactona racémica, que se somete de nuevo a resolución óptica.
3. Un procedimiento de acuerdo con la reivindicación 2, que comprende las siguientes etapas:
4. Un procedimiento de acuerdo con la reivindicación 1, en el que la resolución óptica se lleva a cabo en presencia de una cantidad catalítica de un aldehído aromático, de modo que una de las dos sales diastereoisómeras precipita y la otra que queda en disolución racemiza.
5. Un procedimiento de acuerdo con la reivindicación 4, que comprende las siguientes etapas:
6. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que el ácido orgánico enantioméricamente puro se selecciona de dibenzoiltartárico, ácido ditoluoiltartárico, ácido mandélico, ácido tartárico, ácido canforsulfónico, ácido ascórbico, ácido málico, ácido piroglutámico, ácido aspártico, ácido quínico, siendo el más preferido el ácido ditoluoiltartárico y el ácido mandélico.
7. Un procedimiento de acuerdo con la reivindicación 6, en el que el ácido orgánico enantioméricamente puro es el ácido ditoluoiltartárico o el ácido mandélico.
8. Un procedimiento de acuerdo con la reivindicación 7, en el que el aldehído aromático es salicilaldehído.
Patentes similares o relacionadas:
Moduladores de ROR-gamma, del 18 de Marzo de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde - A1 es NR1 o CR1, siendo […]
Moduladores de ROR gamma (RORgamma), del 18 de Marzo de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: A1 es NR1 o CR1, siendo R1 H o metilo, estando el metilo, […]
Moléculas que tienen utilidad plaguicida e intermediarios, composición y procesos, relacionados con ellas, del 22 de Mayo de 2019, de DOW AGROSCIENCES LLC: Una molécula que tiene la siguiente fórmula**Fórmula** en donde: (A) R1 se selecciona del grupo que consiste en H, F, Cl, Br, I, CN, NH2, NO2, alquilo(C1-C4), […]
Compuesto heterocíclico sustituido con halógeno, del 3 de Agosto de 2016, de UBE INDUSTRIES, LTD.: Un compuesto representado por la fórmula general (I): [Fórmula química 320]**Fórmula** en donde A representa, un anillo de fenilo, un […]
Antagonistas de CCR2 de sales cuaternarias, del 9 de Marzo de 2016, de JANSSEN PHARMACEUTICA NV: Un compuesto de Fórmula (I)**Fórmula** y formas farmacéuticamente aceptables de la misma en el que A es carbonilo, tiocarbonilo o sulfonilo; […]
Derivado de benceno o tiofeno y su uso como inhibidor de la enzima VAP-1, del 24 de Noviembre de 2015, de R-TECH UENO, LTD.: Un compuesto, el cual es 2-(4-{2-[5-(4-acetilpiperazin-1-il)piridin-2-il]etil}fenil)acetohidrazida, o una de sus sales farmacéuticamente aceptables.
Derivado de 1-heterodieno y agente de represión de organismos dañinos, del 29 de Octubre de 2014, de NIPPON SODA CO., LTD.: Un derivado de 1-heterodieno representado por la fórmula o su sal: en la fórmula , Q1 representa un grupo arilo C6-10 opcionalmente […]
Compuestos de guanidina y su uso como componentes de unión para receptores 5-HT5, del 6 de Agosto de 2014, de AbbVie Deutschland GmbH & Co KG: Compuesto de guanidina de fórmula general I formas enantioméricas, diastereoméricas y/o tautoméricas correspondientes del mismo así como sales farmacéuticamente […]