FORMULACION Y PROCEDIMIENTOS DE TRATAMIENTO DE TROMBOCITEMIA.
Uso de un agente de anagrelida en la forma seleccionada de anagrelida,
anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida, en la preparación de un medicamento para el tratamiento o prevención de trombocitemia en un sujeto, en el que el modo de administración es por implantes, sublingual, absorción pregástrica, pesario, supositorio, administración por vía transdérmica, aerosol nasal, absorción inhalada o administración por vía tópica
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2004/000096.
Solicitante: SHIRE BIOPHARMACEUTICALS HOLDINGS IRELAND LIMITED.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 22 GRENVILLE STREET,ST HELIER JE4 8PX.
Inventor/es: FRANKLIN,RICHARD.
Fecha de Publicación: .
Fecha Concesión Europea: 7 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/517 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
Clasificación PCT:
- A61K31/517 A61K 31/00 […] › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
Clasificación antigua:
- A61K31/517 A61K 31/00 […] › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
Fragmento de la descripción:
Formulación y procedimientos de tratamiento de trombocitemia.
Campo de la invención
La presente invención se refiere a procedimientos para el tratamiento de trombocitemia. La presente invención también se refiere a formulaciones que son útiles para la reducción de recuentos de plaquetas.
Antecedentes de la invención
La trombocitemia es un trastorno crónico asociado con producción mayor o anormal de plaquetas en sangre. Debido a que las plaquetas están implicadas en la coagulación sanguínea su producción anormal puede dar lugar a la formación inapropiada de coágulos sanguíneos o a hemorragias, con la consecuencia de verse aumentado el riesgo para el paciente de hemorragia gastrointestinal, ataque cardiaco y apoplejía se vea aumentado.
La anagrelida, un inhibidor de la fosfodiesterasa derivado de quinazolina, se describió en primer lugar como un agente anti-agregante de plaquetas en sangre, agente antihipertensivo y agente bronquiodilatador en la patente de Estados unidos 3.932.407 expedida el 13 de Enero de 1976 y en la patente re-expedida nº Re 31.617 expedida el 26 de Junio de 1984.
La anagrelida se usa en la actualidad para el tratamiento de trombocitemia esencial y diversos trastornos mieloproliferativos. La anagrelida fue aprobada y admitida en 1997 para el tratamiento de trombocitemia esencial en los Estados Unidos y Canadá. En Diciembre de 1998 la FDA (Administración para Fármacos y Alimentos) de los Estados Unidos aprobó una etiqueta expandida para anagrelida; de forma específica para el tratamiento de pacientes con trombocitemia secundaria a trastornos mieloproliferativos, incluyendo policitema vera (PV) y leucemia mielógena crónica (CML).
Los documentos WO 93/09794, US 5306709 y E.C. Storen y col., Blood, vol. 97, nº 4, páginas 863-866, 2001 divulgan el uso de anagrelida para tratamiento por vía oral o parenteral de trombocitemia.
La anagrelida se encuentra disponible como cápsula 0,5 mg y 1,0 mg para administración por vía oral. El evento adverso más común observado con anagrelida se refiere al efecto vasodilatador e inotrópico positivo. Estos incluyen dolor de cabeza, diarrea, palpitaciones y taquicardia.
Sería deseable por tanto tener otras formulaciones que se podrían usar para el tratamiento o prevención de trombocitemia.
Sumario de la invención
Como se establece en la patente de Estados Unidos 3.932.407 expedida el 13 de Enero de 1976 y en la patente renovada nº Re. 31.617 de 26 de Junio de 1984 se puede preparar derivado de quinazolina incluyendo anagrelida en una forma sólida para uso por vía oral y/o parenteral como agentes anti-agregantes de plaquetas en sangre y/o agentes anti-hipertensivos y/o agentes bronquiodilatadores. Sin embargo la patente no sugiere que fuese deseable evitar el primer metabolismo de paso a través del hígado con el fin de reducir alguno de los efectos secundario de la anagrelida cunado se administra por vía oral. La patente tampoco sugiere que fuese posible o deseable preparar una formulación transdérmica o usar la formulación para el tratamiento o prevención de trombocitemia.
Sin pretender queda ligado a teoría alguna (no es necesario un entendimiento del mecanismo para poner en práctica la presente invención, y la presente invención no se ve limitada por mecanismo particular alguno). Los solicitantes creen que ciertos efectos secundarios cardiovasculares o inotrópicos relacionados están asociados con un metabolito como una consecuencia del primer paso por el hígado. De acuerdo con esta invención los inventores han encontrado que, de forma sorprendente, algunos de estos efectos secundarios se pueden reducir evitando el metabolismo de primer paso del hígado.
Los solicitantes han descubierto que la formulación transdérmica y de implante de esta invención proporcionan efectos beneficiosos sorprendentes.
Los solicitantes han determinado que la anagrelida se puede administrar de forma efectiva por vía transdérmica.
En una realización las formulaciones de esta invención proporcionan dosificación consistente del principio activo.
En una realización las formulaciones de esta invención alcanzan concentración en plasma sostenida del agente farmacéuticamente activo.
En una realización las formulaciones de esta invención favorecen la aceptación por el paciente.
En un aspecto, la presente invención proporciona el uso de una formulación que comprende como un ingrediente activo una cantidad efectiva de anagrelida en la preparación de un medicamento para el tratamiento o prevención de tromocitemia en un huésped, en el que el modo de administración es por implantes, sublingual, absorción pregástrica, pesario, supositorio, administración por vía transdérmica, aerosol nasal, absorción inhalada o administración por vía tópica. En otro aspecto, la invención se refiere a la preparación de un medicamento como se describe anteriormente para la reducción de recuento de plaquetas en un paciente. En un aspecto adicional la invención se refiere a la preparación de un medicamento como se describe anteriormente para la reducción de los efectos secundarios asociados con anagrelida.
En otro aspecto se proporciona el uso de una formulación de acuerdo con esta invención como un agente de reducción de plaquetas.
En otro aspecto más se proporciona una formulación farmacéutica de acuerdo con esta invención y al menos un agente terapéutico adicional.
Descripción de las figuras
La figura 1 representa los perfiles de concentración en plasma-tiempo de anagrelida y metabolito A tras aplicación de 1 mg por vía oral y tras aplicación por vía dérmica de una solución saturada durante 24 horas.
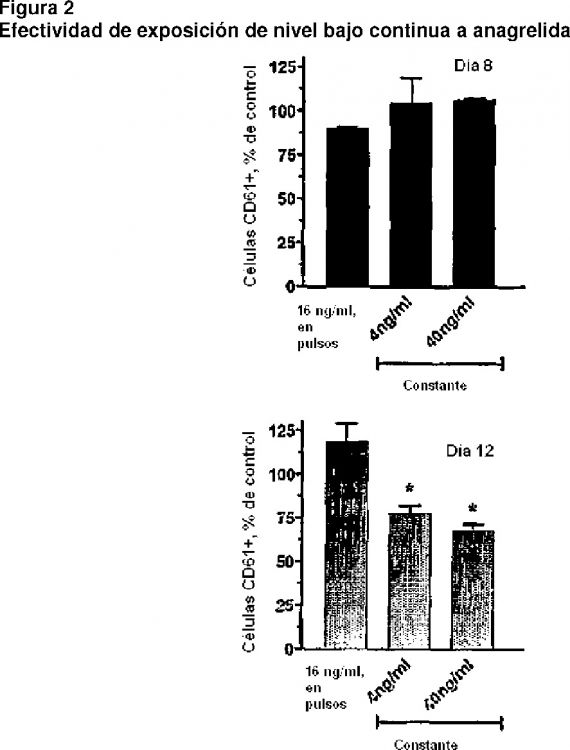
La figura 2 representa la efectividad de exposición a anagrelida con baja cantidad continua.
Descripción detallada de la invención
En una realización la formulación de la presente invención comprende aquellas en las que están presentes las siguientes realizaciones, bien independientemente o bien en combinación.
La anagrelida se ha administrado a sujetos humanos como una formulación en cápsula. Tal formulación en comprimido de anagrelida se puede asociar con efectos no deseados cuando se administra a un grupo de sujetos. De forma sorprendente las formulaciones transdérmicas o para implante reivindicadas en el presente documento minimizan o eliminan tales efectos cuando mientras se mantiene una concentración en plasma consistente, deseable del agente farmacológicamente activo.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se administra por vía transdérmica.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se encuentra en la forma de formulación de depósito.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida, se encuentra en la forma de una formulación de capa única que comprende anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida y al menos un adhesivo.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se encuentra en la forma de una formulación en capa múltiple en la que al menos una capa de dicha formulación en capa múltiple comprende anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida y al menos un adhesivo.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se encuentra en la forma de una formulación matricial.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se administra por vía subdérmica.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se administra en la forma de una formulación de implante por matriz.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se administra en una cantidad de 0,01 a 20 mg/kg/día.
En una realización la anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida se administra en una dosis diaria de 0,5 a 10 mg.
En una realización la anagrelida, anagrelida...
Reivindicaciones:
1. Uso de un agente de anagrelida en la forma seleccionada de anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida, en la preparación de un medicamento para el tratamiento o prevención de trombocitemia en un sujeto, en el que el modo de administración es por implantes, sublingual, absorción pregástrica, pesario, supositorio, administración por vía transdérmica, aerosol nasal, absorción inhalada o administración por vía tópica.
2. Uso de acuerdo con la reivindicación 1, en el que el agente de anagrelida se administra por contacto de una zona de la piel con el agente anagrelida formulado con un potenciador de la permeación en la piel.
3. Uso de acuerdo con la reivindicación 1, en el que el modo de administración es por vía transdérmica.
4. Uso de acuerdo con la reivindicación 1, en el que el modo de administración es por vía subdérmica.
5. Uso de acuerdo con la reivindicación 3, en el que el agente anagrelida está en la forma de formulación de depósito; o en la forma de una formulación de capa única que comprende el agente anagrelida y al menos un adhesivo; o en la forma de una formulación de capa múltiple en la que al menos una capa de la formulación de capa múltiple comprende el agente anagrelida y al menos un adhesivo; o en la forma de una formulación de matriz.
6. Uso de acuerdo con la reivindicación 1, en el que la trombocitemia se asocia con trombocitemia esencial (ET), leucemia mielógena crónica (CML), policitemia vera (PV), metaplasia mieloide agnogénica (AMM) o anemia de células falciformes (SCA).
7. Uso de acuerdo con la reivindicación 1, en el que el agente de anagrelida se administra en una cantidad de 0,01 a 20 mg/kg/día.
8. Uso de acuerdo con la reivindicación 3, en el que el agente de anagrelida se administra en la forma de una formulación de implante matricial.
9. Uso de acuerdo con la reivindicación 4, en el que el agente de anagrelida se administra en la forma de una formulación de implante matricial.
10. Uso de acuerdo con la reivindicación 1, en el que el agente de anagrelida se administra por vía tópica a la epidermis en la forma de un ungüento, crema o loción.
11. Uso de acuerdo con la reivindicación 3, en el que el agente de anagrelida está en la forma de una composición que comprende además al menos un potenciador de la permeación en la piel.
12. Uso de acuerdo con la reivindicación 11, en el que al menos un potenciador de penetración es linalool, carvacrol, timol, citral, mentol o t-anetol.
13. Uso de acuerdo con la reivindicación 3, en el que la administración es mediante un parche transdérmico que presenta un sistema fármaco-en-adhesivo de capa única que comprende una composición que contiene el agente de anagrelida, cualquier excipiente opcional, y al menos un adhesivo de contacto con la piel, que se combina con una película soporte única;
o la administración es por un parche transdérmico que presenta un sistema fármaco-en-adhesivo de capa múltiple en el que:
la administración es mediante un parche transdérmico que presenta un sistema transdérmico depósito que comprende un compartimento de líquido que contiene una solución o suspensión del agente de anagrelida, un revestimiento de liberación, y entre el revestimiento de liberación y el compartimento de líquido, una membrana semi-permeable y al menos un adhesivo;
o la administración es mediante un parche transdérmico que presenta un sistema matricial que componente una matriz semisólida que contiene una solución o suspensión del agente de anagrelida que está en contacto directo con un revestimiento de liberación, y un componente para adhesión a la piel incorporado en un sobrecapa que forma una configuración concéntrica en torno a la matriz semisólida; o la administración es mediante un parche transdérmico que contiene el agente de anagrelida íntimamente distribuido en una matriz.
14. Uso de acuerdo con la reivindicación 3, en el que la administración es mediante un parche transdérmico que contiene de 1 mg a 100 mg del agente de anagrelida por parche.
15. Uso de acuerdo con la reivindicación 3, en el que el parche transdérmico contiene un adhesivo acrílico.
16. Uso de acuerdo con la reivindicación 15, en el que la composición contiene de 66 a 99,8% en peso de adhesivo de acrilato.
17. Uso de acuerdo con la reivindicación 3, en el que el parche transdérmico contiene una cantidad del agente de anagrelida, azona, etanol, agua, opcionalmente propilenglicol y agente gelificante.
18. Uso de acuerdo con la reivindicación 17, en el que la administración es mediante un parche transdérmico que contiene una cantidad del agente de anagrelida, de 0,1 a 10 partes en peso de azona, de 30 a 69,8 partes de etanol, de 29 a 50 partes en peso de agua, de 0 a 30 partes en peso de propilenglicol, y de 1 a 5 partes en peso de agente gelificante.
19. Uso de acuerdo con la reivindicación 3, en el que la administración es mediante un parche transdérmico que contiene el agente de anagrelida, etanol y agente gelificante.
20. Uso de acuerdo con la reivindicación 19, en el que la administración es mediante un parche transdérmico que contiene una cantidad del agente de anagrelida, de 85 a 97 partes en peso de etanol y de 2 a 14,9 partes en peso de agente gelificante.
21. Uso de acuerdo con la reivindicación 3, en el que la administración es mediante un parche transdérmico que presenta un área de 5 cm2 a 100 cm2.
22. Uso de un agente de anagrelida en la forma seleccionada de anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida, en la preparación de un medicamento para la reducción del recuento de plaquetas en un paciente en el que el modo de administración es por implantes, sublingual, absorción pregástrica, pesario, supositorio, administración por vía transdérmica, aerosol nasal, absorción inhalada o administración por vía tópica.
23. Uso de un agente de anagrelida en la forma seleccionada de anagrelida, anagrelida en forma de base, o una sal farmacéuticamente aceptable de anagrelida, en la preparación de un medicamento para la reducción de los efectos asociados con la administración por vía oral de anagrelida, en el que el modo de administración es por implantes, sublingual, absorción pregástrica, pesario, supositorio, administración por vía transdérmica, aerosol nasal, absorción inhalada o administración por vía tópica.
Patentes similares o relacionadas:
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Inhibidores de PDK1 heterocíclicos para uso para tratar cáncer, del 17 de Junio de 2020, de SUNESIS PHARMACEUTICALS, INC.: Un compuesto seleccionado del grupo que consiste en: **(Ver fórmula)** y sales farmacéuticamente aceptables del mismo, para uso en un método de tratamiento […]
Actividad antitumoral de inhibidores de multicinasas en cáncer colorrectal, del 10 de Junio de 2020, de ENTRECHEM, S.L: Composición para uso en la prevención y/o el tratamiento de cáncer colorrectal en un paciente, que comprende: a) un compuesto de fórmula (I) **(Ver fórmula)** […]
Aza-aril 1H-pirazol-1-il-bencenosulfonamidas como antagonistas de CCR(9), del 10 de Junio de 2020, de CHEMOCENTRYX, INC.: Un compuesto o sal del mismo de la fórmula (II): **(Ver fórmula)** donde R1 se selecciona del grupo que consiste en alquilo C2-8 sustituido o no sustituido, […]
4,6-diaminoquinazolinas como moduladores de cuna y métodos de uso de los mismos, del 13 de Mayo de 2020, de GILEAD SCIENCES, INC.: Un compuesto de Fórmula I: **(Ver fórmula)** en donde R1 es C1-9 alquilo, C3-15 cicloalquilo, heterociclilo, heteroarilo, o C6-10 arilo; en donde cada […]
Forma amorfa de un compuesto de pirimidinil-ciclopentano inhibidor de la AKT, composiciones y métodos de la misma, del 6 de Mayo de 2020, de GENENTECH, INC.: Monohidrocloruro de (S)-2-(4-clorofenil)-1-(4-((5R,7R)-7-hidroxi-5-metil-6,7-dihidro-5H-ciclopenta[d]pirimidin-4- il)piperazin-1-il)-3-(isopropilamino)propan-1-ona amorfo.
Combinaciones de moduladores duales de IRS/STAT3 y agentes anticancerígenos para el tratamiento del cáncer, del 29 de Abril de 2020, de TyrNovo Ltd: Una composición farmacéutica que comprende un inhibidor de EGFR y/o un anticuerpo EGFR en combinación con un compuesto representado por la estructura […]