PROCEDIMIENTO PARA LA PREPARACION DE DIAMINAS MONO-N-SULFONILADAS.
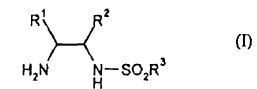
Procedimiento para la preparación de compuestos de fórmula (I),
** ver fórmula** en la que R 1 y R 2 representan fenilo y R 3 representa alquilo C1-C4, fluoroalquilo C1-C4, fenilo o naftilo, que puede estar sustituido adicionalmente con ninguno, uno, dos, tres, cuatro o cinco restos, que se seleccionan del grupo de alquilo C1-C4, alcoxi C1-C4, fluoroalquilo C1-C4, flúor y cloro, caracterizado porque se hacen reaccionar diaminas de fórmula (II)** ver fórmula** en la que R 1 y R 2 poseen el significado citado en la fórmula (I) - en presencia de agua y - en presencia de disolvente orgánico, en donde la relación en volumen de agua en disolvente orgánico es de 20:1 a 1:20, y - - en presencia de bases del grupo de hidróxidos o carbonatos alcalinos o alcalinotérreos - a una temperatura en el intervalo de -20ºC a 50ºC con halogenuros de sulfonilo de fórmula (III), R 3 SO2X (III) en la que X representa flúor, cloro, bromo o yodo y R 3 posee el significado citado en la fórmula (I), en donde la relación molar de compuestos (II) a los compuestos de fórmula (III) es de 0,8 a 1,3 equivalentes
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E03012670.
Solicitante: BAYER CHEMICALS AG.
Nacionalidad solicitante: Alemania.
Dirección: 51368 LEVERKUSEN.
Inventor/es: BOSCH,BORIS,ELMAR,DR, GERHARTZ,FRANK.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Junio de 2003.
Fecha Concesión Europea: 30 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- B01J31/18B
- B01J31/22D6
- C07C29/143 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 29/00 Preparación de compuestos que tienen grupos hidroxilo o grupos O-metal unidos a un átomo de carbono que no forma parte de un ciclo aromático de seis miembros. › de cetonas.
- C07C303/38 C07C […] › C07C 303/00 Preparación de ésteres o amidas de ácidos sulfúricos; Preparación de ácidos sulfónicos o sus ésteres, halogenuros, anhídridos o amidas. › por reacción de amoniaco o de aminas con ácidos sulfónicos o con sus ésteres, sus anhídridos o sus halogenuros.
- C07C311/18 C07C […] › C07C 311/00 Amidas de ácidos sulfónicos, es decir, compuestos en los que átomos de oxígeno, unidos por enlaces sencillos, de grupos sulfónicos han sido sustituidos por átomos de nitrógeno que no forman parte de grupos nitro o nitroso. › a un átomo de carbono acíclico de un radical hidrocarbonado sustituido por átomos de nitrógeno que no forman parte de grupos nitro o nitroso.
- C07C319/12 C07C […] › C07C 319/00 Preparación de tioles, de sulfuros, de hidropolisulfuros o de polisulfuros. › por reacciones que no implican la formación de grupos mercapto.
Clasificación PCT:
- B01J31/22 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01J PROCEDIMIENTOS QUÍMICOS O FÍSICOS, p. ej. CATÁLISIS O QUÍMICA DE LOS COLOIDES; APARATOS ADECUADOS. › B01J 31/00 Catalizadores que contienen hidruros, complejos de coordinación o compuestos orgánicos (composiciones catalíticas utilizadas únicamente para reacciones de polimerización C08). › Complejos orgánicos.
- C07C303/38 C07C 303/00 […] › por reacción de amoniaco o de aminas con ácidos sulfónicos o con sus ésteres, sus anhídridos o sus halogenuros.
Clasificación antigua:
- B01J31/22 B01J 31/00 […] › Complejos orgánicos.
- C07C303/38 C07C 303/00 […] › por reacción de amoniaco o de aminas con ácidos sulfónicos o con sus ésteres, sus anhídridos o sus halogenuros.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Procedimiento para la preparación de diaminas mono-N-sulfoniladas.
La presente invención se refiere a un procedimiento para la preparación de diaminas mono-N-sulfoniladas mediante reacción de diaminas con halogenuros de sulfonilo en presencia de agua, base y disolvente orgánico.
Las diaminas mono-N-sulfoniladas, de forma particular en forma ópticamente activa, han adquirido gran relevancia técnica, por ejemplo, como ligandos en la catálisis (véase, por ejemplo, Noyori y col. J. Amer. Chem. Soc. 1995, 117, 7562).
Básicamente se conoce la preparación de diaminas mono-N-sulfoniladas. Es así como R.A. Sheldon y col., Eur. J. Org. Chem. 1999, 2315 describen, por ejemplo, su preparación a partir de diaminas con halogenuros de sulfonilo en presencia de trietilamina.
BALSELLS, JAUME Y COL: J. ORG. CHEM., tomo 65, 2000, páginas 5005-5008, describe la preparación de monosulfonamidas de 1,2-diaminociclohexano, partiendo de una solución de diamintartrato en sosa cáustica acuosa mediante reacción de cloruro de sulfonilo.
BALSELLS, JAUME Y COL: TETRAHEDON-ASYMMETRY, tomo 9, 1998, páginas 4135 a 4142, describe una solución de una monosulfonamida de fórmula (I), que se usa para la preparación de una imina y finalmente para la preparación de un catalizador.
MEUZELAAR G Y COL: "Chemistry of Opium Alkaloids, 45. Improvements in the Total Synthesis of Morphine" EUROPEAN JOURNAL OF ORGANIC CHEMISTRY, EDITORIAL WILEY-VCH, WEINHEIM, DE, tomo 9, 1999, páginas 2315-2321, describe catalizadores de hidrogenación, que se obtienen mediante reacción de complejos de rutenio de fórmula (IV) con soluciones de monosulfonamidas de fórmula (I).
Sin embargo es desventajoso en este procedimiento que genere normalmente mezclas de productos no sulfonados, mono-N-sulfonados y di-N-sulfonados, que se deben someter a una separación cromatográfica costosa (véase también el documento EP-A 1174426). Las selectividades alcanzan en los procedimientos conocidos de 30 a 85% referido a la diamina mono-N-sustituida deseada, lo que no es satisfactorio para la aplicación industrial.
Existe por tanto la necesidad de proporcionar un procedimiento que haga posible la preparación de diaminas mono-N-sulfonadas de forma más eficiente con buenas selectividades.
Se ha encontrado ahora un procedimiento para la preparación de compuestos de fórmula (I),


en donde la relación molar de compuestos (II) a los compuestos de fórmula (III) es de 0,8 a 1,3 equivalentes.
Los compuestos de fórmula (I) y dado el caso los compuestos de fórmulas (II) y/o (III) son quirales. El marco de la invención comprende expresamente tanto los estereoisómeros puros (enantiómeros y diastereómeros) como también mezclas discrecionales de los mismos como, por ejemplo, racematos.
Se prefieren usar compuestos quirales de fórmula (II) que presenten una pureza óptica de 80% de ee o más, con especial preferencia de 90% de ee o más y con muy especial preferencia de 98,5% de ee o más.
A este respecto la pureza óptica se define como:
en donde
ee (S) es la pureza óptica del enantiómero S, m(S) la cantidad de sustancia del enantiómero S y m(R) la cantidad de sustancia del enantiómero R. Los datos se dan normalmente en porcentaje de "exceso enantiomérico" (% ee = ee/100).
De forma particular es adecuado el procedimiento de acuerdo con la invención para la preparación de los siguientes compuestos de fórmula (II):
N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-p-tolulsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-o-tolilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-m-tolilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-fenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-4-etilfenilsulfonamida, N-[(1R, 2R) y (1S,2S)-2-amino-1,2-difeniletil]-3-etilfenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2-etilfenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2,4,6-trimetilfenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2,4,6-triisopropilfenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-4-clorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-3-clorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2-clorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-4-fluorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-3-fluorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2-fluorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-4-metoxifenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-3-metoxifenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2-metoxifenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-1-naftilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-2-naftilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-pentafluorofenilsulfonamida, N-[(1R,2R) y (1S,2S)-2-amino-1,2-difeniletil]-metanosulfonamida o mezclas de los enantiómeros respectivos como particularmente los racematos.
El procedimiento de acuerdo con la invención se lleva a cabo en presencia de agua, base y disolvente orgánico. Son disolventes orgánicos adecuados, por ejemplo:
Reivindicaciones:
1. Procedimiento para la preparación de compuestos de fórmula (I),

en la que

en donde la relación molar de compuestos (II) a los compuestos de fórmula (III) es de 0,8 a 1,3 equivalentes.
2. Procedimiento según la reivindicación 1, caracterizado porque X representa flúor o cloro.
3. Procedimiento según las reivindicaciones 1 ó 2, caracterizado porque se usan compuestos quirales de fórmula (II) que presentan una pureza óptica de 80% de ee o más.
4. Procedimiento según una o varias de las reivindicaciones 1 a 3, caracterizado porque como disolventes orgánicos se usan:
5. Procedimiento según una o varias de las reivindicaciones 1 a 4, caracterizado porque como disolventes orgánicos se usan:
6. Procedimiento según una o varias de las reivindicaciones 1 a 5, caracterizado porque la mezcla de reacción forma dos fases líquidas y la fase acuosa presenta un valor de pH referido a 25ºC de 8 o más.
7. Procedimiento según una o varias de las reivindicaciones 1 a 6, caracterizado porque de la solución de reacción se aíslan los productos, por ejemplo, mediante conversión en el halogenhidrato, cristalización o precipitación del halogenhidrato y liberación del compuesto de fórmula (I) del halogenhidrato con base.
8. Procedimiento para la preparación de soluciones que contienen compuestos de fórmula (I)
en la que

9. Procedimiento para la preparación de catalizadores, que comprende las siguientes etapas:

10. Procedimiento según la reivindicación 9, caracterizado porque Z representa cloro.
11. Procedimiento para la preparación de catalizadores según la reivindicación 9, caracterizado porque se usan aquellos compuestos de fórmula (IV) en los que M representa rutenio y n es igual a dos.
12. Procedimiento de hidrogenación que comprende la preparación del catalizador según la reivindicación 9 y el uso del catalizador así preparado en la hidrogenación.
Patentes similares o relacionadas:
Procedimiento de preparación de compuestos de tipo oxatiazina, del 13 de Mayo de 2020, de Geistlich Pharma AG: Un procedimiento que comprende hacer reaccionar el ácido isetiónico o una sal del mismo con alcohol bencílico para producir un compuesto que tiene […]
Procedimiento no electroquímico de fluoración de compuestos halogenuros de sulfonilo, del 24 de Junio de 2019, de RHODIA OPERATIONS: Procedimiento no-electroquímico de preparación de un compuesto fluorado de fórmula (I) que comprende al menos una función -SO2F, caracterizado por que […]
Síntesis quiral de N-{3,4-difluoro-2-[(2-fluoro-4-yodofenil)amino]-6-metoxifenil}-1-[2,3-dihidroxi-propil]ciclopropanosulfonamidas, del 18 de Julio de 2018, de ARDEA BIOSCIENCES, INC: Un compuesto seleccionado de: Bromuro de 1-{[(4S)-2,2-dimetil-1,3-dioxolan-4-il]metil}ciclopropanosulfonilo (S)-10-Br: **Fórmula** Bromuro […]
Derivado de bisfurano antivírico como inhibidor de la proteasa del VIH e intermedios del mismo, del 16 de Marzo de 2016, de GILEAD SCIENCES, INC.: Un compuesto que tiene la fórmula C:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Proceso para la síntesis de haluros de sulfonilo y sulfonamidas a partir de sales de ácido sulfónico, del 19 de Enero de 2016, de Ziarco Pharma Ltd: Un proceso sintético que comprende hacer reaccionar un compuesto de Fórmula II: [Ar-(R)z-SO3-1]qM II en la que: Ar es fenilo sustituido con un grupo perhaloalquilo […]
MÉTODOS PARA LA PREPARACIÓN DE DERIVADOS DE N-ISOBUTIL-N-(2-HIDROXI-3-AMINO-4-FENILBUTIL)-P-NITROBENCENOSULFONILAMIDA, del 8 de Junio de 2011, de TIBOTEC PHARMACEUTICALS: Un proceso para la preparación de derivados de N-isobutil-N-(2-hidroxi-3-amino-4-fenilbutil)-p-nitrobencenosulfonilamida de fórmula (I) que comprende hacer […]
MÉTODO DE PREPARACIÓN DE (R)-(-)-5(2-AMINOPROPIL)-2-METOXIBENZENOSULFONAMIDA, del 16 de Marzo de 2011, de ZENTIVA, K.S: Método de preparación de (R)- -5-(2-aminopropil)-2metoxibencenosulfonamida de fórmula I caracterizado porque a. se introduce un grupo protector a N-[(1R)-2-(4-metoxifenil)-1-metiletil]-N-[(1R)-1feniletil)]amina […]
NITRO-SULFOBENZAMIDAS, del 29 de Enero de 2010, de BAYER CROPSCIENCE GMBH: Un compuesto de la fórmula (I) **(Ver fórmula)** en la que R1 es un radical hidrocarbilo sin sustituir o sustituido que tiene un total de 1 a 10 átomos de carbono, R2 es […]