DERIVATIZACION DEL FACTOR ESTIMULANTE DE COLONIAS GRANULOCITICAS (GCSF).
Un compuesto que es un derivado polisacárido N-terminal del GCSF,
o de una proteína parecida al GCSF, en el que el polisacárido es el ácido polisiálico que posee al menos 2 unidades de ácido siálico unidas una a la otra a través de enlaces a2,8 ó a2,9 y está compuesto de entre 2 y 200 unidades sacáridas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2007/002816.
Solicitante: LIPOXEN TECHNOLOGIES LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: LONDON BIOSCIENCE INNOVATION CENTRE 2 ROYAL COLLEGE STREET,LONDON NW1 0NH.
Inventor/es: LAING, PETER, GREGORIADIS, GREGORY, JAIN,SANJAY.
Fecha de Publicación: .
Fecha Concesión Europea: 12 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K47/48H4P
- A61K47/48K8
- C07K14/535 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › CSF de granulocitos; CSF de granulocitos-macrófagos.
Clasificación PCT:
- A61K47/48
- C07K14/535 C07K 14/00 […] › CSF de granulocitos; CSF de granulocitos-macrófagos.
Fragmento de la descripción:
Derivatización del factor estimulante de colonias granulocíticas (GCSF).
La presente invención hace referencia a derivados polisacáridos novedosos del GCSF y a métodos para producir dichos derivados. Los derivados son útiles para mejorar la estabilidad, la farmacocinética y la farmacodinámica del GCSF.
El Factor Estimulante de Colonias Granulocíticas (GCSF, CSF3) es una glicoproteina. Puede actuar como una hormona, un factor de crecimiento o una citoquina y la producen cierto número de tejidos diferentes para estimular que la médula ósea produzca granulocitos y células madre. El GCSF también estimula la supervivencia, proliferación, diferenciación y funcionamiento de los precursores de neutrófilos y los neutrófilos maduros.
El GCSF es producido por el endotelio, los macrófagos y cierto número de otras células inmunitarias. La glicoproteína humana natural existe de dos formas, una proteína larga de 174 y 180 aminoácidos con un peso molecular de 19,600 gramos por mol. La forma de 174 aminoácidos, más abundante y más activa, se ha utilizado en el desarrollo de productos farmacéuticos mediante la tecnología de ADN recombinante (ADNr). El GCSF de los ratones fue reconocido y purificado por primera vez en Australia en 1983, y la forma humana fue clonada por grupos procedentes de Japón y los Estados Unidos en 1986. El receptor de GCSF está presente en células precursoras de la médula ósea, y, en respuesta a la estimulación provocada por el GCSF, inicia la proliferación y la diferenciación en granulocitos maduros.
El GCSF estimula la producción de glóbulos blancos. En oncología y hematología, se utiliza una forma recombinante del GCSF con determinados pacientes con cáncer para acelerar la recuperación de la neutropenia tras la quimioterapia, permitiendo regímenes de tratamiento de mayor intensidad. La quimioterapia puede causar mielosupresión y niveles inaceptablemente bajos de glóbulos blancos, haciendo que los pacientes sean propensos a infecciones y sepsis. El GCSF también se utiliza para incrementar el número de células madre hematopoyéticas en la sangre antes de la recogida mediante leucoféresis para su uso en los trasplantes de células madre hematopoyéticas.
El GCSF recombinante humano sintetizado en un sistema de expresión de E. coli se denomina filgrastim. La estructura del filgrastim difiere ligeramente de la estructura de la glicoproteína natural. La mayoría de los estudios publicados han utilizado el filgrastim. El filgrastim (Neupogen®) es una forma comercialmente disponible del GCSFrh (GCSF recombinante humano).
Otra forma de GCSF recombinante humano, el lenograstim, se sintetiza en las células de los ovarios de los hámsteres chinos. Dado que éste es un sistema de expresión de células de mamíferos, es imposible de distinguir el lenograstim del GCSF humano natural de 174 aminoácidos. Aún no se han identificado consecuencias clínicas o terapéuticas de las diferencias entre el filgrastim y el lenograstim, y no se han realizado estudios comparativos formales.
Se han hecho intentos por derivatizar el GCSF para mejorar sus propiedades farmacocinéticas. Existe un producto en el mercado, el PEG-filgrastim (Neulasta®), que es una forma derivatizada del polietilenglicol del GCSF. Se ha demostrado que éste posee una vida media mayor que el filgrastim, reduciendo la necesidad de inyecciones diarias. El diseño y desarrollo del PEG-filgrastim viene descrito con más detalle en Curr. Pharm Des. 2004; 10(11): 1235-44.
US20070014759 describe conjugados entre partes de moléculas de PEG y GCSF que están unidas a través de un grupo de enlace glicosilo intacto. Los conjugados se forman a partir de péptidos tanto glicosilados como no glicosilados a través de la acción de una glicosiltransferasa en aminoácidos de cadena media. US6956027 facilita las condiciones para modificar de forma selectiva el extremo N-terminal del GCSF con PEG.
Otros han derivatizado el GCSF con moléculas que no son PEG. WO 2005/014050, por ejemplo, describe el GCSF unido covalentemente a almidón de hidroxialquilo.
En vista del estado anterior de la técnica, existe la necesidad de proporcionar derivados mejorados del GCSF que se puedan utilizar en terapia humana y animal y que posean una estabilidad y vida media optimizadas y baja toxicidad. Hemos descubierto que unir PSAs al GCSF confiere dichas propiedades y de ese modo hemos llegado a esta invención. Ésta es la primera vez que se ha descrito el GCSF unido en el extremo N-terminal a polisacáridos aniónicos.
Los ácidos polisiálicos (PSAs) son polímeros del ácido siálico no ramificados presentes de forma natural producidos por determinadas cepas bacterianas y en los mamíferos en ciertas células. Pueden producirse en diferentes grados de polimerización desde n= alrededor de 80 ó más residuos de ácido siálico hasta n=2 mediante hidrólisis ácida limitada o mediante digestión con neuraminidasas, o mediante fraccionamiento de las formas naturales derivadas de manera bacteriana del polímero.
En los últimos años, se han aprovechado las propiedades biológicas de los ácidos polisiálicos, en particular las del ácido polisiálico homopolimérico unido con enlaces alfa-2,8, para modificar las propiedades farmacocinéticas de las moléculas de fármacos de bajo peso molecular y de proteínas. La derivatización del ácido polisiálico da lugar a aumentos espectaculares en la vida media de cierto número de proteínas terapéuticas circulantes incluyendo la catalasa y la asparaginasa, y también permite que se puedan utilizar dichas proteínas con anticuerpos preexistentes generados como una consecuencia no deseada (y a veces inevitable) a una exposición previa a la proteína terapéutica [Fernandes y Gregoriadis, 2006; Jain et. al., 2003, 2004]. El ácido polisiálico unido con enlaces alfa-2,8 ofrece una alternativa atractiva al PEG, siendo un polímero biodegradable inmunológicamente invisible que forma parte de manera natural del cuerpo humano, y que se degrada, a través de neuraminidasas de los tejidos, en ácido siálico, un sacárido no tóxico.
Anteriormente hemos descrito métodos para la unión de polisacáridos (en especial el PSA) a agentes terapéuticos como por ejemplo las proteínas [US-A-5846.951; WO-A-0187922]. Algunos de estos métodos dependen de la derivatización química del extremo "no reductor" del polímero para crear una parte de una molécula de aldehído reactiva a las proteínas que reaccione ante grupos amina primarios. Una unidad terminal de ácido siálico no reductora, debido a que contiene dioles vecinos, puede oxidarse fácilmente (y de forma selectiva) con peryodato para producir una forma de monoaldehído, que es mucho más reactiva ante las proteínas, y que comprende un elemento adecuadamente reactivo para la unión de las proteínas a través de la aminación reductiva y otros comportamientos químicos. La reacción viene ilustrada en las Figuras 1 y 2 en las que:
La Figura 1 muestra la oxidación del ácido colomínico (ácido polisiálico unido con enlaces alfa-2,8 de E. coli) con peryodato de sodio para formar un aldehído reactivo ante las proteínas en el extremo no reductor; y
La Figura 2 muestra la reducción selectiva de la base de Schiff con cianoborohidruro de sodio para formar un enlace covalente irreversible y estable con el grupo amino de las proteínas.
Se pueden generar subproductos de forma no intencionada durante las reacciones de conjugación convencionales descritas anteriormente mediante la reacción del ácido colomínico con cadenas laterales de aminoácidos, por ejemplo. Estos puede que sean suficientes como para dar problemas en la fabricación de conjugados químicamente definidos requeridos por las autoridades reguladoras para el uso terapéutico en el hombre y los animales.
No resulta sencillo purificar el producto de reacción buscado (por ejemplo el producto monopolisialilado) de los diferentes productos no deseados, dado que las características fisicoquímicas de la mayoría de los productos de reacción son similares. Esto significa que técnicas como la cromatografía de intercambio iónico y la cromatografía de permeación en gel (que separan basándose respectivamente en la carga y el tamaño) producen perfiles de purificación pobres. Este problema se puede superar reduciendo la complejidad de los productos en la reacción de conjugación. Hemos desarrollado un nuevo método para la conjugación de polisacáridos con proteínas según el que puede utilizarse la alta reactividad del extremo N-terminal de la proteína y que evita la complejidad...
Reivindicaciones:
1. Un compuesto que es un derivado polisacárido N-terminal del GCSF, o de una proteína parecida al GCSF, en el que el polisacárido es el ácido polisiálico que posee al menos 2 unidades de ácido siálico unidas una a la otra a través de enlaces a2,8 ó a2,9 y está compuesto de entre 2 y 200 unidades sacáridas.
2. Un compuesto de conformidad con la reivindicación 1, en el que el polisacárido es un ácido polisiálico, que consta básicamente solamente de unidades de ácido siálico.
3. Un compuesto de conformidad con la reivindicación 1 ó la reivindicación 2, en el que el polisacárido derivatiza el GCSF o la proteína parecida al GCSF en la unidad terminal reductora del polisacárido.
4. Un compuesto con la fórmula general (I)
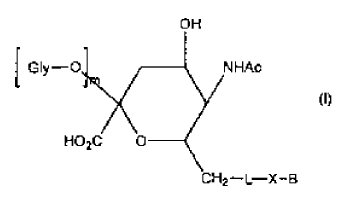
en la que
m es al menos uno;
XB deriva de B-XH que es el GCSF o una proteína parecida al GCSF donde XH es NH2 ó SH;
L es un enlace, un grupo de unión, o está compuesto de un polipéptido o un oligómero sintético;
GlyO es una unidad de ácido siálico, donde las unidades de ácido siálico están unidas con enlaces a2,8 ó a2,9 las unas a las otras;
en la que el grupo de unión, si está presente, tiene la fórmula general -Y-C(O)-R1-C(O)-;
en la que Y es NR2 ó NR2-NR2; R1 es un radical orgánico bifuncional seleccionado del grupo que está compuesto de alcanediilo, arileno, alcarileno, heteroarileno y alquilheteroarileno, cualquiera de los cuales puede ser sustituido y/o interrumpido por enlaces carbonilo, éster, sulfuro, éter, amida y/o amina;
y R2 es H o un alquilo C1-6.
5. Un compuesto de conformidad con la reivindicación 4, en el que L es un enlace o es un grupo.
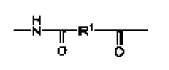
6. Un compuesto de conformidad con la reivindicación 4 ó 5, en el que XH es NH2 y es la amina N-terminal del GCSF o de la proteína parecida al GCSF.
7. Un compuesto de conformidad con la reivindicación 4 ó 5, en el que XH es NH2 y es un grupo amina de la cadena lateral de un aminoácido lisina.
8. Un compuesto de conformidad con cualesquiera de las reivindicaciones anteriores, en el que el ácido polisiálico está compuesto de 80-180 unidades de ácido siálico.
9. Una composición farmacéutica que comprende un compuesto de conformidad con cualesquiera de las reivindicaciones 1-8, y uno o más excipientes farmacéuticamente aceptables.
10. Un compuesto de conformidad con cualesquiera de las reivindicaciones 1-8, para su uso en terapia.
11. Un método para producir un N-derivado polisacárido del GCSF o de una proteína parecida al GCSF en el que un polisacárido aniónico, es decir, un ácido polisiálico que posea al menos 2 unidades de ácido siálico unidas con enlaces a2,8 ó a2,9 la una a la otra y que esté compuesto de 2-200 unidades sacáridas, se hace reaccionar químicamente con el GCSF o la proteína parecida al GCSF.
12. Un método de conformidad con la reivindicación 11, en el que el polisacárido aniónico posee un grupo aldehído reactivo que reacciona con el GCSF o con la proteína parecida al GCSF y la reacción de derivatización se lleva a cabo bajo condiciones de reducción.
13. Un método de conformidad con la reivindicación 12, en el que el grupo aldehído reactivo se encuentra en el extremo no reductor del polisacárido.
14. Un método de conformidad con cualesquiera de las reivindicaciones 11-13, en el que el polisacárido reacciona con un grupo amina del GCSF o de la proteína parecida al GCSF.
15. Un método de conformidad con la reivindicación 14, donde la amina es un grupo amina terminal.
16. Un método de conformidad con la reivindicación 15, en el que la amina se deriva de la cadena lateral de un aminoácido lisina del GCSF o de la proteína parecida al GCSF.
17. Un método de conformidad con cualesquiera de las reivindicaciones 11-16, en el que el polisacárido aniónico o producto intermedio de la reacción reacciona con un grupo amina terminal del GCSF o de la proteína parecida al GCSF en una primera solución acuosa de pH acídico de entre 4,0-6,0; y el derivado polisacárido resultante se purifica en una segunda solución acuosa de un pH mayor que el de la primera solución acuosa en la gama entre 6,5-8,5.
18. Un método de conformidad con cualesquiera de las reivindicaciones 11-17, que se lleva a cabo en presencia de un aditivo de formulación seleccionado de entre uno o más tampones, estabilizadores, surfactantes, sales, polímeros, iones metálicos, azúcares, polioles o aminoácidos.
19. Un método de conformidad con la reivindicación 18, en el que el aditivo de formulación se selecciona de entre el sorbitol, la trehalosa, la sacarosa, los surfactantes no iónicos, los polímeros seleccionados de entre el PSA, el PEG y la hidroxi-beta-ciclodextrina, los iones metálicos divalentes, y el tampón de acetato/fosfato de sodio.
Patentes similares o relacionadas:
Dímero de G-CSF humano recombinante y uso del mismo para el tratamiento de enfermedades neurológicas, del 14 de Agosto de 2019, de Generon (Shanghai) Corporation Ltd: Un polipéptido de G-CSF-Fc aislado que comprende: (i) la secuencia de aminoácidos de la SEQ ID NO: 4 o 6, o (ii) la secuencia de aminoácidos de la […]
Roedores inmunodeficientes modificados genéticamente y métodos de uso de los mismos, del 3 de Julio de 2019, de Institute for Research in Biomedicine (IRB): Un roedor inmunodeficiente genéticamente modificado que comprende: un ácido nucleico que 5 codifica IL-6 humana unido operativamente a un promotor de IL-6, en donde el roedor […]
Composición farmacéutica que contiene, como ingrediente activo, la proteína mutante del factor estimulante de colonias de granulocitos o la proteína de fusión de transferrina de la misma, del 8 de Mayo de 2019, de SUPEX BNP CO., LTD: Una proteína de fusión en la que la transferrina está unida por un péptido a un terminal de una proteína mutante del factor estimulante de colonias de granulocitos […]
Método para la producción de G-CSF, del 24 de Abril de 2019, de RICHTER GEDEON NYRT: Método para la producción de un polipéptido de G-CSF recombinante en cuerpos de inclusión, comprendiendo el método (a) cultivar una célula huésped bacteriana […]
Aminoácidos modificados que comprenden un grupo azido, del 17 de Abril de 2019, de Sutro Biopharma, Inc: Un compuesto de acuerdo con la formula II:**Fórmula** o una de sus sales, en la que W4 es alquileno C1-C10.
Composiciones que presentan un virus de la enfermedad de Newcastle atenuado y métodos de uso para el tratamiento de la neoplasia, del 11 de Abril de 2019, de MEDIMMUNE LIMITED: Una cepa 73T del virus de la enfermedad de Newcastle atenuado (NDV) en la que se modifica el sitio de escisión de la proteína F de tipo salvaje (FPCS) que tiene […]
Procesamiento mejorado de G-CSF humano recombinante, del 3 de Abril de 2019, de OCTAPHARMA AG: Un precursor de G-CSF que comprende un péptido señal y un péptido G-CSF, en el que el péptido señal tiene la secuencia del péptido señal de tipo silvestre humano de la molécula […]
Ratones modificados genéticamente e injerto, del 19 de Febrero de 2019, de REGENERON PHARMACEUTICALS, INC.: Un raton Rag2-/-IL-2rγ-/- modificado geneticamente, que comprende una sustitucion de un gen de trombopoyetina (TPO) de raton con un gen de TPO humana en […]