COMPRIMIDO DE BOSENTAN DISPERSABLE.
Un comprimido dispersable que comprende el compuesto I de la fórmula
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/051519.
Solicitante: ACTELION PHARMACEUTICALS LTD..
Nacionalidad solicitante: Suiza.
Dirección: GEWERBESTRASSE 16,4123 ALLSCHWIL.
Inventor/es: HOLMAN,LOVELACE, TRENKTROG,TIMM.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/513 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo grupos oxo unidos directamente al heterociclo, p. ej. citosina.
- A61K9/00Z6
Clasificación PCT:
- A61K31/513 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. citosina.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
Fragmento de la descripción:
Comprimido de bosentán dispersable.
La presente invención se refiere a comprimidos dispersables que comprenden el compuesto 4-terc-butil-N-[6-(2-hidroxietoxi)-5-(2-metoxi-fenoxi)-2-(pirimidin-2-il)-pirimidin-4-il]-bencensulfonamida, denominándose dicho compuesto en lo que sigue como compuesto I.
El compuesto I tiene la siguiente fórmula:
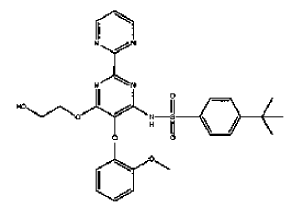
El compuesto I es un inhibidor del receptor de endotelina y es de utilidad para el tratamiento de hipertensión arterial pulmonar (PAH). El compuesto I y su preparación se revelan en el documento EP 0526708 A1.
Bosentán (Tracleer®) es un tratamiento oral para PAH (clases III y IV en los Estados Unidos, clase III en Europa). Bosentán es un antagonista dual del receptor de endotelina con afinidad tanto por el receptor de endotelina ETA y ETB, por lo que evita los efectos nocivos de ET-1. Tal como se sabe de la World Standard Drug Database, la formulación asequible en comercios tiene la siguiente composición: bosentán (125 ó 62,5 mg), almidón, triacetina, estearato de magnesio, talco, óxido férrico, povidona, dióxido de titanio, etilcelulosa, behenato de glicerilo, hipromelosa y glicolato de almidón sódico.
Dentro del contexto de esta descripción, cualquier referencia al compuesto I ha de entenderse también a sus sales o solvatos farmacéuticamente aceptables, incluyendo los hidratos del compuesto I, así como sus formas morfológicas, si no se indica otra cosa y, cuando sea apropiado y oportuno.
Por "comprimido dispersable" se entiende un comprimido que se desintegra por completo en agua a 15-22ºC en no más de 5 minutos o, con preferencia, en menos de 4 minutos. En otra forma de realización, los comprimidos dispersables de la presente invención tienen un tiempo de desintegración inferior a 3 minutos, con preferencia inferior a 2 minutos o, con máxima preferencia, inferior a 1 minuto (método de desintegración de acuerdo con la European Pharmacopoeia, EP).
El presente producto farmacológico del compuesto I se está comercializando en la actualidad como un comprimido para el tratamiento de PAH, una enfermedad mortal si no se trata. Los niños tienen dificultad para ingerir comprimidos, de modo que la formulación en comprimido actualmente comercializada no es conveniente para administrar en niños. Un producto farmacológico en forma de una suspensión será más conveniente para niños. Por ello, la presente invención se refiere al desarrollo de un comprimido que se puede dispersar en agua para formar una suspensión antes de administrarla. El comprimido dispersable se deberá desintegrar en agua a 15-22ºC en menos de 5 minutos o preferentemente en menos de 4 minutos. En otra forma de realización, los comprimidos dispersables de la presente invención tienen un tiempo de desintegración inferior a 3 minutos, con preferencia inferior a 2 minutos o, con máxima preferencia, inferior a 1 minuto en base al método de acuerdo con la European Pharmacopoeia (método de desintegración de acuerdo con la EP).
Otras ventajas de la formulación pediátrica son las siguientes:
La presente invención provee tal comprimido dispersable apropiado para niños, que comprende: (a) compuesto I y (b) excipientes farmacéuticamente aceptables apropiados para la preparación de comprimidos dispersables. La cantidad de compuesto I, calculada como el porcentaje del contenido en peso del resto activo, en base al peso total del comprimido dispersable; es del 5% al 40%, con preferencia del 8% al 30%. En particular, la cantidad del compuesto I como ingrediente activo puede variar del 10% al 17%.
En una forma de realización preferida de la invención, la presente invención provee un comprimido dispersable, en el que el compuesto I está en la forma de monohidrato.
Los excipientes farmacéuticamente aceptables están presentes en el comprimido dispersable, por ejemplo, agente de cargas (1.1), desintegrantes (1.2), deslizantes (1.3), agentes acidificantes (1.4), agentes saborizantes (1.5), agentes endulzantes (1.6), y lubricantes (1.7).
Se hace referencia a la extensa literatura al objeto para estos y otros excipientes farmacéuticamente aceptables y procedimientos mencionados en la presente, ver en particular Handbook of Pharmaceutical Excipients, Third Edition, editado por Arthur H. Kibbe, American Pharmaceutical Association, Washington, Estados Unidos y Pharmaceutical Press, Londres; y Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete editado por H. P. Fiedler, 4th Edition, Edito Cantor, Aulendorf y anteriores ediciones.
Los agentes de carga (1.1) de acuerdo con la invención incluyen, pero sin limitación, celulosa microcristalina, fosfato dicálcico, lactosa y almidón pregelatinizado. Con preferencia, la celulosa microcristalina se usa en combinación con fosfato dicálcico.
Los desintegrantes apropiados (1.2) de acuerdo con la invención incluyen, pero sin limitación, croscarmelosa sódica, glicolato de almidón sódico, almidón de maíz, CMC-Ca, CMC-Na, celulosa microcristalina, PVP con enlaces cruzados, por ejemplo, tal como se conocen y son asequibles en comercios bajo los nombres comerciales crospovidona, poliplasdona, disponibles en comercios de la empresa ISP, o Kollidon® XL, ácido algínico, alginato de sodio, almidón pregelatinizado y goma guar. Con preferencia, se usa croscarmelosa sódica, por ejemplo, Ac-Di-Sol®.
Como deslizantes (1.3), se puede usar uno o varios de los siguientes: sílice; sílice coloidal, por ejemplo, sílice coloidal anhidra, por ejemplo, Aerosil® 200, trisilicato de magnesio, celulosa en polvo, almidón y talco. Con preferencia, se usa dióxido de silicio coloidal.
Los agentes acidificantes (1.4) incluyen, pero sin limitación, ácido tartárico, ácido cítrico, ácido ascórbico, ácido láctico y ácido fumárico. Con preferencia, se usa ácido tartárico.
Los agentes saborizantes (1.5) incluyen, pero sin limitación, Tutti Frutti, fresa, banana y vainilla. Con preferencia, se usa Tutti Frutti.
Los agentes endulzantes apropiados (1.6) de acuerdo con la invención incluyen, pero sin limitación: aspartamo, acesulfame de potasio, sacarina, sacarina sódica, ciclamato sódico, sucralosa. Con preferencia, los agentes endulzantes usados son aspartamo y acesulfame de potasio.
Los agentes saborizantes añadidos tal como se mencionó con anterioridad y/o los agentes endulzantes tal como se mencionó con anterioridad tienen la ventaja de elevar la aceptación.
Como lubricantes (1.7) se pueden usar uno o varios de los siguientes: estearato de Mg, de AI o de Ca, ácido esteárico, estearilfumarato sódico, talco, benzoato de sodio, ácido graso de monoglicerilo, por ejemplo, con un peso molecular de 200 a 800 Daltons, por ejemplo, monoestearato de glicerilo (por ejemplo, Danisco, Reino Unido), dibehenato de glicerilo (por ejemplo, Compritol AT0888TM, Gattefossé Francia), éster glicerilpalmito-esteárico (por ejemplo, PrecirolTM, Gattefossé France), polietilenglicol (PEG, BASF), aceite de semillas de algodón hidrogenado (Lubitab, Edward Mendell Co Inc.), aceite de ricino (Cutina HR, Henkel) y ésteres de sacarosa (Surfhope SE, Mitsubishi-Kagaku Foods Co.). Con preferencia, se usa estearato de magnesio, solo o en combinación con dibehenato de glicerilo.
Se apreciará que cualquier excipiente dado pueda servir para más de una función, por ejemplo, como agente de carga, desintegrante, aglutinante, deslizante y/o lubricante.
Se halló que la presencia de un agente acidificante (1.4) reduce la solubilidad del compuesto I, evitando así sentir el sabor amargo del compuesto I cuando el comprimido se dispersa con agua, por ejemplo, en una cuchara antes de administrarlo. El sabor amargo del compuesto I también se puede superar usando agentes saborizantes (1.5) y/o agentes endulzantes (1.6).
De acuerdo con la presente invención, la cantidad de agente de carga (1.1) varía dentro de un intervalo del 40 al 85%, en particular del 63 al 78% en peso, en base al peso total del comprimido dispersable.
La cantidad de desintegrante...
Reivindicaciones:
1. Un comprimido dispersable que comprende el compuesto I de la fórmula
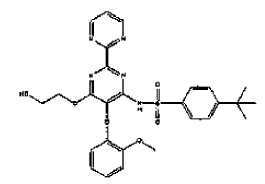
o una de sus sales o solvatos farmacéuticamente aceptables, y excipientes farmacéuticamente aceptables, que comprende los siguientes excipientes farmacéuticamente aceptables: uno o varios agente de cargas en una cantidad total del 40 al 85% en peso, en base al peso total del comprimido dispersable, uno o varios desintegrantes en una cantidad total del 0,5 al 20% en peso, en base al peso total del comprimido dispersable, uno o varios deslizantes en una cantidad total del 0,1 al 5% en peso, en base al peso total del comprimido dispersable, uno o varios agentes acidificantes en una cantidad total del 0,5 al 13% en peso, en base al peso total del comprimido dispersable, uno o varios agentes saborizantes en una cantidad total del 1 al 15% en peso, en base al peso total del comprimido dispersable, uno o varios agentes endulzantes en una cantidad total del 0,1 al 10% en peso, en base al peso total del comprimido dispersable, y uno o varios lubricantes en una cantidad total del 0,05 al 7% en peso, en base al peso total del comprimido dispersable, en el que el comprimido dispersable es un comprimido que se desintegra por completo en agua a 15-22ºC en no más de 5 minutos.
2. Un comprimido dispersable de acuerdo con la reivindicación 1, que comprende los siguientes excipientes farmacéuticamente aceptables: uno o varios agente de cargas en una cantidad total del 63% al 78% en peso, en base al peso total del comprimido dispersable, uno o varios desintegrantes en una cantidad total del 1 al 15% en peso, en base al peso total del comprimido dispersable, uno o varios deslizantes en una cantidad total del 0,5 al 1,0% en peso, en base al peso total del comprimido dispersable, uno o varios agentes acidificantes en una cantidad total del 1 al 8% en peso, en base al peso total del comprimido dispersable, uno o varios agentes saborizantes en una cantidad total del 2 al 10% en peso, en base al peso total del comprimido dispersable, uno o varios agentes endulzantes en una cantidad total del 0,2 al 8% en peso, en base al peso total del comprimido dispersable, y uno o varios lubricantes en una cantidad total del 0,1 al 3% en peso, en base al peso total del comprimido dispersable.
3. Un comprimido dispersable de acuerdo con la reivindicación 1, en el que el agente de carga está seleccionado de celulosa microcristalina, fosfato dicálcico, lactosa y almidón pregelatinizado; el desintegrante está seleccionado de croscarmelosa sódica, glicolato de almidón sódico, almidón de maíz, CMC-Ca, CMC-Na, celulosa microcristalina, PVP reticulado, ácido algínico, alginato de sodio, almidón pregelatinizado y goma guar; el deslizante está seleccionado de sílice, sílice coloidal, trisilicato de magnesio, celulosa en polvo, almidón y talco; el agente acidificante está seleccionado de ácido tartárico, ácido cítrico, ácido ascórbico, ácido láctico y ácido fumárico; el agente saborizante está seleccionado de Tutti Frutti, fresa, banana y vainilla; el agente endulzante está seleccionado de aspartamo, acesulfame de potasio, sacarina, sacarina sódica, ciclamato sódico, sucralosa; el lubricante está seleccionado de estearato de Mg, de AI o de Ca, ácido esteárico, estearilfumarato sódico, talco, benzoato de sodio, ácido graso de monoglicerilo, polietilenglicol, aceite de semillas de algodón hidrogenado, aceite de ricino y ésteres de sacarosa.
4. Un comprimido dispersable de acuerdo con cualquiera de las reivindicaciones 1 a 3, que consiste en 33,045 mg de compuesto micronizado de la fórmula I como monohidrato; 116,265 mg de celulosa microcristalina; 101,5 mg de fosfato dicálcico; 11,6 mg de croscarmelosa sódica; 2,9 mg de dióxido de silice coloidal; 7,0 mg de ácido tartárico; 9,0 mg de Tutti Frutti; 3,7 mg de aspartamo; 1,8 mg de acesulfame de potasio; 3,19 mg de estearato de magnesio.
5. El comprimido dispersable de acuerdo con la reivindicación 1, en el que el compuesto I está en forma de monohidrato.
6. El comprimido dispersable de acuerdo con las reivindicaciones 1 y 5 que se puede obtener usando el método de compresión directa.
7. El comprimido dispersable de acuerdo con cualquiera de las reivindicaciones 1, 5 y 6 para usar como un medicamento.
8. Uso del compuesto I, o una de sus sales o solvatos farmacéuticamente aceptable, para la preparación de un comprimido dispersable de acuerdo con cualquiera de las reivindicaciones 1, 5 y 6, para usar en el tratamiento de hipertensión arterial pulmonar.
9. Un procedimiento de preparación de un comprimido dispersable que comprende el compuesto I de la fórmula
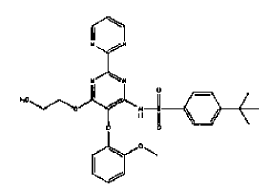
o una de sus sales o solvatos farmacéuticamente aceptable, y excipientes farmacéuticamente aceptables, caracterizado porque el comprimido se prepara por compresión directa, en donde el comprimido dispersable es un comprimido que se desintegra por completo en agua a 15-22ºC en no más de 5 minutos.
Patentes similares o relacionadas:
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Régimen de terapia y métodos para sensibilizar células de cáncer tratadas con una terapia epigenética frente a inhibidores de PARP en múltiples cánceres, del 22 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una combinación que comprende un agente desmetilante del ADN y un inhibidor de poli ADP ribosa polimerasa (PARP) para su uso en el tratamiento del cáncer, en […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Agente terapéutico para cáncer sólido, del 17 de Junio de 2020, de IDAC Theranostics, Inc: Un agente para uso en el tratamiento de cáncer sólido que comprende como principio activo un anticuerpo anti-CD4 que es un anticuerpo quimérico de tipo humano, un anticuerpo […]
Fármaco antitumoral que contiene compuesto de taxano y potenciador del efecto antitumoral, del 3 de Junio de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un agente antitumoral que consiste en un fármaco de combinación que contiene trifluridina y clorhidrato de tipiracilo en una relación molar […]
Derivados de iminotetrahidropirimidinona como inhibidores de plasmepsina V, del 27 de Mayo de 2020, de UCB Biopharma SRL: Un compuesto de fórmula (IIA) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde el anillo X representa un anillo […]
Composición farmacéutica oral, del 20 de Mayo de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un comprimido sin recubrir que comprende α-α-α-trifluorotimidina y clorhidrato de 5-cloro-6-(2-iminopirrolidin-1- il)metil-2,4-(1H,3H)-pirimidin diona […]