COMBINACION DE INHIBIDORES DE LA PROTEASA DEPENDIENTE DEL CITOCROMO P450.
Tipo: Resumen de patente/invención. Número de Solicitud: W0214277EP.
Solicitante: TIBOTEC PHARMACEUTICALS LTD..
Nacionalidad solicitante: Irlanda.
Dirección: EASTGATE VILLAGE,EASTGATE LITTLE ISLAND CO CORK.
Inventor/es: STOFFELS,PAUL, VAN DER GEEST,RONALD, GROEN,CORNELIS, JOCHMANS,DIRK,EDWARD,DESIRE.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/635 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que contienen un heterociclo, p. ej. sulfadiazina.
Clasificación PCT:
- A61K31/365 A61K 31/00 […] › Lactonas.
- A61K31/425 A61K 31/00 […] › Tiazoles.
- A61K31/435 A61K 31/00 […] › que tienen ciclos con seis eslabones con un nitrógeno como único heteroátomo de un ciclo.
- A61K31/47 A61K 31/00 […] › Quinoleínas; Isoquinoleínas.
- A61K31/495 A61K 31/00 […] › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K31/635 A61K 31/00 […] › que contienen un heterociclo, p. ej. sulfadiazina.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P31/18 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para el VIH.
Clasificación antigua:
- A61K31/365 A61K 31/00 […] › Lactonas.
- A61P31/18 A61P 31/00 […] › para el VIH.
Fragmento de la descripción:
Combinación de inhibidores de la proteasa dependiente del citocromo P450.
La presente invención se refiere a la mejora de la farmacocinética de inhibidores de la proteasa de HIV que contienen hexahidrofuro[2,3-b]furanilo, que comprende administrar a un humano que se encuentra en necesidad de ello una combinación de una cantidad terapéuticamente eficaz de un inhibidor de la proteasa de HIV que contiene hexahidrofuro[2,3-b]furanilo, y una cantidad terapéuticamente eficaz de un inhibidor del citocromo P450.
El virus causante del síndrome de inmunodeficiencia adquirida (SIDA) se conoce por diferentes nombres, que incluyen virus III de los linfocitos T (HTLV-III) o virus asociado a la linfadenopatía (LAV) o virus afín al SIDA (ARV) o virus de la inmunodeficiencia humana (HIV). Hasta ahora se han identificado dos familias distintas, a saber HIV-1 y HIV-2. En lo sucesivo, se utilizará HIV para designar genéricamente estos virus.
Uno de los caminos críticos en el ciclo vital de un retrovirus es el procesamiento de los precursores de poliproteína por la proteasa retrovírica. Por ejemplo, durante el ciclo de replicación del virus del HIV, los productos de la transcripción de los genes gag y gag-pol se traducen como proteínas, las cuales son procesadas subsiguientemente por una proteasa (o proteinasa) para producir enzimas virales y proteínas estructurales del núcleo del virus. Con gran generalidad, las proteínas precursoras de gag se procesan en las proteínas de núcleo y las proteínas precursoras de pol se procesan en las enzimas virales, v.g., transcriptasa inversa, integrasa y proteasa retroviral. Se ha demostrado que el procesamiento correcto de las proteínas precursoras por la proteasa retroviral es necesario para el ensamblaje de los viriones infectados. Por ejemplo, se ha demostrado que mutaciones de desplazamiento de marco en la región de la proteasa del gen pol de HIV previenen el procesamiento de la proteína precursora de gag. Se ha demostrado también que, por mutagénesis orientada de un residuo de ácido aspártico en el sitio activo de la proteasa de HIV, se previene el procesamiento de la proteína precursora gag. Por esta razón, la inhibición de la proteasa retrovírica proporciona una diana atractiva para la terapia antiviral. En particular, para el tratamiento de HIV, la proteasa de HIV es una diana atractiva.
La inhibición de la proteasa retroviral implica típicamente una mimética de estados de transición por la cual la proteasa retroviral se expone a un compuesto mimético que se fija (típicamente de manera reversible) a la enzima en competición con las proteínas gag y gag-pol para inhibir con ello el procesamiento específico de proteínas estructurales y la liberación de la proteasa retrovírica propiamente dicha. De esta manera pueden inhibirse eficazmente las proteasas de replicación retrovírica.
Los inhibidores de la proteasa de HIV (PIs) se administran comúnmente a los pacientes de SIDA en combinación con otros compuestos anti-HIV tales como, por ejemplo, inhibidores de la transcriptasa inversa nucleosídicos (NRTIs), inhibidores de la transcriptasa inversa no nucleosídicos (NNRTIs) u otros inhibidores de proteasas.
Ghosh et al. (Bioorg. Med. Chem. Lett., 1998, 8, 687-690), WO 00/47551 y WO 99/33815 describen ciertos inhibidores de proteasa de HIV que comprenden un resto hexahidrofuro[2,3-b]furanilo.
Algunos antirretrovirales y, en particular, algunos inhibidores de la proteasa de HIV son metabolizados por el citocromo P450, conduciendo a perfiles farmacocinéticos sub-óptimos que causan una necesidad indeseable de dosis más frecuentes y mayores. Así pues, existe una alta necesidad médica de un tratamiento eficaz y seguro anti-HIV en el cual los compuestos terapéuticos tengan biodisponibilidad satisfactoria, un perfil farmacocinético y metabólico favorable, y tengan efectos secundarios reducidos.
Varias descripciones proponen una combinación de un inhibidor de proteasa con al menos un segundo compuesto para la mejora de la farmacocinética de dicho primer PI. Por ejemplo, WO 00/25784 describe un método para mejorar la farmacocinética de tipranavir que comprende una combinación de tipranavir y ritonavir. La patente de EE.UU. No. 6.180.634 describe una composición sinérgica que comprende N-(2(R)-hidroxi-1(S)-indanil)-2(R)-fenilmetil-4(S)-hidroxi-5-(1-(4-(2-benzo[b]furanilmetil)-2(S)-N'-(t-butil-(t-butil-carboxamido)-piperazinil))-pentanoamida y uno o más agentes antirretrovirales tales como indinavir. WO 97/01349 describe un método para mejorar la farmacocinética de un fármaco que es metabolizado por la monooxigenasa del citocromo P450 en donde dicho método comprende administrar a un paciente una composición que comprende una combinación de dicho fármaco con ritonavir. WO 95/10281 describe una combinación de un inhibidor seleccionado de proteasa, L-735.524 en combinación con cimetidina o ketoconazol. Sadler et al. (AIDS), 2001, 15(8), 1009-1018) evaluaron la farmacocinética y la seguridad de amprenavir y ritonavir después de co-administración en dosis múltiples a individuos voluntarios sanos. Tanaka et al. (J. Clin. Pharmacy Therap., 1998, 23, 403-416) describen algunos fármacos de la proteasa de HIV cuyo metabolismo puede ser dependiente de isoformas del citocromo P450. Hsu et al. (Clin Pharmacokinet, 1998, 35-275-291) describen la farmacocinética de Ritonavir, incluyendo el impacto sobre las isoenzimas del citocromo P450.
WO 99/67254 describe inhibidores de proteasas retrovirales resistentes a multifármacos.
Es un objeto de la presente invención proporcionar combinaciones mejoradas de inhibidores de la proteasa de HIV que contienen hexahidrofuro[2,3-b]furanilo con inhibidores del citocromo P450. Es otro objeto proporcionar una combinación de inhibidores de la proteasa de HIV que contienen hexahidrofuro[2,3-b]furanilo en los cuales se observa un efecto sinérgico adicional de dichos inhibidores después de la administración de dicha composición a un paciente que se encuentra en necesidad de ello.
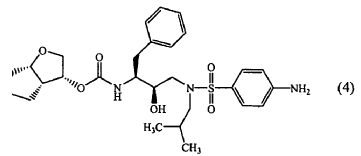
Se ha encontrado que la composición de (a) inhibidores de la proteasa de HIV de fórmula (4) o una sal farmacéuticamente aceptable de los mismos y (b) ritonavir o una sal farmacéuticamente aceptable del mismo, tenían un efecto reductor de la dosis sobre la dosis terapéuticamente eficaz del inhibidor de la proteasa de HIV de fórmula (4).
La presente invención se refiere también al uso de dicha combinación como medicamento para el tratamiento, la prevención o para combatir la infección retroviral. La presente invención se refiere adicionalmente al uso de dicha combinación en la fabricación de un medicamento para el tratamiento, la prevención o para combatir la infección retroviral y en un método de tratamiento de la infección retroviral. La presente invención se refiere también al uso de dicha combinación en ensayos de alta capacidad de analitos diana tales como, por ejemplo, ensayos de monitorización de la resistencia fenotípica.
Como se utiliza en esta memoria, el término "composición" tiene por objeto abarcar un producto que comprende los ingredientes especificados, así como cualquier producto que resulte, directa o indirectamente, de la combinación de los ingredientes especificados.
Siempre que se utiliza el término "sustituido" en la definición del inhibidor de la proteasa de HIV de fórmula (4), debe entenderse que indica que uno o más hidrógenos en el átomo indicado en la expresión que utiliza "sustituido" está(n) reemplazado(s) con una selección del grupo indicado, con la condición de que no se sobrepase la valencia normal del átomo indicado, y que la sustitución da como resultado un compuesto químicamente estable, es decir un compuesto que es suficientemente resistente para sobrevivir al aislamiento en un grado de pureza útil a partir de una mezcla de reacción, y la formulación en un agente terapéutico.
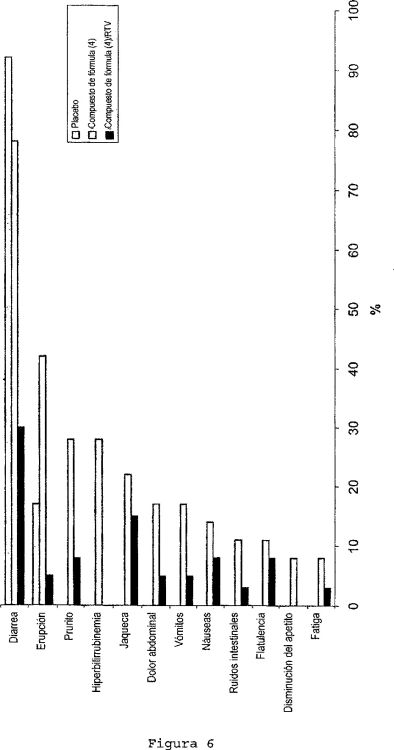
En general, las combinaciones de dos compuestos pueden actuar sinérgicamente, de manera aditiva o de modo antagonista. La sinergia entre los dos inhibidores significaría una terapia de combinación más potente, sin aumentar los efectos secundarios indeseables. Para la presente invención, esto se evaluó en un escenario experimental en el cual se mide la potencia de diferentes relaciones de los dos inhibidores de la proteasa de HIV. Los resultados se representaron gráficamente en un gráfico de isobolograma...
Reivindicaciones:
1. Combinación que comprende (a) un inhibidor de la proteasa de HIV de fórmula (4)
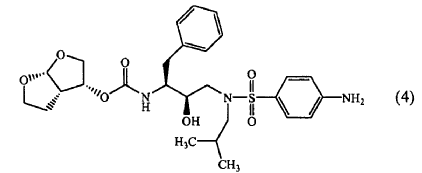
o una sal farmacéuticamente aceptable del mismo y (b) ritonavir o una sal farmacéuticamente aceptable del mismo.
2. Combinación de acuerdo con la reivindicación 1 en donde los componentes comprendidos en dicha combinación deben administrarse juntos o por separado.
3. Combinación de acuerdo con la reivindicación 1 ó 2, en donde la relación en peso del inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 40:1 a 1:15.
4. Combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en donde la relación en peso del inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 30:1 a 1:15.
5. Combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en donde la relación en peso del inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 10:1 a 1:10.
6. Combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la relación en peso del inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 8:1 a 1:8.
7. Combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en donde la relación en peso del inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 6:1 a 1:6.
8. Combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en la cual la cantidad en peso de inhibidor de la proteasa de HIV de fórmula (4) es igual a o mayor que la de ritonavir.
9. Combinación de acuerdo con la reivindicación 8, en donde la relación en peso de inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 1:1 a 15:1.
10. Combinación de acuerdo con la reivindicación 8 ó 9, en donde la relación en peso de inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 1:1 a 8:1.
11. Combinación de acuerdo con una cualquiera de las reivindicaciones 8 a 10, en donde la relación en peso de inhibidor de la proteasa de HIV de fórmula (4) a ritonavir está comprendida en el intervalo de 1:1 a 6:1.
12. Combinación de acuerdo con la reivindicación 1 ó 2, en donde los componentes comprendidos en dicha combinación deben co-administrarse b.i.d., en donde la cantidad del compuesto de fórmula (4) por dosis es de 50 a 1500 mg y la cantidad de ritonavir por dosis es de 50 a 1500 mg de ritonavir.
13. Combinación de acuerdo con la reivindicación 12, en donde la cantidad del compuesto de fórmula (4) por dosis es de 100 a 1000 mg y la cantidad de ritonavir por dosis es de 100 a 800 mg.
14. Combinación de acuerdo con la reivindicación 12, en donde la cantidad del compuesto de fórmula (4) por dosis es de 150 a 800 mg y la cantidad de ritonavir por dosis es de 100 a 600 mg.
15. Combinación de acuerdo con la reivindicación 12, en la cual la cantidad del compuesto de fórmula (4) por dosis es de 200 a 600 mg y la cantidad de ritonavir por dosis es de 20 a 300 mg.
16. Combinación de acuerdo con la reivindicación 1 ó 2, en donde los componentes contenidos en dicha combinación deben co-administrarse b.i.d., en donde la cantidad del compuesto de fórmula (4) por dosis es 600 mg y la cantidad de ritonavir por dosis es 100 mg de ritonavir.
17. Combinación de acuerdo con la reivindicación 1 ó 2, en donde los componentes contenidos en dicha combinación deben ser co-administrados una sola vez al día, en donde la cantidad del compuesto de fórmula (4) por dosis es de 50 a 1500 mg y la cantidad de ritonavir por dosis es 50 a 1500 mg de ritonavir.
18. Combinación de acuerdo con la reivindicación 17, en donde la cantidad del compuesto de fórmula (4) por dosis es de 100 a 1000 mg y la cantidad de ritonavir por dosis es de 100 a 800 mg.
19. Combinación de acuerdo con la reivindicación 17, en donde la cantidad del compuesto de fórmula (4) por dosis es de 150 a 800 mg y la cantidad de ritonavir por dosis es de 100 a 600 mg.
20. Combinación de acuerdo con la reivindicación 17, en donde la cantidad del compuesto de fórmula (4) por dosis es de 200 a 600 mg y la cantidad de ritonavir por dosis es de 20 a 200 mg.
21. Composición farmacéutica que comprende una cantidad terapéutica de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 y un excipiente farmacéuticamente aceptable.
22. Kit que contiene (a) una composición farmacéutica que comprende una cantidad terapéutica de un inhibidor de la proteasa de HIV de fórmula (4)
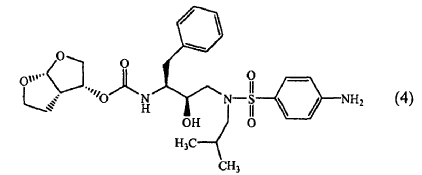
o una sal farmacéuticamente aceptable del mismo, y (b) ritonavir o una sal farmacéuticamente aceptable del mismo, como preparación combinada para uso simultáneo, separado o secuencial en terapia del HIV.
23. Una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 para uso como medicamento.
24. Uso de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 en la fabricación de un medicamento para tratar, prevenir o combatir una infección o enfermedad asociada con una infección de retrovirus en un mamífero.
25. Uso de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 en la fabricación de un medicamento para tratar o combatir la infección o enfermedad asociada con una infección de retrovirus en un mamífero.
26. Uso de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 en la fabricación de un medicamento para inhibir una proteasa de un retrovirus en un mamífero infectado con dicho retrovirus.
27. Uso de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 en la fabricación de un medicamento para inhibición de la replicación retrovírica.
28. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 27, en donde el retrovirus es un virus de la inmunodeficiencia humana (HIV).
29. Uso de acuerdo con una cualquiera de las reivindicaciones 24 a 28, en donde el retrovirus es un retrovirus resistente a multifármacos.
30. Uso de una combinación de acuerdo con una cualquiera de las reivindicaciones 1 a 20 para mejora de la farmacocinética de un compuesto de fórmula (4) con relación a la farmacocinética cuando se administra un compuesto de fórmula (4) aisladamente, en la fabricación de un medicamento para la inhibición de proteasas virales.
31. Uso de una combinación de acuerdo con cualquiera de las reivindicaciones 1 a 20 en la fabricación de un medicamento para el tratamiento o la prevención de HIV o condiciones afines a HIV que comprenden SIDA en un humano, caracterizado porque dicha combinación es útil para mejorar las variables farmacocinéticas de un compuesto de fórmula (4) con relación a las variables farmacocinéticas cuando un compuesto de fórmula (4) se administra solo.
32. Uso de una combinación de acuerdo con la reivindicación 30, en donde la cantidad de ritonavir o una sal farmacéuticamente aceptable del mismo es suficiente para aumentar al menos una de las variables farmacocinéticas seleccionadas de Cmin, Cmax, AUC a las 12 horas, con relación a las variables farmacocinéticas cuando un compuesto de fórmula (4) se administra solo.
33. Uso de una combinación de acuerdo con la reivindicación 30 en donde la cantidad de ritonavir o una sal farmacéuticamente aceptable del mismo es suficiente para aumentar al menos una de las variables farmacocinéticas de un compuesto de fórmula (4) seleccionadas de Cmin, Cmax, Css,av, AUC a las 12 horas, o AUC a las 24 horas, con relación a dicha al menos una variable farmacocinética cuando un compuesto de fórmula (4) se administra solo.
Patentes similares o relacionadas:
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Compuestos de piridina heterocíclicos de cinco miembros y método de preparación y uso de los mismos, del 3 de Junio de 2020, de SHANGHAI INSTITUTE OF MATERIA MEDICA, CHINESE ACADEMY OF SCIENCES: Un compuesto de piridina fusionado con heterociclo de 5 miembros que tiene una estructura de Fórmula (II), sales farmacéuticamente aceptables o solvatos […]
COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE LA COMBINACIÓN DE UN INHIBIDOR SELECTIVO DE LA CICLOOXIGENASA 2 Y UN CARBAMATO DERIVADO DE LA GUAIFENESINA PARA EL TRATAMIENTO DEL DOLOR, INFLAMACIÓN Y CONTRACTURA MUSCULAR, del 14 de Mayo de 2020, de AMEZCUA AMEZCUA, Federico: La presente invención se refiere a una composición farmacéutica que comprende la combinación sinérgica de un inhibidor selectivo de la ciclooxigenasa ll, como […]
Composiciones y métodos para el tratamiento de enfermedades neurodegenerativas y otras enfermedades, del 11 de Septiembre de 2019, de Glialogix, Inc: Una composición farmacéutica que comprende sulfasalazina y un excipiente farmacéuticamente aceptable, en la que la sulfasalazina está en una forma esencialmente […]
Activador de las placas de Peyer, del 31 de Julio de 2019, de Mitsui Sugar Co., Ltd. (100.0%): Un polisacárido obtenido de caña de azúcar que es adecuado para activar las placas de Peyer, en el que el polisacárido contiene α-glucano como componente […]
Composiciones nootrópicas para mejorar el rendimiento de la memoria, del 22 de Abril de 2019, de Pharnext: El uso no terapéutico de una combinación de al menos dos compuestos seleccionados de baclofeno, acamprosato, cinacalcet, mexiletina, sulfisoxazol, y torasemida o sal(es) de […]
FORMULACIÓN QUE INCLUYE COMPLEJOS SUPRAMOLECULARES ESTABLES, del 21 de Marzo de 2019, de PRODUCTOS MAVER, S.A. DE C.V: La presente invención se refiere a una composición farmacéutica para el tratamiento del dolor, caracterizada porque comprende un complejo supramolecular de meglumina, un […]
Marcadores predictivos para terapias de cáncer con inhibidores de poliaminas, del 4 de Febrero de 2019, de Arizona Board of Regents on Behalf of University of Arizona: Una composicion que comprende un inhibidor de la ornitina decarboxilasa (ODC), para su uso en el tratamiento preventivo o curativo de cancer en un paciente, […]