Terapia génica de porfobilinógeno deaminasa.
Uso de un virión de parvovirus que comprende:
a) un constructo de ácidos nucleicos que comprende:
i) una secuencia de nucleótidos que codifica una porfobilinógeno deaminasa humana y que tiene la secuencia de nucleótidos de la SEC ID nº: 1; y,
ii) un promotor AAT combinado con el elemento potenciador del gen de albúmina de ratón (Ealb); y, iii) ITRs de AAV de serotipo 2; y,
b) proteínas de la cápside de AAV de serotipo 5;
para la producción de un medicamento para el tratamiento de una afección provocada por una deficiencia de porfobilinógeno deaminasa.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2009/050584.
Solicitante: UniQure IP B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: Meibergdreef 61 1105 BA Amsterdam PAISES BAJOS.
Inventor/es: PETRY, HARALD, DR., GONZALEZ ASEGUINOLAZA,GLORIA, VAN DEVENTER,SANDER,JAN,HENDRIK, PRIETO VALTUEÑA,JESUS MARIA, RODRIGUEZ PENA,MARIA SOL, TWISK,JAAP, FONTANELLAS ROMÁ,ANTONIO, PAÑEDA RODRÍGUEZ,MARÍA ASTRID.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/864 C12N 15/00 […] › Vectores parvovirales.
- C12N9/88 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Liasas (4.).
PDF original: ES-2507540_T3.pdf


Fragmento de la descripción:
Terapia génica de porfobilinógeno deaminasa Campo de la invención [0001] La presente invención se refiere a viriones de parvovirus que comprenden una secuencia de nucleótidos que codifica porfobilinógeno deaminasa humana o un constructo de ácidos nucleicos que alberga tal secuencia. La presente invención se refiere además a métodos para su uso en el tratamiento y prevención de enfermedades provocadas por la deficiencia de porfobilinógeno deaminasa. Más específicamente, los vectores de terapia génica de la invención se pueden utilizar en métodos para paliar los síntomas de tales enfermedades, incluyendo la porfiria aguda intermitente.
Antecedentes de la invención
La porfiria aguda intermitente (PAI) es una enfermedad metabólica heredada caracterizada por una deficiencia de porfobilinógeno deaminasa (PBGD) , la tercera enzima de la vía de síntesis del hemo. La actividad enzimática es ~50 % de la normal en aquellos que heredan el rasgo genético. La enfermedad se hereda de manera autosómica dominante y es la más común de las porfirias agudas. Aunque ésta ocurre en todas las razas es predominante en el norte de Europa, principalmente en Suecia, Gran Bretaña e Irlanda. En EE.UU. y otros países, la prevalencia estimada es 5/100.000 y en el norte de Suecia llega a ser 60-100/100.000. Se han descrito más de 225 mutaciones en el gen de PBGD hasta la fecha. La característica clínica dominante es un ataque intermitente agudo debido a una disfunción del sistema nervioso, incluyendo dolor abdominal y trastornos neuroviscerales y circulatorios. Se ha informado de dolor abdominal en el 85-95 % de los casos y es la característica más común, seguido de o asociado a los cambios neurológicos. Puede ocurrir la progresión hacia parálisis respiratoria y bulbar y muerte si la PAI no es reconocida y no se retiran fármacos nocivos, tales como fármacos metabolizados por las enzimas hepáticas del citocromo P450, que pueden precipitar un ataque. Puede ocurrir también muerte súbita como resultado de una arritmia cardiaca. A veces se da también cáncer primario de hígado y deterioro de la función renal.
Una deficiencia heredada de PBGD no es suficiente para que aparezcan los síntomas. Una proporción alta de sujetos que heredan una mutación PBGD nunca desarrollan síntomas porfíricos, es decir, hay una penetrancia clínica muy baja. Los síntomas clínicos en portadores de PAI se asocian con la producción y excreción aumentadas de los precursores de porfirina ácido delta-aminolevulínico (ALA) y porfobilinógeno (PBG) como resultado de la demanda aumentada de síntesis del hemo debido a un fármaco u otros factores desencadenantes que provocan el ataque agudo. En estas condiciones la deficiencia de PBGD limita la síntesis del hemo y como resultado se deteriora la represión de ALA sintasa (ALAS1) mediada por el hemo. Hay evidencia indicando que el hígado es la fuente principal del exceso de precursores de porfirina. Estos compuestos permanecen elevados entre ataques en aquellos sujetos propensos a crisis porfíricas repetidas y aumentan más durante las crisis. Pueden reducirse hasta niveles normales si la enfermedad permanece inactiva durante un largo periodo de tiempo.
Los ataques agudos ocurren normalmente después de la pubertad y pueden ser inducidos en individuos latentes por factores endocrinos y hormonas esteroideas, y una variedad de factores medioambientales incluyendo fármacos, factores nutricionales, ingesta calórica y de carbohidratos restringida, tabaco, hormonas esteroideas y anticonceptivos orales, envenenamiento por plomo, infecciones intercurrentes, cirugía y estrés psicológico. Los fármacos están entre los factores más importantes que precipitan los ataques agudos y una lista de fármacos seguros está disponible en www.drugsporphyria.com. Tabaco, etanol y fármacos metabolizados por CYP450, incrementan enormemente la demanda del hemo hepático y suponen la inducción de ALAS1, la cual aumenta la producción de precursores de porfirina y precipita un ataque agudo. Además, ALAS1 está regulada positivamente por el coactivador 1α del receptor γ activado por el proliferador de peroxisomas (PGC1α) , que se induce en el hígado en ayunas. Entre los factores de precipitación las hormonas esteroideas parecen jugar un papel importante. Este concepto es apoyado por el hecho de que la enfermedad raramente se manifiesta antes de la pubertad y que los anticonceptivos orales pueden exacerbar los ataques en algunas mujeres con deficiencia de PBGD. Además, las mujeres (80%) son afectadas más frecuentemente que los hombres (20%) .
Los ataques agudos se tratan con infusiones de glucosa y hemina (Normosang, Orphan Europe) . La glucosa parece oponerse a la inducción de ALAS1 mediada por PGC-1α. La hemina restaura la reserva del hemo regulador y suprime la inducción hepática de ALAS1.
Algunas mujeres desarrollan ataques premenstruales que se pueden prevenir mediante análogos de hormona liberadora de gonadotropina (GnRH) . Algunos pacientes exhiben ataques agudos recurrentes y una disfunción neurológica discapacitante significativa. El daño neurológico avanzado y los síntomas crónicos y subagudos son insensibles a la terapia con hemo. Esta es una afección potencialmente mortal que puede ser curada solo por trasplante alogénico de hígado que, en tres pacientes hasta la fecha, previene la acumulación de ALA y PBG neurotóxicas.
[0006]. Sin embargo el trasplante de hígado tiene disponibilidad limitada de donantes compatibles, y una morbidez y mortalidad significativas.
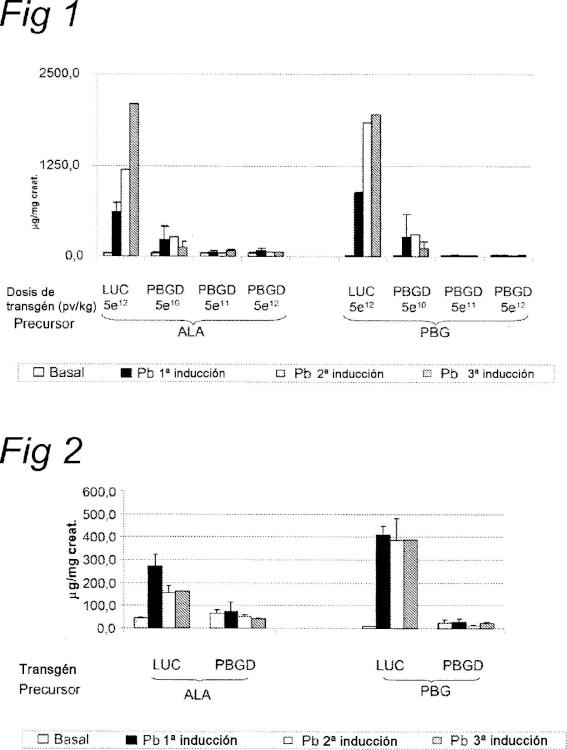
Así, la terapia de sustitución de genes es una alternativa potencial al trasplante de hígado en estos pacientes donde la función del hígado es completamente normal salvo por la deficiencia de PBGD. La terapia génica es un procedimiento que consiste en la introducción de un gen específico en las células para controlar la enfermedad a través del uso de vectores. La viabilidad de las terapias de entrega de genes con el objetivo de corregir el déficit de enzima hepática se explora en modelos experimentales de PAI (ratones PAI) . La transferencia de genes mediada por vectores adenovirales de PBGD a ratones porfíricos mostró eficacia terapéutica a corto plazo como resultado de la expresión hepática transitoria de PBGD (Johansson, 2004, Mol. Ther. 10 (2) :337-43) . Estos resultados establecieron un estudio demostrativo preliminar, que demuestra que la entrega del gen PBGD mediada por vector vírico puede mejorar transitoriamente las manifestaciones severas de ataques porfíricos inducidos por fenobarbital en ratones PAI.
EP 1 049 487 describe sólo a un nivel conceptual la construcción de vectores rAAV que contienen un ADNc humano de PBGD.
No obstante, hay todavía una necesidad en la técnica, de vectores mejorados y protocolos para entrega de hPBGD mediada por AAV a sujetos con necesidad de ella.
Resumen de la invención
Según la invención, se proporciona un virión de parvovirus que comprende: a) un constructo de ácidos nucleicos que comprende: i) una secuencia de nucleótidos, es decir, un ácido nucleico o polinucleótido, que codifica una porfobilinógeno deaminasa (PBGD) humana y que tiene la secuencia de nucleótidos de la SEC ID nº : 1; y, ii) un promotor AAT combinado con el elemento potenciador del gen de albúmina de ratón (Ealb) ; y, iii) proteínas de la cápside de AAV de serotipo 5.
Preferiblemente, en el constructo de ácidos nucleicos, la secuencia de nucleótidos que codifica la porfobilinógeno deaminasa humana está operativamente enlazada al promotor.
Preferiblemente, el virión de parvovirus es un vector vírico adeno-asociado (AAV) .
La presente invención se refiere a estos viriones de parvovirus para usar como medicamento, y para usar en el tratamiento de una afección provocada por una deficiencia en la porfobilinógeno deaminasa, donde, preferiblemente la afección es porfiria aguda intermitente (PAI) .
La invención también se refiere al uso de un virión de parvovirus de la invención para usar en la producción de un medicamento para utilizarlo en el tratamiento de una afección provocada por una deficiencia en la porfobilinógeno deaminasa.
Descripción de la invención Definiciones [0015] Un "ácido nucleico" incluye cualquier molécula compuesta por o que comprende nucleótidos monoméricos. El término "secuencia de nucleótidos" se puede utilizar de forma intercambiable con "ácido nucleico" en este documento. Un ácido nucleico puede ser un oligonucleótido o un polinucleótido. Un ácido nucleico puede ser un ADN o un ARN. Un ácido nucleico puede ser químicamente modificado o artificial. Ã?cidos nucleicos... [Seguir leyendo]
Reivindicaciones:
1. Uso de un virión de parvovirus que comprende:
a) un constructo de ácidos nucleicos que comprende:
i) una secuencia de nucleótidos que codifica una porfobilinógeno deaminasa humana y que tiene la secuencia de nucleótidos de la SEC ID nº : 1; y, ii) un promotor AAT combinado con el elemento potenciador del gen de albúmina de ratón (Ealb) ; y,
iii) ITRs de AAV de serotipo 2; y,
b) proteínas de la cápside de AAV de serotipo 5;
para la producción de un medicamento para el tratamiento de una afección provocada por una deficiencia de 15 porfobilinógeno deaminasa.
2. Uso según la reivindicación 1, donde el promotor tiene la secuencia de la SEC ID nº : 5.
3. Uso según la reivindicación 1 o reivindicación 2, donde la condición es porfiria aguda intermitente. 20
4. Virión de parvovirus que comprende: a) un constructo de ácidos nucleicos que comprende: 25 i) una secuencia de nucleótidos que codifica una porfobilinógeno deaminasa humana y que tiene la secuencia de nucleótidos de la SEC ID nº : 1; y, ii) un promotor AAT combinado con el elemento potenciador del gen de albúmina de ratón (Ealb) ; y, iii) ITRs de AAV de serotipo 2; y,
b) proteínas de la cápside de AAV de serotipo 5; para usar en el tratamiento de una afección provocada por una deficiencia de porfobilinógeno deaminasa.
5. Un virión de parvovirus para usar según la reivindicación 4, donde el promotor tiene la secuencia de la SEC ID nº :
5.
6. Un virión de parvovirus para usar según la reivindicación 4 o reivindicación 5, donde la afección es porfiria aguda intermitente.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]