PROCEDIMIENTO PARA LA PREPARACIÓN DE GUGGULSTERONAS Y GUGGULSTEROL.
Un procedimiento par a la preparación de 4,17(20)-Z-pregnadieno-3,
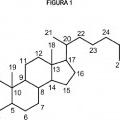
16-diona de la fórmula ( IV) siguiente, que comprende la oxidación del compuesto de la fórmula (II) siguiente, para proporcionar 4,17(20)-E-pregnadieno-3,16diona de la fórmula (III) siguiente, y la consecución de la 4,17(20)-E-pregnadieno-3,16-diona de la fórmula (III) resultante con una cualquiera de las reacciones seleccionadas entre el grupo que consiste en la reacción fotoquímica, la reacción termoquímica, y la reacción catalizada por ácido. En la que X representa un grupo hidroxilo (-OH) o un grupo oxo (=O), y una línea de puntos indica la presencia de un doble enlace en la posición C-4 o C-5.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2004/000950.
Solicitante: SEOUL NATIONAL UNIVERSITY INDUSTRY FOUNDATION.
Nacionalidad solicitante: República de Corea.
Dirección: SAN 4-2, BONGCHEON-DONG, GWANK-GU SEOUL 151-818 REPUBLICA DE COREA.
Inventor/es: KANG,HEONJOONG, HAM,JUNGYEOB, CHIN,Jungwook.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J13/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno, teniendo un enlace doble carbono-carbono a partir de o hacia la posición 17.
PDF original: ES-2376549_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de guggulsteronas y guggulsterol.
Campo de la invención
La presente invención se refiere a un procedimiento para la preparación de 4, 17 (20) -pregnadieno-3, 16-diona (deno
minada en la presente invención en adelante como "guggulsterona") que tiene un efecto de reducción de la lipoproteina de baja densidad (LDL) elevada y altos niveles del colesterol de manera eficaz, y de elevación de los bajos niveles de lipoproteina de alta densidad (HDL) , un procedimiento para la preparación del isómero tipo Z de la guggulsterona a partir del tipo E, y un procedimiento para la preparación del compuesto de la fórmula (11) , el compuesto intermedio del compuesto (111) anterior.
10 Antecedentes de la invención
La guggulsterona ha sido extraida a partir del árbol guggul de la 1ndia (nombre botánico: Commiphora mukul) , y usada tradicionalmente para la curación de la hiperlipidemina, e igualmente es conocida como un antagonista eficaz para el receptor orfano farnesoide (FXR) , el cual regula el metabolismo del colesterol (Nature, pág. 411, Junio, (2002) ; Science, pág. 1703, Mayo, (2002) ) . De manera convencional, el tipo E o el tipo Z de la guggulsterona se han usado como un fármaco hipolipidémico, y se le ha obtenido mediante la extracción de la resina del árbol guggul, y, en los casos necesarios, mediante la purificación adicional de la misma usando HPLC, etc. En la Patente EP 0 447 706 A1 se divulga un procedimiento de sintesis de mezcla de guggulsterona. Tal como se muestra en el esquema siguiente, los grupos cetona y acetato del acetato de 16-deshidropregnalona (1) se redujeron con hidruro de aluminio y litio (LiAlH4) proporcionando 5, 16-pregnanodieno-3º, 20 diol (2) , el cual reaccionó con anhidrido acético y ácido p
toluenosulfónico, para proporcionar la mezcla de 5, 17 (20) -trans-pregnadieno-3º, 16º-diacetato y 5, 17 (20) -transpregnadien-3º, 16a-diacetato (3) . La mezcla resultante se hizo reaccionar con hidróxido potásico en metanol, proporcionando la mezcla de 5, 17 (20) -trans-pregnadieno-3º, 16º-diol y 5, 17 (20) -trans-pregnadien-3º, 16a-diol (4) , la cual se oxidó con isobutóxido de aluminio o fenóxido de aluminio, proporcionando, de esta forma, la mezcla estereoisómera (Z:E: 8:2, aproximadamente) de guggulsteronas.
Aunque el compuesto (5) anterior del procedimiento en la Patente EP 0 447 706 A1 se sabe que tiene una buena eficacia, el procedimiento de fabricación del mismo no es satisfactorio, no siendo, por ello, eficaz en cuanto a costes. Es decir, 1) El material de partida, 16-deshidropregnalona no es un esteroide comúnmente disponible, y por tanto no 30 es adecuado para ser aplicado a la industria.
2) Cuando el hidruro de aluminio y litio (LiAlH4) usado en la primera etapa de reducción se expone a la humedad, se genera gas hidrógeno, lo cual puede conducir a una posibilidad de explosión, siendo, por ello, muy peligroso adoptarlo en una escala industrial.
3) Es dificil desprenderse del ácido acético que ha sido usado como un disolvente en la segunda reacción 35 después de completarse la reacción, e igualmente el tiempo de reacción de 72 horas es demasiado largo.
4) En la tercera etapa de reacción, el tiempo de reacción para mantener a reflujo el metanol con hidróxido potásico durante 6 horas es comparativamente largo.
5) El rendimiento de la tercera etapa parece ser del 114%, pero no se describe el rendimiento del producto final, guggulsterona, en la memoria descriptiva de la patente.
6) El procedimiento de la sintesis descrito en la patente anterior no es fiable, puesto que los datos de análisis de la guggulsterona y del compuesto intermedio de la misma no se describen en la memoria descriptiva de la patente.
De acuerdo con el procedimiento divulgado en J. Org. Chem., vol. 29, pág. 1142, (1964) , se hizo reaccionar 16a, 17a-epoxipregnenolona con hidracina con 85% de pureza a 190º C durante 5, 5 horas con el fin de sintetizar el com
puesto intermedio diol, el cual fue una mezcla de trans y cis. Puesto que el rendimiento del compuesto diol fue del 21, 7%, es imposible preparar el producto final, guggulsterona, en una escala industrial.
Más aún, el procedimiento divulgado en J. Org. Chem., vol. 29, pág. 1142, (1964) , tiene los problemas siguientes.
1) Puesto que el rendimiento del compuesto (8a) diolresultante es del 21, 7%, no es adecuado paraser aplicado en la industria.
2) El compuesto (8a) diol resultante se obtiene como una mezcla, la cual no tiene actividad óptica, de manera que es necesario aislarla adicionalmente. Y, el producto final tiene baja eficacia como medicina o alimento.
Bajo estas circunstancias, se ha demanda en la técnica un nuevo procedimiento para la preparación de guggulsterona tipo E o tipo Z individual con facilidad y bajo coste.
20 Sumario de la invención
El objeto de la presente invención es proporcionar un procedimiento económico para la preparación de guggulterol, guggulsterona (111) tipo E individual, y guggulsterona (1V) tipo Z individual con un alto rendimiento, y en un tiempo de reacción corto a partir de un material de partida, el cual esté fácilmente disponible a bajo precio.
Bajo las circunstancias anteriores, los autores de la presente invención han llevado a cabo una extensa investigación 25 sobre la sintesis de guggulsterona.
Como un resultado de ello, los presentes autores han encontrado procedimientos eficaces para la preparación del compuesto representado por la fórmula siguiente (11) a partir de un esteroide conocido representado por la fórmula (1) siguiente, y sintesis de las guggulsteronas representadas por las fórmulas (111) y (1V) siguientesde manera fácil y económica.
En la que A representa un grupo hidroxilo (-OH) o un gr upo oxo (=O) ; B representa un grupo hidroxilo (-OH) , un grupo oxo (=O) o un grupo metil cetona (-C (O) CH3) ; X representa un grupo hidroxilo (-OH) o un grupo oxo (=O) ; n es un número de átomo de oxigeno, 0 ó 1; y una linea de puntos indica la presencia de un doble enlace en la posición C-4 (referida en la presente invención en adelante como "/4") o C-5 (referida en la presente invención en adelante como "/5") .
Descripción de la realización preferida El compuesto de la fórmula (111) , un objeto de la presente invención, puede obtenerse mediante la oxidación del compuesto de la fórmula (11) y el compuesto de la fórmula (1V) puede obtenerse mediante la isomerización del compuesto de la fórmula (111) . El procedimiento anterior de preparación se explicará, después de explicar un procedimiento para la preparación del compuesto de la fórmula (11) a partir del compuesto de la fórmula (1) como un material de partida.
I. Síntesis del compuesto de fórmula (II) :
I.1. Síntesis del compuesto de la fórmula (II-A) a partir de 4-androsten-3, 17-diona (I-A) de la fórmula (I) en la 5 que AyB respectivamente representan un grupooxo (=O) , n es0, y 14:
El compuesto de fórmula (1-A) se trató con 1, 2-etanoditiol para la protección del grupo cetona únicamente en la posición C-3 para proporcionar el compuesto de la fórmula (1-A-1) , el cual se sometió a la reacción de Witttig sobre el grupo cetona en la posición C-17, para proporcionar el compuesto de la fórmula (1-A-2) . El compuesto de la fórmula (1-A-3) se obtuvo mediante la eliminación del grupo de protección del grupo cetona en la posición C-3 del compuesto anterior de la fórmula (1-A-2) . El compuesto de la fórmula (1-A-3) se oxidó mediante la reacción con dióxido de selenio (SeO2) , con el fin de introducir el grupo alcohol en la posición C-16, proporcionando, de esta forma, el guggulsterol representado mediante el compuesto de la fórmula (11-A) .
Esquema (1)
15 [Etapa A] Preparación del compuesto de la fórmula (I-A-1) :
El compuesto de la fórmula (1-A-1) puede obtenerse mediante la reacción del compuesto de la fórmula (1-A) con alcanoditiol en un disolvente en presencia de un catalizador ácido.
Como los disolventes usables en esta reacción, pueden mencionarse diclorometano, cloroformo, 1, 2-dicloroetano, éter dietilico, acetonitrilo, tetrahidrofurano, tolueno, yácido acético glacial. Estos disolventes pueden usarse o bien individualmente o bien como una combinación de dos o más. Entre ellos, son particularmente preferidos el diclorometano y el ácido acético glacial.
Reivindicaciones:
1. Un procedimiento para la preparación de 4, 17 (20) -Z-pregnadieno-3, 16-diona dela fórmula (1V) siguiente, que comprende la oxidación del compuesto de la fórmula (11) siguiente, para proporcionar 4, 17 (20) -E-pregnadieno-3, 16diona de la fórmula (111) siguiente, y la consecución de la 4, 17 (20) -E-pregnadieno-3, 16-diona de la fórmula (111) resultante con una cualquiera de las reacciones seleccionadas entre el grupo que consiste en la reacción fotoquimica, la reacción termoquimica, y la reacción catalizada por ácido.
En la que X representa un grupo hidroxilo (-OH) o un grupo oxo (=O) , y una linea de puntos indica la presencia de un doble enlace en la posición C-4 o C-5.
2. Un procedimiento tal como se reivindica en la reivindicación 1, en el que la reacción fotoquimica se lleva a cabo mediante el fotosensibilizador seleccionado entre el grupo que consiste en azul de metileno, verde metileno y Rosa Bengala.
8. 200º C durante 1 hora a 48 horas.
4. Un procedimiento tal como se reivindica en la reivindicación 1, en el que el catalizador ácido es ácido ptoluenosulfónico.
6. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara sometiendo el compuesto de la fórmula (1-B) a la reacción de Wittig para proporcionar el compuesto de la fórmula (1-B-1) , y haciendo reaccionar el compuesto de la fórmula (1-B-1) con dióxido de selenio (SeO2) . 7. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara sometiendo el compuesto de la fórmula (1-B) a la reacción de Wittig para proporcionar el compuesto de la fórmula (1-B-1) , oxidando el compuesto resultante con clorocromato de piridinio (PCC) para proporcionar el compuesto de la fórmula (1-B-2) , haciendo reaccionar el compuesto resultante en la presencia de una base para proporcionar el compuesto de la fórmula (1B-3) , y haciendo reaccionar el producto con dióxido de selenio. 8. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara protegiendo el compuesto de la fórmula (1-C) con 1, 2-etanoditiol en la presencia de un catalizador ácido para proporcionar el compuesto de la fórmula (1-C-1) , haciendo reaccionar el compuesto de la fórmula (1-C-1) con un óxido de cromo para proporcionar el compuesto de la fórmula (1-C-2) , sometiendo el compuesto de la fórmula (1-C-2) a la reacción de Wittig con haluro de etiltrifenil fosfonio en la presencia de una base fuerte para proporcionar el compuesto de la fórmula (1-C-3) , des-protegiendo el grupo cetona del compuesto de la fórmula (1-C-3) para proporcionar el compuesto de la fórmula (1-A 3) , y oxidando el producto con dióxido de selenio. 9. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara haciendo reaccionar el compuesto de la fórmula (1-D) con hidracina en la presencia de una base a alta temperatura. 10. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara reduciendo el compuesto de la fórmula (1-E) para proporcionar el compuesto de la fórmula (1-E-1) , oxidando el compuesto resultante mediante el uso de un reactivo de oxidación selectiva para proporcionar el compuesto de la fórmula (1-E-2) , introduciendo un grupo p-tolueno sulfonilo o grupo metano sulfonilo al compuesto resultante de la fórmula (1-E-2) para proporcionar el compuestode lafórmula (1-E-3) , haciendo reaccionar el producto con una base para proporcionar el compuesto de la fórmula (1-E-4) , y haciendo reaccionar a este con dióxido de selenio. 20 5. El procedimiento de la reivindicación 1, en el que el compuesto de fórmula (11) se prepara protegiendo el compuesto de la fórmula (1-A) con 1, 2-etanoditiol para proporcionar el compuesto de la fórmula (1-A-1) , sometiendo el compuesto resultante de la fórmula (1-A-1) a la reacción de Wittig para proporcionar el compuesto de la fórmula (1-A-2) , eliminando el grupo de protección para proporcionar el compuestode lafórmula (1-A-3) , y haciendo reaccionar el compuesto resultante con dióxido de selenio (SeO2) .
Patentes similares o relacionadas:
Esteroides neuroactivos 19-nor para métodos de tratamiento, del 25 de Marzo de 2020, de Sage Therapeutics, Inc: Un compuesto de Fórmula (Ila): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo; en donde: ----- representa un enlace simple o doble según lo […]
Compuestos anfifílicos con propiedades neuroprotectoras, del 2 de Octubre de 2019, de Ustav Organicke Chemie a Biochemie AV CR, v.v.i: Compuesto anfifílico, seleccionado de: 3-sulfato de piridinio(3R,5R,8S,9S,10 S,13S,14S)-10,13-dimetilhexadecahidro-1H-ciclopenta[a]fenantren-3- […]
Esteroides C21-n-pirazolilo 19-nor C3,3-disustituidos y métodos de uso de los mismos, del 16 de Abril de 2019, de Sage Therapeutics, Inc: Un compuesto de fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo; donde: ----- representa un enlace simple o doble; R1 es alquilo […]
Proceso para la preparación de esteroides 17-sustituidos, del 27 de Julio de 2016, de ZACH SYSTEM: Un proceso para la preparación de abiraterona que comprende: a) realizar la triflación de un compuesto de fórmula**Fórmula** en presencia […]
Proceso para la producción de intermediarios de estetrol, del 6 de Abril de 2016, de Estetra S.P.R.L: Proceso para la preparacion de un compuesto de fórmula **Fórmula** dicho proceso comprendiendo las etapas de: a) reaccionar un compuesto de formula , con […]
 Preparación de un antibiótico cristalino de ácido fusídico, del 4 de Diciembre de 2015, de LEO PHARMA A/S: Ácido fusídico cristalino caracterizado por exhibir un ángulo de reflexión de (2θ) a 22.7 (±0.1) excediendo en 30% con respecto al pico de intensidad […]
Preparación de un antibiótico cristalino de ácido fusídico, del 4 de Diciembre de 2015, de LEO PHARMA A/S: Ácido fusídico cristalino caracterizado por exhibir un ángulo de reflexión de (2θ) a 22.7 (±0.1) excediendo en 30% con respecto al pico de intensidad […]
 Preparación de ácido biliar sintético, del 10 de Noviembre de 2015, de Kythera Biopharmaceuticals, Inc: Un método para preparar ácido desoxicólico (DCA) o una sal farmacéuticamente aceptable del mismo:**Fórmula**
comprendiendo dicho método
(a) hacer reaccionar […]
Preparación de ácido biliar sintético, del 10 de Noviembre de 2015, de Kythera Biopharmaceuticals, Inc: Un método para preparar ácido desoxicólico (DCA) o una sal farmacéuticamente aceptable del mismo:**Fórmula**
comprendiendo dicho método
(a) hacer reaccionar […]
 ESTROGENOS COMO AGENTES ANTIMITOTICOS, del 1 de Abril de 2009, de CHILDREN'S MEDICAL CENTER CORPORATION: Utilización de un producto para la fabricación de un medicamento para inhibir la estimulación excesiva o anormal de células endoteliales en un humano o animal, comprendiendo dicho […]
ESTROGENOS COMO AGENTES ANTIMITOTICOS, del 1 de Abril de 2009, de CHILDREN'S MEDICAL CENTER CORPORATION: Utilización de un producto para la fabricación de un medicamento para inhibir la estimulación excesiva o anormal de células endoteliales en un humano o animal, comprendiendo dicho […]