Polimorfos de darunavir.
Un solvato de alcohol C5 de darunavir.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2009/000724.
Solicitante: Hetero Research Foundation.
Nacionalidad solicitante: India.
Dirección: Plot No. B-80&81 A.P.I.E., Balanagar Hyderabad 500 018, Andhrapradesh INDIA.
Inventor/es: PARTHASARADHI REDDY,BANDI, MURALIDHARA,REDDY,DASARI, RATHNAKAR REDDY,Kura, RAJI REDDY,Rapolu, SUBASH CHANDER REDDY,kesireddy, VAMSI KRISHAN,BANDI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D493/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 493/00 Compuestos heterocíclicos que contienen átomos de oxígeno como únicos heteroátomos del ciclo en el sistema condensado. › Sistemas orto-condensados.
PDF original: ES-2546866_T3.pdf
Fragmento de la descripción:
Polimorfos de darunavir Campo de la invención
La presente invención proporciona nuevas formas solvatadas de darunavir y procesos para su preparación. La presente invención también proporciona un nuevo proceso para la preparación de una forma amorfa del darunavir.
Antecedentes de la invención
Las proteasas codificadas por virus, que son esenciales para la replicación vírica, son necesarias para el procesamiento de los precursores de las proteínas víricas. La interferencia con el procesamiento de los precursores proteicos inhibe la formación de viriones infecciosos. Por consiguiente, los inhibidores de proteasas víricas se pueden usar para prevenir o tratar afecciones víricas crónicas y agudas. El darunavir tiene actividad inhibidora de la proteasa del VIH y es muy adecuado en particular para inhibir los virus VIH-1 y VIH-2. Entre ellos el darunavir, químicamente (1 S,2R,3'R,3'aS,6'aR)-[3'-hexahidrofuro[2,3-b]furanil-[3-(4-aminobencenosulfonil)-isobutilamino]-1 - bencil-2-hidroxipropil]carbamato. El darunavir está representado mediante la siguiente estructura:
**(Ver fórmula)** **(Ver fórmula)**Los procesos para las preparaciones de darunavir ácido se han desvelado en las patentes EP 715618, WO 99/67417, patente de Estados Unidos NQ 6.248.775, y en Bioorganic and Chemistry Letters, Vol. 8, pp. 687-690, 1998, "Potent HIV protease inhibitors incorporating high-affinity P2-igands and (R)-(hydroxyethylamino)sulfonamide isostere", todos ellos incorporados en el presente documento por referencia.
El polimorfismo se define como "la capacidad de una sustancia para existir en dos o más fases cristalinas que tienen una disposición y/o conformaciones diferentes de las moléculas en la red cristalina. Así, en el sentido estricto, los polimorfos son formas cristalinas diferentes de la misma sustancia pura en las que las moléculas tienen disposiciones diferentes y/o configuraciones diferentes de las moléculas". Polimorfos diferentes pueden diferir en sus propiedades físicas tales como el punto de fusión, la solubilidad, los patrones de difracción de rayos X, etc. Aunque estas diferencias desaparecen una vez que se disuelve el compuesto, pueden influir apreciablemente en propiedades farmacéuticamente importantes de la forma sólida, tales como propiedades de manipulación, velocidad de disolución y estabilidad. Dichas propiedades pueden influir significativamente en el procesamiento, vida útil, y aceptación comercial de un polimorfo. Por tanto es importante investigar todas las formas sólidas de un fármaco, incluyendo todas las formas polimórficas, y determinar la estabilidad, disolución y propiedades fluidas de cada forma polimórfica. Las formas polimórficas de un compuesto se pueden distinguir en laboratorio mediante métodos analíticos tales como difracción de rayos X (XRD), calorimetría de barrido diferencial (DSC) y espectrometría de infrarrojos (IR).
El darunavir puede existir en diferentes formas polimórficas, que difieren entre sí en términos de estabilidad, propiedades físicas, datos espectrales y métodos de preparación.
El documento WO 03/106461 desvela una serie de solvatos de darunavir que incluyen el metanolato e isopropanolato.
La solicitud de patente de Estados Unidos NQ 2005/0250845 describe la forma amorfa, la forma A (etanolato), la forma B (hidrato), la forma C (metanolato), la forma D (acetonato), la forma E (diclorometanato), la forma F (solvato de acetato de etilo), la forma G (1-metoxi-2-propanolato), la forma H (anisolato), la forma I (tetrahidrofuranato), la forma J (isopropanolato) y la forma K (mesilato) del darunavir.
Un objetivo de la presente invención es proporcionar nuevas formas solvatadas del darunavir y procesos para su preparación.
Otro objetivo de la presente invención es proporcionar un nuevo proceso para la preparación de una forma amorfa del darunavir.
Sumario de la invención
En un aspecto, la presente invención proporciona el solvato de alcohol Cs de darunavir.
En otro aspecto, la presente invención proporciona un proceso para la preparación del solvato de alcohol Cs de darunavir, que comprende la cristalización del solvato de alcohol Cs de darunavir en una solución de darunavir en disolvente de alcohol Cs.
En otro aspecto, la presente invención proporciona un proceso para la preparación de una forma amorfa de darunavir, que comprende:
a) la disolución del solvato de alcohol Cs de darunavir;
b) la eliminación del disolvente de la solución obtenida en la etapa (a) para obtener un residuo;
c) la suspensión del residuo obtenido en la etapa (b) con un disolvente alifático o un disolvente aromático; y
d) el aislamiento de la forma amorfa de darunavir.
Breve descripción de los dibujos
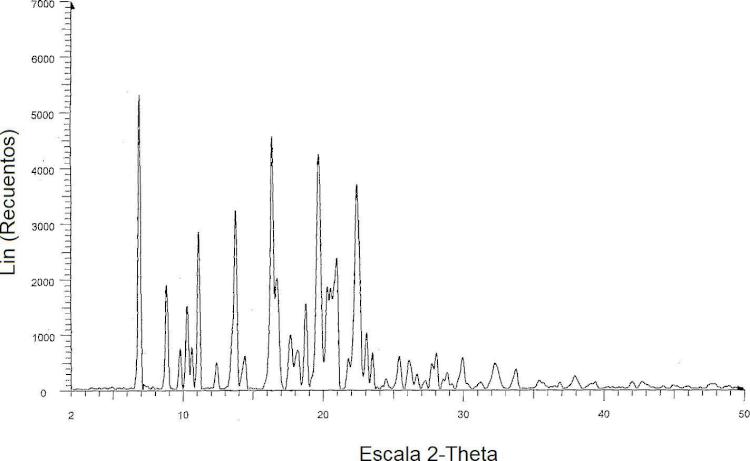
La Figura 1 es un espectro de difracción en polvo de rayos X del solvato de 2-metil-2-butanol de darunavir.
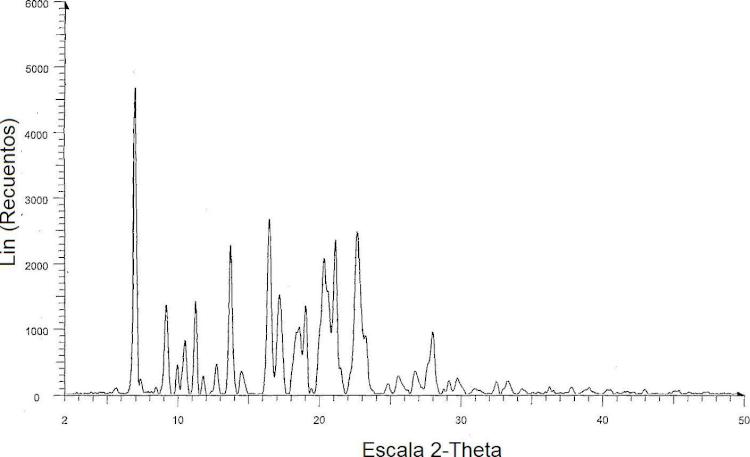
La Figura 2 es un espectro de difracción en polvo de rayos X del solvato de n-pentanol de darunavir.
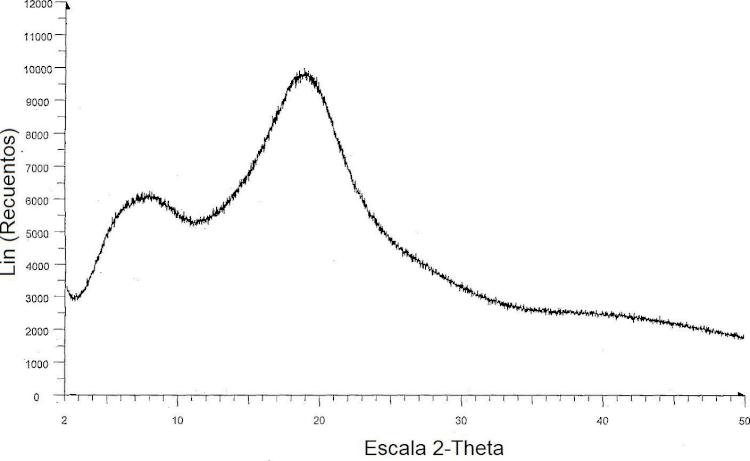
La Figura 3 es un espectro de difracción en polvo de rayos X del de la forma amorfa de darunavir.
El espectro de difracción en polvo de rayos X se midió sobre un difractómetro en polvo de rayos X Bruker axs D8
advance con radiación de cobre-Ka. Se esparció con cuidado 1 g de muestra aproximadamente sobre un soporte de muestra y se sometió a detección de 2 a 50 grados 20, a 0,02 grados a theta por paso y un paso de 10,4 segundos. La muestra se pone simplemente sobre el soporte de muestras. La muestra se hace girar a 30 rpm a una tensión de 40 KV y 35 mA de corriente.
Descripción detallada de la invención
De acuerdo con un aspecto de la presente invención, se proporciona un solvato de alcohol Cs de darunavir.
De acuerdo con otro aspecto de la presente invención, se proporciona un proceso para la preparación de un solvato de alcohol Cs de darunavir, que comprende la cristalización del solvato de alcohol Cs de darunavir en una solución de darunavir en disolvente de alcohol Cs.
Los solvatos se pueden producir a diferentes relaciones de solvatación. La relación de darunavir al disolvente de alcohol Cs-Cs puede oscilar entre 1:0,3 y 1:1,3. En particular, la relación puede oscilar entre 0,5 aproximadamente y 1 molécula aproximadamente de disolvente de alcohol Cs por 1 molécula de darunavir, preferentemente la relación es de 1 molécula de disolvente de alcohol Cs por 1 molécula de darunavir.
El disolvente de alcohol Cs se selecciona entre 2-metil-2-butanol o n-pentanol.
El solvato de 2-metil-2-butanol de darunavir se caracteriza por picos en el espectro de difracción de rayos X de polvo que tiene posiciones del ángulo 20 a 6,8, 8,8, 11,1, 13,7, 16,3, 16,7, 19,6, 20,9 y 22,3 ± 0,2 grados aproximadamente. El difractograma de rayos X en polvo (PXRD) de solvato de 2-metil-2-butanol de darunavir se muestra en la Figura 1.
El solvato de n-pentanol de darunavir se caracteriza por picos en el espectro de difracción de rayos X de polvo que tiene posiciones del ángulo 20 a 6,9, 9,1, 11,2, 13,7, 16,4, 17,1, 20,3, 20,6, 21,1 y 22,6 ± 0,2 grados aproximadamente. El difractograma de rayos X en polvo (PXRD) de solvato de n-pentanol de darunavir se muestra en la Figura 2.
Los solvatos de la presente invención son intermedios útiles para obtener darunavir puro. Los solvatos de darunavir de la presente invención se pueden usar para obtener polimorfos conocidos del darunavir.
De acuerdo con otro aspecto de la presente invención, se proporciona un proceso para la preparación de una forma amorfa del darunavir, que comprende:
a) la disolución del solvato de alcohol C5 de darunavir;
b) la eliminación del disolvente de la solución obtenida en la etapa (a) para obtener un residuo;
c) la suspensión del residuo obtenido en la etapa (b) con un disolvente alifático o un disolvente aromático; y
d) el aislamiento de la forma amorfa de darunavir.
Preferentemente, el darunavir usado en la etapa (a) es solvato de 2-metil-2-butanol o solvato de n-pentanol de darunavir.
El disolvente usado en la etapa (a) puede ser un disolvente o una mezcla de disolventes seleccionado del grupo constituido por diclorometano, dicloruro de etileno, cloroformo y acetato de etilo. El disolvente preferido es diclorometano.
La destilación del disolvente se puede realizar en la etapa (b) a presión atmosférica o a presión reducida. La destilación preferentemente se puede realizar hasta que el disolvente se haya eliminado casi completamente por destilación.
El disolvente alifático o disolvente aromático usado en la etapa (c) puede ser un disolvente o una mezcla de disolventes seleccionado del grupo constituido por ciclohexano, hexano, n-heptano, tolueno... [Seguir leyendo]
Reivindicaciones:
1. Un solvato de alcohol Cs de darunavir.
2. El solvato de acuerdo con la reivindicación 1, en el que la relación de darunavir a disolvente de alcohol Cs oscila entre 1:0,3 y 1:1,3.
3. El solvato de acuerdo con la reivindicación 2, en el que la relación de darunavir a disolvente de alcohol Cs es de 1:1 aproximadamente.
4. El solvato de acuerdo con la reivindicación 1, en el que dicho solvato es un solvato de 2-metil-2-butanol caracterizado por picos en el espectro de difracción de rayos X de polvo que tienen posiciones del ángulo 20 a 6,8, 8,8, 11,1, 13,7, 16,3, 16,7, 19,6, 20,9 y 22,3 ± 0,2 grados aproximadamente.
5. El solvato de acuerdo con la reivindicación 1, en el que dicho solvato es un solvato de n-pentanol de darunavir caracterizado por picos en el espectro de difracción de rayos X de polvo que tienen posiciones del ángulo 20 a 6,9, 9,1, 11,2, 13,7, 16,4, 17,1,20,3, 20,6, 21,1 y 22,6 ± 0,2 grados aproximadamente.
6. Un proceso para la preparación de solvato de alcohol Cs de darunavir como se define en la reivindicación 1, que comprende la cristalización de solvato de alcohol Cs de darunavir a partir de una solución de darunavir en disolvente de alcohol Cs.
7. El proceso de acuerdo con la reivindicación 6, en el que el disolvente de alcohol Cs se selecciona entre 2-metil-2- butanol o n-pentanol.
8. Un proceso para la preparación de una forma amorfa de darunavir, que comprende:
a. la disolución del solvato de alcohol Cs de darunavir en un disolvente;
b. la eliminación del disolvente de la solución obtenida en la etapa (a) para obtener un residuo;
c. la suspensión del residuo obtenido en la etapa (b) con un disolvente alifático o un disolvente aromático; y
d. el aislamiento de la forma amorfa de darunavir.
9. El proceso de acuerdo con la reivindicación 8, en el que el solvato de darunavir usado en la etapa (a) es solvato de 2-metil-2-butanol o solvato de n-pentanol de darunavir.
10. El proceso de acuerdo con la reivindicación 8, en el que el disolvente usado en la etapa (a) es un disolvente o una mezcla de disolventes seleccionados entre diclorometano, dicloruro de etileno, cloroformo y acetato de etilo.
11. El proceso de acuerdo con la reivindicación 10, en el que el disolvente es diclorometano.
12. El proceso de acuerdo con la reivindicación 8, en el que el disolvente alifático o el disolvente aromático usados en la etapa (c) son un disolvente o una mezcla de disolventes seleccionados entre ciclohexano, hexano, n-heptano, tolueno y xileno.
13. El proceso de acuerdo con la reivindicación 12, en el que el disolvente alifático es ciclohexano.
Patentes similares o relacionadas:
Moduladores heteroaromáticos del receptor NMDA y usos de los mismos, del 24 de Junio de 2020, de Cadent Therapeutics, Inc: Un compuesto representado por la Fórmula I **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en el que: los anillos A y B son un sistema heteroaromático […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]
Nuevos compuestos antibacterianos, del 1 de Abril de 2020, de AZIENDE CHIMICHE RIUNITE ANGELINI FRANCESCO A.C.R.A.F. S.P.A.: Compuesto de fórmula: : A-L1-Y-L2-R-B en el que: A es un grupo cíclico que presenta la fórmula (II) siguiente: **(Ver fórmula)** […]
Ester de ibuprofeno de filigenina, su procedimiento de preparación y aplicaciones del mismo, del 3 de Enero de 2020, de Fu, Li: Un compuesto de éster de ibuprofeno de filigenina con fórmula estructural general representada por la fórmula (I):**Fórmula**
Compuestos de biarilamida como inhibidores de cinasas, del 25 de Diciembre de 2019, de NOVARTIS AG: Un compuesto de formula (I): **(Ver fórmula)** o una sal farmaceuticamente aceptable de este, donde: Z1 es O, S, S(=O) o SO2; […]
Tricíclicos sustituidos y métodos de uso, del 18 de Diciembre de 2019, de AbbVie Overseas S.à r.l: Un compuesto de fórmula (I) o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** en donde R1 es H o alquilo C1-C3; X es la fórmula (a) […]
Modulación de receptores quimiosensoriales y ligandos asociados con los mismos, del 26 de Noviembre de 2019, de SENOMYX INC.: Un compuesto que tiene la fórmula estructural (IIIb1)**Fórmula** o una sal, tautómero, solvato o éster del mismo, en donde A es acilo, acilo sustituido, heteroalquilo, […]
Derivados de pirazol tricíclicos condensados útiles para modular los receptores farnesoide x, del 20 de Noviembre de 2019, de Recordati AG: Un compuesto de acuerdo con la Fórmula (II), **(Ver fórmula)** o una sal farmacéutica aceptable de esta, donde R0 es alquilo C1-6; haloalquilo C1-6; […]