Las podofilotoxinas como agentes antiproliferativos.
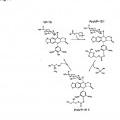
Una podofilotoxina seleccionada del grupo que comprende**Fórmula**
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10010826.
Solicitante: UNIVERSITÄTSKLINIKUM CHARITÉ DER HUMBOLDT- UNIVERSITÄT ZU BERLIN.
Nacionalidad solicitante: Alemania.
Dirección: TECHNOLOGIETRANSFERSTELLE 10098 BERLIN ALEMANIA.
Inventor/es: WRASIDLO, WOLFGANG, GAEDICKE,GERHARD, LODE,HOLGER N. PROF. DR. MED.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con un oxígeno como único heteroátomo de un ciclo, p. ej. isosorbida.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D493/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 493/00 Compuestos heterocíclicos que contienen átomos de oxígeno como únicos heteroátomos del ciclo en el sistema condensado. › Sistemas orto-condensados.
PDF original: ES-2545393_T3.pdf



Fragmento de la descripción:
Las podofilotoxinas como agentes antiproliferativos
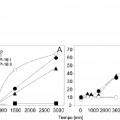
Los lignanos como la podofilotoxina y sus metabolitos y precursores forman parte de la vía de los fenilpropanoides y están ampliamente distribuidos en el reino vegetal. Algunos de ellos, en particular la podofilotoxina, son conocidos por sus propiedades anticancerosas, antlfúnglcas y antimicroblanas. La podofilotoxina se extrajo por primera vez en forma de resina del podófilo o «manzana de mayo» (Podophyllum peltatum) y de especies del género Linum como Linum álbum, Linum flavum y Linum nodiflorum, siendo utilizada por médicos de algunas zonas del sur de EE. UU. A finales del siglo XIX como tratamiento contra las verrugas genitales, vinculadas con ciertos tipos de cáncer por su etiología ligada al virus del papiloma humano (HPV). La podofilotoxina ha acaparado especial interés como molécula originaria de fármacos quimioterapéuticos como el etopósido, el tenipósido y el etopofós, todos ellos inhibidores de la topoisomerasa II. En la actualidad, la demanda de podofilotoxina excede con mucho las existencias mundiales, que resultan insuficientes debido al lento crecimiento de las plantas silvestres y a su sobreexplotación. A fin de compensar las escasas existencias de podofilotoxina se han intentado cultivar células de Podophyllum peltatum y de Linum álbum con un éxito relativo. Los derivados semisintéticos etopósido y tenipósido son importantes fármacos antitumorales que si bien gozan de amplio uso adolecen de varias limitaciones, como son la escasa hidrosolubilidad, la inactivación metabólica y el desarrollo de resistencia farmacológica. Para superar tales limitaciones numerosos laboratorios han sintetizado derivados de la podofilotoxina (Yin et al., acta pharm. Sínica 1993, 28,758-761, Wang et al., acta chem. Sinica 1992, 50, 698-701, Chang et al., J. med. chem. 1994, 37446-442, Pelter et al., J. nat. prod. 1994, 57, 1598-1602). Sin embargo, ninguno ha demostrado mejorar sustancialmente la eficacia ni los efectos secundarios.
El etopósido es un fármaco antitumoral muy eficaz utilizado comúnmente contra una gran diversidad de tumores, entre ellos algunos pediátricos como los linfomas linfáticos agudos, el rabdomiosarcoma y el neuroblastoma, así como en los tipos de cáncer de adulto más frecuentes. Asimismo, se emplea en los regímenes de acondicionamiento que preceden al trasplante de médula ósea. Con todo, el uso terapéutico del etopósido se ve limitado por su toxicidad, básicamente consistente en mielodepresión.
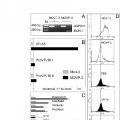
Uno de los mayores obstáculos para lograr una quimioterapia eficaz en el cáncer en general y en la leucemia de alto riesgo en particular radica en vencer la multirresistencia farmacológica. La mayoría de pacientes responde inicialmente al tratamiento con combinaciones de varios quimioterápicos. Pero la poliquimioterapia puede promover la aparición de clones de células multirresistentes (MDR) que siguen proliferando en presencia de agentes citotóxicos (Dalton WS. Mechanism of drug resistance in hematologic malignancies Semin Hematol. 1997;34:3-8). La reducción de la quimiosensibilidad en esos clones celulares exigiría la administración de citostáticos en cantidades que exceden la dosis máxima tolerada in vivo. Uno de los mecanismos de resistencia mejor conocidos de la leucemia y del carcinoma es la expulsión del fármaco mediada por la glucoprotefna-p, que es el producto del gen de multirresistencia farmacológica 1 (MDR-1, Multidrug resistance-1), lo cual ha demostrado estar asociado con un desenlace negativo (Hunault M, Zhou D, Delmer A, et al. Multidrug resistance gene expression in acute myeloid leukemia: major prognosis significance for in vivo drug resistance to induction treatment. Ann Hematol. 1997;74:65- 71; Marie JP, Zhou DC, Gurbuxani S, Legrand O, Zittoun R. MDR1/P-glycoprotein in haematological neoplasms. Eur J Cáncer. 1996;32A:1034-1038.).
Desde la introducción de la poliquimioterapia se han concebido diversas estrategias para evitar o burlar la resistencia farmacológica. Las estrategias para vencer la resistencia en los pacientes giran en torno a: (I) La posología, esto es, el tratamiento prolongado con dosis bajas como en el caso de los antifolatos en la leucemia recidivante o la administración de dosis altas a corto plazo, p. ej. antifolatos con posterior rescate con folato en el osteosarcoma; (II) El tratamiento de combinación con sensibilizantes químicos como los inhibidores del MDR-1 en el caso de resistencia mediada por dicho gen; y (III) La combinación de quimioterapia con sensibilizantes no químicos como por ejemplo radioterapia, hipertermia u oxígeno hiperbárico (Dalton WS. Mechanisms of drug resistance in hematologic malignancies. Semin Hematol. 1997;34:3-8; Joel SP, Slevin ML. Schedule-dependent topoisomerase II- inhibiting drugs. Cáncer Chemother Pharmacol. 1994;34 Suppl:S84-S88; Ishikawa T, Kuo MT, Furuta K, Suzuki M. The human multidrug resistance-associated protein (MRP) gene family: from biological function to drug molecular design. Clin Chem Lab Med. 2000;38:893-897.)
Son contadas las tentativas de modificar directamente el agente citostático con el fin de hallar análogos que burlen activamente los mecanismos de resistencia farmacológica, como un análogo desaminado de la doxorrubicina (Solary E, Ling YH, Perez-Soler R, Priebe W, Pommier Y. Hydroxyrubicin, a deaminated derivative of doxorubicin, inhibits mammalian DNA topoisomerase II and partially circumvents multidrug resistance. Int J Cáncer. 1994;58:85-94.), y derivados beta-amino del etopósido (Zhang YL, Guo X, Cheng YC, Lee KH. Antitumor agents. 148. Synthesis and biological evaluation of novel 4 beta-amino derivatives of etoposide with better pharmacological profiles. J Med Chem. 1994;37:446-452; Zhang YL, Shen YC, Wang ZQ, et al. Antitumor agents, 130, Novel 4 beta-arylamino derivatives of 3',4'- didemethoxy-S'^'-dioxo^-deoxypodophyllotoxin as potent inhibitors of human DNA topoisomerase II. J Nat Prod. 1992;55:1100-1111.). Así pues, posibles soluciones contra los fracasos vinculados al MDR son el diseño racional de fármacos que no resulten afectados por los mecanismos del MDR y que estén dotados de una toxicidad sistémica reducida a la par que una potencia antitumoral incrementada.
La resistencia contra el etopósido tiene lugar en distintos niveles celulares, pues implica la regulación a la baja de la enzima diana, la topoisomerasa II, la regulación a la baja de los mecanismos proapoptósicos o la regulación al alza de los mecanismos antiapoptósicos como la bcl-2, así como el aumento del metabolismo y/o de la expulsión del fármaco de la célula a través de sistemas de transporte. La activación de tales sistemas de transporte acaba generando con frecuencia resistencia cruzada contra otros citostáticos, tal y como se ha observado en la multirresistencia farmacológica mediada por MDR-1, MRP o LRP (Gottesman MM. How cáncer cells evade chemotherapy: sixteenth Richard and Hinda Rosenthal Foundation Award Lecture. Cáncer Res. 1993;53:747-754; Borst P, Evers R, Kool M, Wijnholds J. A family of drug transporters: the multidrug resistance-associated proteins. J Nati Cáncer Inst. 2000;92:1295-1302; Borst P, Evers R, Kool M, Wijnholds J. The multidrug resistance proteln family. Biochim Biophys Acta. 1999;1461:347-357.) Un importante mecanismo de resistencia farmacológica, confirmado en neoplasias hematológicas, consiste en la sobreexpresión del producto del gen MDR-1, la glucoproteína-p. Así pues, los intentos por vencer la resistencia farmacológica mediada por sistemas de transporte básicamente se han centrado hasta el momento en la modulación de la expresión del MDR-1 (Liu C, Qureshi IA, Ding X, et al. Modulation of multidrug resistance gene (mdr-1) with antisense oligodeoxynucleotides. ClinSci (Colch). 1996;91:93-98.) o en la administración conjunta de inhibidores de MDR-1 como la ciclosporina (Sonneveld P, Durie BG, Lokhorst HM, et al. Modulation of multidrug-resistant múltiple myeloma by cyclosporin. The Leukaemia Group of the EORTC and the HOVON. Lancet. 1992;340:255-259 ), el verapamilo (Joly P, Lallemand A, Oum'Hamed Z, Trentesaux C, Idoine O, Desplaces A. Effects of verapamil and S9788 on MDR-1 mRNA expression studied by in situ hybridization. Anticancer Res. 1996;16:3609-3614.) o el valspodar (Tai HL. Technology evaluation: Valspodar, Novartis AG. Curr Opin Mol Ther. 2000;2:459-467 ), todos los cuales han demostrado una eficacia limitada en condiciones in vitro e in vivo. Estas proteínas de transporte de membrana expulsan una gama sorprendentemente amplia de sustratos dotados de estructuras completamente distintas, posiblemente debido al hecho de que los metabolitos abundantes como el glucurónido, el glutatión o el sulfato son reconocidos específicamente en lugar de los diversos fármacos (Zhu BT. A novel hypothesis forthe... [Seguir leyendo]
Reivindicaciones:
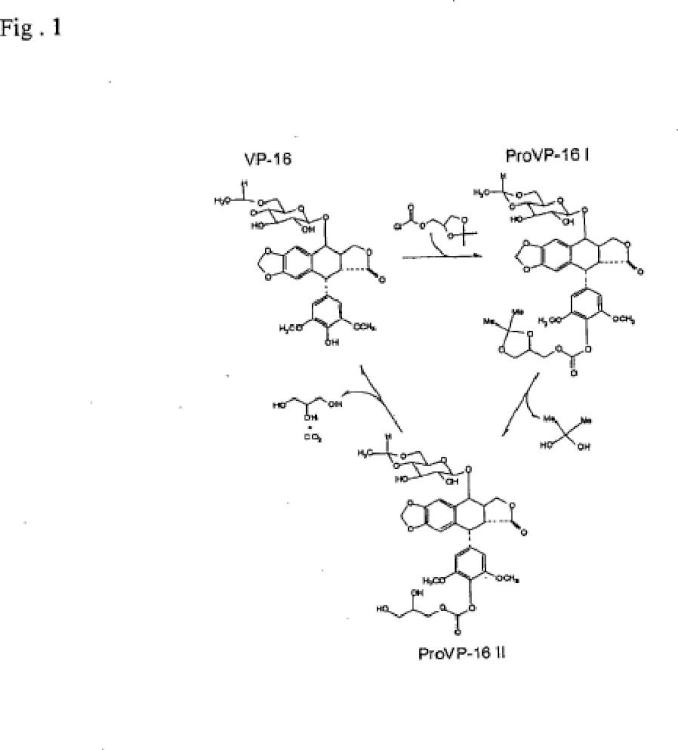
1. Una podofilotoxina seleccionada del grupo que comprende
**(Ver fórmula)**2. Método para la preparación de una podofilotoxina acorde con la reivindicación 1, caracterizado por 5 a) un compuesto con la fórmula (V)
En qué A es
**(Ver fórmula)**, se hace reaccionar con un haloformiato W-(C=X)-(Y)-(CH2)n-Z, en el que X=S, Y=0, n = 1 y Z es
**(Ver fórmula)**y Wes Cl, F, Bro I, o
b) caracterizado porque un compuesto como el representado por la fórmula V se hace reaccionar con fosgeno o triclorometilcloroformiato, para dar el producto intermedio 4-fenol cloroformiato, haciéndose 15 reaccionar dicho producto intermedio con un alcohol o tiol de la fórmula ZYH, para dar el tiocarbonato
correspondiente, Y=S, y siendo Z como se define en a).
3. Método acorde con la reivindicación 2, caracterizado porque el compuesto que se representa con la fórmula V se hace reaccionar con un compuesto seleccionado del grupo consistente en solcetalcloroformiato y PEG-cloroformiato.
4. Método para preparar una podofilotoxina acorde con la reivindicación 1, caracterizado porque el producto resultante de cualquiera de las reivindicaciones 2-3 se hidroliza.
5. Composición farmacéutica que comprende a) una podofilotoxina acorde con la reivindicación 1, y b) un vehículo
farmacéuticamente aceptable.
6. Una podofilotoxina acorde con la reivindicación 1 o una composición farmacéutica acorde con la reivindicación 5 para el tratamiento de trastornos proliferativos celulares.
7. Una podofilotoxina o una composición farmacéutica acorde con la reivindicación 6, caracterizada porque el 10 trastorno proliferativo celular afecta a un niño, un adolescente o un adulto.
Patentes similares o relacionadas:
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Aril éteres y usos de los mismos, del 22 de Julio de 2020, de Peloton Therapeutics, Inc: Un compuesto de formula Vd: **(Ver fórmula)** ç o una sal farmaceuticamente aceptable del mismo, en donde: R1 es arilo o heteroarilo; […]