FORMULACIONES DE EBASTINA NANOPARTICULADAS.
Una composición nanoparticulada estable de ebastina, o de una sal de la misma,
consistente en:
(a) partículas de ebastina o de una sal de la misma que tienen un tamaño medio efectivo de partícula de menos de aproximadamente 2.000 nm y (b) al menos un estabilizador de superficie
Tipo: Resumen de patente/invención. Número de Solicitud: W06022330US.
Solicitante: ELAN PHARMA INTERNATIONAL LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: MONKSLAND,ATHLONE WESTMEATH.
Inventor/es: LIVERSIDGE, GARY G., JENKINS,SCOTT.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A61K31/445 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperidinas no condensadas, p. ej. piperocaína.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/14H4
Clasificación PCT:
- A61K31/445 A61K 31/00 […] › Piperidinas no condensadas, p. ej. piperocaína.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
Fragmento de la descripción:
Formulaciones de ebastina nanoparticuladas.
Campo de la invención
La presente invención se relaciona con compuestos antagonistas de los receptores H1 de histamina y con composiciones útiles en el tratamiento o la prevención de enfermedades o trastornos tales como la rinitis alérgica estacional y perenne, la urticaria crónica idiopática y condiciones o síntomas relacionados. Más específicamente, la invención se relaciona con composiciones antagonistas de los receptores H1 de histamina nanoparticuladas, tales como composiciones nanoparticuladas de ebastina con un tamaño medio de partícula efectivo de menos de aproximadamente 2.000 nm. La invención se relaciona también con métodos de preparación y utilización de dichas composiciones nanoparticuladas.
Antecedentes de la invención
Los antihistamínicos han sido utilizados desde hace mucho tiempo para tratar los síntomas de las alergias estacionales y crónicas (rinitis alérgica estacional y perenne), la fiebre del heno y los sarpullidos, también conocidos como urticaria (véase, v.g., Glenis Scadding, Clin. Drug Invest. 2005, 25(3):153-164). Se han reconocido ahora condiciones y enfermedades tales como éstas como problemas médicos debilitantes que pueden tener un enorme efecto adverso sobre la calidad de vida de un paciente (véase, v.g., Corren J, J. Allergy Clin. Immunol. 2000, 105(6):610-615).
En una reacción alérgica, los antihistamínicos actúan como antagonistas reversibles de la histamina. Básicamente, los antihistamínicos evitan que las histaminas, liberadas por las células cebadas o los basófilos en respuesta a un alergeno, se unan a los receptores H1 de histamina. Una vez se libera la histamina y se une a su receptor, ésta puede tener efectos amplios sobre el organismo, que pueden incluir moqueo, picor y estornudos.
Existen numerosas categorías de antihistamínicos, algunas de las cuales tienen síntomas secundarios más severos (v.g., sedación y distrés gastrointestinal) que otras. Los antihistamínicos de primera generación
(tales como las etanolaminas y las alquilaminas) han mostrado causar efectos colaterales de moderados a severos, incluyendo sedación, efectos adversos anticolinérgicos y alguna disfunción del SNC. Los antihistamínicos de segunda generación
, tales como la ebastina, la loratadina y la fexofenadina fueron desarrollados para reducir algunos de estos efectos colaterales. Los antihistamínicos de tercera generación
, metabolitos o derivados de los fármacos de segunda generación, fueron desarrollados para ser incluso más efectivos con incluso menos efectos colaterales. Con una activa investigación en el área, muchos antihistamínicos de segunda y tercera generación han mostrado tener funciones medicinales aparte del bloqueo de los receptores de histamina.
A. Antecedentes en cuanto a la ebastina
La ebastina, un antihistamínico de segunda generación, Nº CAS 90729-43-4, es químicamente conocida como 4'-terc-butil-4-[4-(difenilmetoxi)piperidino]butiro-fenona. La ebastina tiene una fórmula empírica de C32H39NO2, con un peso molecular de 469,67.
La estructura química de la ebastina es:
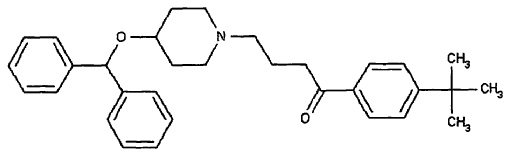
La ebastina es un antagonista selectivo y de acción prolongada de los receptores H1 de histamina. La ebastina se convierte en el metabolito ácido farmacológicamente activo, la carebastina. La vida media de la carebastina es de entre 15 y 19 horas, excretándose un 66% de la medicina por la orina principalmente como metabolitos conjugados. Tras administración repetida de 10 mg una vez al día, se alcanza un estado estacionario en 3 a 5 días, con niveles pico plasmáticos que varían de 130 a 160 ng/mL. La ebastina está indicada para el tratamiento sintomático de la rinitis alérgica estacional y perenne y de la urticaria crónica idiopática.
La ebastina, generalmente administrada una vez al día en concentraciones de 10 mg, es un antihistamínico no sedante para el tratamiento de síntomas asociados a la rinitis alérgica estacional y perenne. La ebastina puede ser adquirida comercialmente en diversos países fuera de los Estados Unidos bajo diversas denominaciones comerciales, tales como KestineTM EbastelTM, EvastelTM y No-SedatTM, comercializadas por compañías tales como Almirall Prodesfarma de España, en tabletas de ebastina orales de 10 mg revestidas con película.
Se describen compuestos de ebastina, por ejemplo, en las Patentes Estadounidenses Nº 4.550.116 para Derivado de piperidina
, 4.766.215 para Antagonistas de los receptores H1 de histamina
, 5.204.249 para Procedimiento para la preparación de carebastina y materiales similares
, 5.460.829 para Composiciones farmacéuticas basadas en ebastina o sus análogos
y 5.602.148 para Composiciones líquidas basadas en derivados de piperidina 1,4-substituida
, todas ellas aquí incorporadas como referencia en su totalidad.
La ebastina es altamente efectiva en la terapia y el tratamiento de la rinitis alérgica estacional y perenne y de enfermedades relacionadas. Sin embargo, la ebastina no es muy soluble en agua y, como resultado de ello, no resulta fácilmente biodisponible cuando se administra oralmente. Por lo tanto, sería deseable formular una forma más soluble - y más biodisponible - de antihistamínico, tal como la ebastina. Dicha formulación sería de acción más rápida, proporcionando así alivio a un sujeto que sufra rinitis, urticaria y trastornos relacionados mucho más rápidamente. Dicha formulación puede también solucionar otros problemas asociados a las formulaciones de fármacos convencionales. La presente invención satisface estas necesidades.
La presente invención se relaciona entonces con composiciones nanoparticuladas antagonistas de los receptores H1, tales como ebastina nanoparticulada, o una sal o derivado de la misma, composiciones para el tratamiento de la rinitis alérgica estacional y perenne, de la urticaria crónica idiopática y de enfermedades, trastornos, condiciones y síntomas relacionados.
B. Antecedentes en cuanto a composiciones nanoparticuladas de agentes activos
Las composiciones nanoparticuladas de agentes activos, primeramente descritas en la Patente EE.UU. Nº 5.145.684 (la patente '684
), son partículas consistentes en un agente terapéutico o diagnóstico poco soluble que tiene adsorbido sobre su superficie un estabilizante de superficie no entrecruzado. La patente '684 no describe composiciones nanoparticuladas de antagonistas de los receptores H1 de histamina tales como la ebastina.
Se describen métodos de preparación de composiciones nanoparticuladas de agentes activos en, por ejemplo, las Patentes EE.UU. Nº 5.518.187 y 5.862.999, ambas para Método de trituración de substancias farmacéuticas
, la Patente EE.UU. Nº 5.718.388, para Método continuo de trituración de substancias farmacéuticas
, y la Patente EE.UU. Nº 5.510.118, para Procedimiento de preparación de composiciones terapéuticas que contienen nanopartículas
.
También se describen composiciones nanoparticuladas de agentes activos, por ejemplo, en las Patentes EE.UU. Nº 5.298.262 para Uso de modificadores iónicos del punto de turbidez para evitar la agregación de partículas durante la esterilización
, 5.302.401 para Método para reducir el crecimiento del tamaño de partícula durante la liofilización
, 5.318.767 para Composiciones de contraste para rayos X útiles en imagen médica
, 5.326.552 para Nueva formulación para agentes de contraste nanoparticulados para pool de sangre para rayos X usando surfactantes no iónicos de alto peso molecular
, 5.328.404 para Método de imagen de rayos X usando propanodioatos aromáticos yodados
, 5.336.507 para Uso de fosfolípidos cargados para reducir la agregación de nanopartículas
, 5.340.564 para Formulaciones que contienen Olin 10-G para evitar la agregación de partículas y aumentar la estabilidad
, 5.346.702 para Uso de modificadores no iónicos del punto de turbidez para minimizar la agregación de nanopartículas durante la esterilización
, 5.349.957 para Preparación y propiedades magnéticas de partículas de dextrano magnéticas muy pequeñas
, 5.352.459 para Uso de modificadores de superficie purificados para evitar la agregación de partículas durante la esterilización
, 5.399.363 y 5.494.683, ambas para Nanopartículas anticancerosas modificadas en superficie
,...
Reivindicaciones:
1. Una composición nanoparticulada estable de ebastina, o de una sal de la misma, consistente en:
2. La composición de la reivindicación 1, donde la ebastina está en una fase cristalina, una fase amorfa, una fase semicristalina, una fase semiamorfa o sus mezclas.
3. La composición de la reivindicación 1 o de la reivindicación 2, donde el tamaño medio efectivo de partícula de las partículas de ebastina o de una sal de la misma es seleccionado entre el grupo consistente en menos de aproximadamente 1.900 nm, menos de aproximadamente 1.800 nm, menos de aproximadamente 1.700 nm, menos de aproximadamente 1.600 nm, menos de aproximadamente 1.500 nm, menos de aproximadamente 1.400 nm, menos de aproximadamente 1.300 nm, menos de aproximadamente 1.200 nm, menos de aproximadamente 1.100 nm, menos de aproximadamente 1.000 nm, menos de aproximadamente 900 nm, menos de aproximadamente 800 nm, menos de aproximadamente 700 nm, menos de aproximadamente 600 nm, menos de aproximadamente 500 nm, menos de aproximadamente 400 nm, menos de aproximadamente 300 nm, menos de aproximadamente 250 nm, menos de aproximadamente 200 nm, menos de aproximadamente 100 nm, menos de aproximadamente 75 nm y menos de aproximadamente 50 nm.
4. La composición de cualquiera de las reivindicaciones 1 a 3, donde la composición de ebastina nanoparticulada tiene una mejor biodisponibilidad en comparación con las tabletas convencionales de ebastina.
5. La composición de cualquiera de las reivindicaciones 1 a 4, donde la composición está formulada:
6. La composición de cualquiera de las reivindicaciones 1 a 5, donde la composición incluye además uno o más excipientes o soportes farmacéuticamente aceptables o una combinación de éstos.
7. La composición de cualquiera de las reivindicaciones 1 a 6, donde:
8. La composición de cualquiera de las reivindicaciones 1 a 7, que contiene al menos un estabilizador de superficie primario y al menos un estabilizador de superficie secundario.
9. La composición de cualquiera de las reivindicaciones 1 a 8, donde al menos un estabilizador de superficie es seleccionado entre el grupo consistente en un estabilizador de superficie no iónico, un estabilizador de superficie iónico, un estabilizador de superficie aniónico, un estabilizador de superficie catiónico y un estabilizador de superficie zwitteriónico.
10. La composición de cualquiera de las rei vindicaciones 1 a 9, donde al menos un estabilizador de superficie es seleccionado entre el grupo consistente en cloruro de cetilpiridinio, gelatina, caseína, fosfátidos, dextrano, glicerol, goma acacia, colesterol, tragacanto, ácido esteárico, cloruro de benzalconio, estearato de calcio, monoestearato de glicerol, alcohol cetoestearílico, cera emulsionante cetomacrogol, ésteres de sorbitán, éteres alquílicos de polioxietileno, derivados de aceite de ricino polioxietilenado, ésteres de polioxietilensorbitán y ácidos grasos, polietilenglicoles, bromuro de dodeciltrimetilamonio, estearatos de polioxietileno, dióxido de silicio coloidal, fosfatos, dodecilsulfato de sodio, carboximetilcelulosa calcio, hidroxipropilcelulosas, hipromelosa, carboximetilcelulosa sodio, metilcelulosa, hidroxietilcelulosa, ftalato de hipromelosa, celulosa no cristalina, silicato de magnesio y aluminio, trietanolamina, alcohol polivinílico, polivinilpirrolidona, polímero de 4-(1,1,3,3-tetrametilbutil)fenol con óxido de etileno y formaldehído, poloxámeros, poloxaminas, un fosfolípido cargado, dioctilsulfosuccinato, ésteres dialquílicos de ácido sulfosuccínico sodio, laurilsulfato de sodio, sulfonatos de alquil aril poliéteres, mezclas de estearato de sacarosa y diestearato de sacarosa, C18H37CH2C(O)N(CH3)-CH2(CHOH)4(CH2OH)2, p-isononilfenoxipoli(glicidol), decanoil-N-metilglucamida, n-decil-ß-D-glucopiranósido, n-decil-ß-D-maltopiranósido, n-dodecil-ß-D-glucopiranósido, n-dodecil-ß-D-maltósido, heptanoil-N-metilglucamida, n-heptil-ß-D-glucopiranósido, n-heptil-ß-D-tioglucósido, n-hexil-ß-D-glucopiranósido, nonanoil-N-metilglucamida, n-nonil-ß-D-glucopiranósido, octanoil-N-metilglucamida, n-octil-ß-D-glucopiranósido, octil-ß-D-tio-glucopiranósido, lisozima, PEG-fosfolípido, PEG-colesterol, PEG-derivado de colesterol, PEG-vitamina A, PEG-vitamina E, copolímeros aleatorios de acetato de vinilo y vinilpirrolidona, un polímero catiónico, un biopolímero catiónico, un polisacárido catiónico, un celulósico catiónico, un alginato catiónico, un compuesto no polimérico catiónico, un fosfolípido catiónico, lípidos catiónicos, polimetilmetacrilato bromuro de trimetilamonio, compuestos de sulfonio, metacrilato de polivinilpirrolidona-2-dimetilaminoetilo sulfato de dimetilo, bromuro de hexadeciltrimetilamonio, compuestos de fosfonio, compuestos de amonio cuaternario, bromuro de bencildi(2-cloroetil)-etilamonio, cloruro de coco trimetilamonio, bromuro de coco trimetilamonio, cloruro de coco metildihidroxietilamonio, bromuro de coco metildihidroxietilamonio, cloruro de deciltrietilamonio, cloruro de decildimetilhidroxietilamonio, cloruro bromuro de decildimetilhidroxietilamonio, cloruro de C12-15dimetilhidroxietilamonio, cloruro bromuro de C12-15dimetilhidroxietilamonio, cloruro de coco dimetilhidroxietilamonio, bromuro de coco dimetilhidroxietilamonio, metilsulfato de miristiltrimetilamonio, cloruro de laurildimetilbencilamonio, bromuro de laurildimetilbencilamonio, cloruro de laurildimetil(etenoxi)4amonio, bromuro de laurildimetil(etenoxi)4amonio, cloruro de N-alquil(C12-18)dimetilbencilamonio, cloruro de N-alquil(C14-18)dimetilbencilamonio, cloruro de N-tetradecildimetilbencilamonio monohidrato, cloruro de dimetildidecilamonio, cloruro de N-alquil(C12-14)dimetil-1-naftilmetilamonio, haluro de trimetilamonio, sales de alquiltrimetilamonio, sales de dialquildimetilamonio, cloruro de lauriltrimetilamonio, sal de alquilamidoalquildialquilamonio etoxilado, una sal de trialquilamonio etoxilado, cloruro de dialquilbencenodialquilamonio, cloruro de N-didecildimetilamonio, cloruro de N-tetradecildimetilbencilamonio monohidrato, cloruro de N-alquil(C12-14)dimetil-1-naftilmetilamonio, cloruro de dodecildimetilbencilamonio, cloruro de dialquilbencenoalquilamonio, cloruro de lauriltrimetilamonio, cloruro de alquilbencilmetilamonio, bromuro de alquilbencildimetilamonio, bromuros de C12trimetilamonio, bromuros de C15trimetilamonio, bromuros de C17trimetilamonio, cloruro de dodecilbenciltrimetilamonio, cloruro de polidialildimetilamonio (DADMAC), cloruros de dimetilamonio, haluros de alquildimetilamonio, cloruro de tricetilmetilamonio, bromuro de deciltrimetilamonio, bromuro de dodeciltrietilamonio, bromuro de tetradeciltrimetilamonio, cloruro de metiltrioctilamonio, POLYQUAT 10TM, bromuro de tetrabutilamonio, bromuro de benciltrimetilamonio, ésteres de colina, cloruro de benzalconio, compuestos de cloruro de estearalconio, bromuro de cetilpiridinio, sales haluros de polioxietilalquilaminas cuaternizadas, MIRAPOLTM ALKAQUATTM, sales de alquilpiridinio, aminas, sales de aminas, óxidos de aminas, sales de imidoazolinio, acrilamidas cuaternarias protonadas, polímeros cuaternarios metilados y guar catiónico.
11. La composición de cualquiera de las reivindicaciones 1 a 10, que contiene adicionalmente uno o más agentes activos útiles para el tratamiento de la rinitis alérgica estacional y perenne y de enfermedades relacionadas.
12. La composición de cualquiera de las reivindicaciones 1 a 11, donde:
13. La composición de la reivindicación 12, donde el medio biorrelevante es seleccionado entre el grupo consistente en agua, soluciones acuosas de electrolitos, soluciones acuosas de una sal, soluciones acuosas de un ácido, soluciones acuosas de una base y sus combinaciones.
14. La composición de cualquiera de las reivindicaciones 1 a 13, donde:
15. La composición de la reivindicación 14, donde:
16. La composición de cualquiera de las reivindicaciones 1 a 15, que no produce niveles de absorción significativamente diferentes cuando se administra en condiciones de ingestión de alimento en comparación con condiciones de ayuno.
17. La composición de la reivindicación 16, donde la diferencia en la absorción de la composición de agente activo de la invención, cuando se administra en el estado de ingestión de alimento frente al estado de ayuno, es seleccionada entre el grupo consistente en menos de aproximadamente un 100%, menos de aproximadamente un 90%, menos de aproximadamente un 80%, menos de aproximadamente un 70%, menos de aproximadamente un 60%, menos de aproximadamente un 50%, menos de aproximadamente un 40%, menos de aproximadamente un 30%, menos de aproximadamente un 25%, menos de aproximadamente un 20%, menos de aproximadamente un 15%, menos de aproximadamente un 10%, menos de aproximadamente un 5% y menos de aproximadamente un 3%.
18. La composición de cualquiera de las reivindicaciones 1 a 17, donde la administración de la composición a un humano en ayunas es bioequivalente a la administración de la composición a un sujeto que ha ingerido alimento.
19. La composición de la reivindicación 18, donde se establece la bioequivalencia
por:
20. Uso de una composición según cualquiera de las reivindicaciones 1 a 19 para la fabricación de un medicamento.
21. El uso de la reivindicación 20, donde el medicamento es útil en el tratamiento de la rinitis alérgica estacional y perenne, de la urticaria crónica idiopática o de una enfermedad relacionada.
22. Un método de preparación de una composición nanoparticulada de ebastina, o de una sal de la misma, consistente en poner en contacto partículas de una ebastina con al menos un estabilizador de superficie durante un tiempo y en condiciones suficientes como para obtener una composición nanoparticulada de ebastina que tiene un tamaño medio efectivo de partícula de menos de aproximadamente 2.000 nm.
23. El método de la reivindicación 22, donde el contacto consiste en molienda, molienda húmeda, homogeneización, precipitación, congelación, técnicas de generación de partículas en fluido supercrítico o técnicas de emulsión.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Triple combinación de antagonistas del receptor 5-HT6 puros, inhibidores de la acetilcolinesterasa y antagonista del receptor NMDA, del 15 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un antagonista del receptor 5-HT6 puro, un inhibidor de la acetilcolinesterasa y un antagonista del receptor NMDA, en el que el antagonista […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Compuestos inhibidores de la acetilcolinesterasa y agonistas de los receptores serotoninérgicos 5HT4, con efecto paramnesiante, sus procedimientos de preparación y composiciones farmacéuticas que los contienen, del 10 de Junio de 2020, de Université de Caen: Compuesto de fórmula general (I): **(Ver fórmula)** en la que: X representa un átomo de hidrógeno, o un átomo de halógeno […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Composición farmacéutica en comprimido que comprende bilastina, del 27 de Mayo de 2020, de Alfred E. Tiefenbacher (GmbH & Co. KG): Una composición farmacéutica en forma de comprimido, que comprende a) una forma cristalina de bilastina, en donde la forma cristalina tiene picos característicos a 6,53, […]
Nuevas composiciones para prevenir y/o tratar trastornos degenerativos del sistema nervioso central, del 27 de Mayo de 2020, de AMICUS THERAPEUTICS, INC: Un compuesto de Fórmula III: **(Ver fórmula)** en donde: R1 es C(R2)(R3)(R4); R2 es hidrógeno, -OH o halógeno; R3 es hidrógeno, -OH, halógeno o -CH3; […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]