Formulación de liberación sostenida que comprende un análogo de somatostatina.
Una composición farmacéutica líquida para administración parental que comprende
una sal de lactato,
acetato, diaspartato o diglutamato o disuccinato del análogo de somatostatina ciclo[{ 4-(NH2-C2H4-NH-CO-O-)Pro} -Phg-DTrp-Lys-Tyr(4-Bzl)-Phe], en donde Phg significa -HN-CH(C6H5)-CO- y Bzl significa bencilo, y
agua, que tiene un pH de entre 3.0 y 7.0,
que forma un sistema de depósito de gel después de inyección en contacto con el fluido corporal.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/013703.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: LAMBERT,OLIVIER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/18 A61K 47/00 […] › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61P5/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 5/00 Medicamentos para el tratamiento de trastornos del sistema endocrino. › de las hormonas hipotalámicas, p.ej. TRH, GnRH, CRH, GRH, somatostatina.
PDF original: ES-2515097_T3.pdf
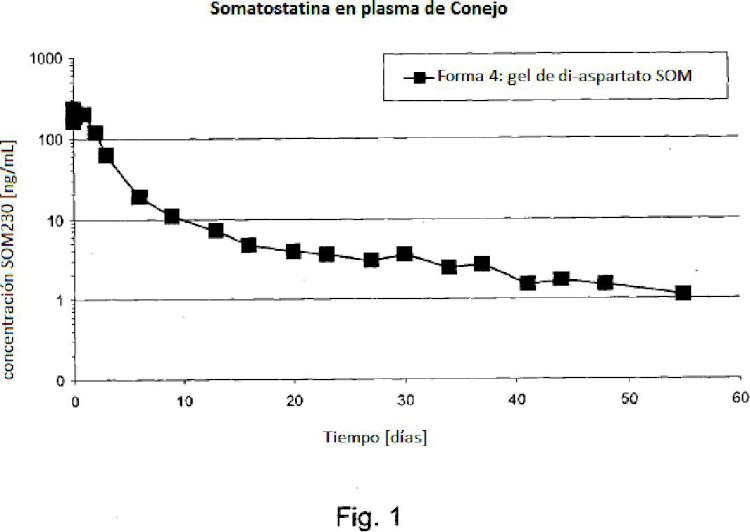
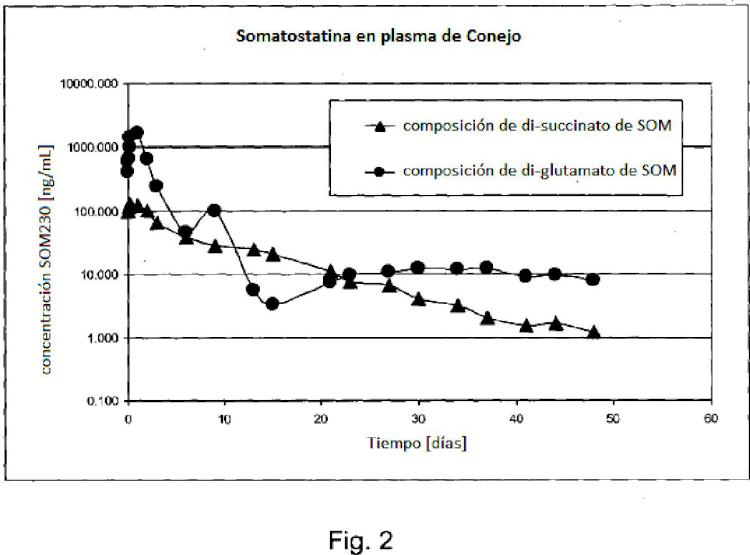
Fragmento de la descripción:
Formulación de liberación sostenida que comprende un análogo de somatostatina
La presente invención se relaciona con composiciones farmacéuticas líquidas, a saber con depósitos de composiciones farmacéuticas líquidas para administración parental, su preparación y una jeringa precargada que las comprende; cada una como se define en las reivindicaciones y en las siguientes realizaciones:
De esta manera, una primera realización de la invención se relaciona con una composición farmacéutica líquida para administración parental que comprende
una sal de lactato, acetato, diaspartato o diglutamato o disuccinato del análogo de somatostatina ciclo[{ 4-(NFÍ2- C2H4-NH-CO--)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe], en donde Phg significa -HN-CH(C6Hs)-CO- y Bzl significa bencilo, y agua, que tiene un pH de entre 3. y 7.,
que forma un sistema de depósito de gel después de inyección en contacto con el fluido corporal.
Una realización de la invención específica de esta primera realización se refiere a la composición que tiene un pH de entre aproximadamente 4. y 6..
Una realización de la invención específica adicional de una cualquiera de las realizaciones en los dos párrafos precedentes se refiere a la composición farmacéutica líquida que comprende un regulador farmacéuticamente aceptable en una cantidad que proporciona un pH de entre aproximadamente 3 y 7.
Una realización de la invención específica adicional en el párrafo precedente se refiere a dicha composición que tiene un pH de entre aproximadamente 4. y 5., en particular en donde el regulador farmacéuticamente aceptable se selecciona de por lo menos uno de un regulador de acetato, un regulador de tartrato, un regulador de glicina y un regulador de lactato, más particularmente regulador de acetato, aún más particularmente regulador de acetato en una concentración de aproximadamente 1 mM a 25 mM.
Una realización de la invención específica adicional de las realizaciones en los tres párrafos precedentes se refiere a la composición farmacéutica líquida en donde la sal de análogo de somatostatina tiene una sal: relación base que varía desde.1 hasta 2.
Una segunda realización de la invención se relaciona con una jeringa precargada que comprende la composición farmacéutica líquida mencionada en los cuatro párrafos precedentes e instrucciones de uso.
Una tercera realización de la invención se relaciona con un proceso para preparar la composición farmacéutica líquida mencionada en los cuatro párrafos anteriores al párrafo inmediatamente precedente que comprende
i) disolver una sal de análogo de somatostatina de diaspartato, diglutamato, o disuccinato, lactato, acetato en agua,
ii) agregar opcionalmente una cantidad farmacéuticamente aceptable de un regulador, y opcionalmente
iii) cargar la solución en una jeringa.
Las formulaciones de depósito normalmente se administran parenteralmente. Se pueden administrar formulaciones de depósito de somatostatina mediante inyección subcutáneamente o intramuscularmente a través de una aguja de pequeño calibre o se coloca en sitios de tejido accesibles a través de una cánula. Sin embargo la administración parental especialmente puede ser muy difícil si se necesitan inyecciones repetidas. Adicionalmente, se pueden presentar dificultades con formulaciones de depósito que se administran en forma líquida y que forman un implante sólido en el cuerpo después de inyección. A menudo el proceso de solidificación inicia en la jeringa antes de inyección y provoca el taponamiento de la aguja.
Adicionalmente, estas formulaciones de depósito pueden comprender un polímero o una mezcla de polímeros que tienen que ser disueltos en un solvente orgánico, por ejemplo pueden comprender más de 5% de un solvente orgánico. Si el solvente orgánico permanece en la solución para inyección puede provocar necrosis o irritación de tejido severa en el sitio de implante.
El documento EP 779 85 proporciona una composición farmacéutica que consiste de una sal de péptido soluble que formará un gel luego de contacto con un fluido corporal, y hasta 3% en peso de la composición de un portador farmacéuticamente aceptable. Los péptidos descritos en el documento EP 77985 son somatostatinas o análogos
de somatostatina, por ejemplo lanreotida. Los documentos EP 1 475 114 (que no describe composiciones líquidas), WO 3/75887 (que se relacionan con formulaciones sólidas o semisólidas), US 6,53,534 (que se relaciona con una formulación en donde la sal de péptido tiene un alta área de superficie específica y que puede formar un gel cuando se inyecta a un paciente) y US 22/11163 (que se relaciona con un método para implantar o insertar una formulación sólida o semisólida) todos describen formulaciones sólidas o semisólidas, pero ninguna de ellas da un indicio de que las composiciones farmacéuticas líquidas de sales de somatostatina como se define en la reivindicación 1 conducirán a un sistema de depósito de gel después de inyección. Carón et al., Clin. Endocrinol. (24) 6, 734-4 describe una solución acuosa inyectable de acetato de lanreotida y de esta manera no la sal en la reivindicación 1.
De forma sorprendente se ha encontrado ahora que se pueden obtener formulaciones de depósito de somatostatina parenterales ventajosas con una composición que comprende una sal de un análogo de somatostatina y agua que tiene un pH desde 3 hasta 7 sin utilizar un polímero y sin utilizar un solvente orgánico.
La presente descripción para referencia proporciona en un aspecto una composición farmacéutica para administración parental que comprende una sal de análogo de somatostatina de aspartato, por ejemplo mono- o diaspartato, glutamato, por ejemplo mono- o diglutamato, o succinato, por ejemplo mono- o disuccinato, lactato, acetato o citrato y agua, con las realizaciones de la invención como se definió anteriormente, que forma un depósito de gel después de inyección en contacto con el fluido corporal. La sal: relación base de la sales de análogos de somatostatina puede variar desde.1 a 2 y proporciona la solubilidad de la sal de análogo de somatostatina. La composición farmacéutica tiene un pH entre aproximadamente 3. y 7., preferiblemente desde entre 4. y 6. y más preferiblemente desde entre aproximadamente 4. y 5.. Opcionalmente la composición puede comprender un regulador farmacéuticamente aceptable en una cantidad para estabilizar el pH entre aproximadamente 3. y 7., preferiblemente entre aproximadamente 4. y 6., más preferiblemente entre 4. y 5..
En otro aspecto la presente descripción para referencia proporciona una composición farmacéutica para administración parental que comprende una sal de análogo de somatostatina de aspartato, por ejemplo mono- o diaspartato, glutamato, por ejemplo mono o diglutamato, lactato, succinato, por ejemplo mono- o disuccinato, acetato o citrato, y agua, que tiene un pH entre aproximadamente 3. y 7., que forma un depósito de gel después de inyección en contacto con el fluido corporal.
La composición que tiene un pH entre aproximadamente 3. y 7. proporciona buena solubilidad y por lo tanto la composición de la invención se puede almacenar durante un periodo de tiempo extendido sin precipitación. La composición se administra al paciente mediante inyección en donde la composición se iniciará para formar un depósito de gel después y no antes de interacción con el fluido corporal. El depósito de gel libera la sal de análogo de somatostatina de aspartato, lactato, succinato, acetato, glutamato o citrato, como realizaciones de la invención como se definió anteriormente, dentro del paciente durante un periodo de tiempo extendido.
En otro aspecto la descripción para referencia proporciona un proceso para preparar una formulación de depósito al
i) disolver una sal de análogo de somatostatina de aspartato, por ejemplo mono- o diaspartato, lactato, succinato, por ejemplo mono- o disuccinato, acetato, glutamato, por ejemplo mono- o diglutamato o citrato en agua,
ii) agregar opcionalmente un regulador para estabilizar el pH de la solución, y opcionalmente
iii) cargar la solución en una jeringa, donde las realizaciones de la invención se definieron anteriormente.
En un aspecto adicional la descripción para referencia proporciona un proceso para preparar una formulación de depósito al
i) disolver una sal de análogo de somatostatina de aspartato, por ejemplo mono- o diaspartato, lactato, succinato, por ejemplo mono- o disuccinato, acetato, glutamato, por ejemplo mono- o diglutamato, o citrato en agua, que tiene un pH de entre 3. y 7.,
ii) agregar opcionalmente un regulador para estabilizar el pH de la solución,... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica líquida para administración parental que comprende una sal de lactato, acetato, diaspartato o diglutamato o disuccinato del análogo de somatostatina ciclo[{ 4- (NH2-C2H4-NH-CO-O-) Pro} -Phg-DTrp-Lys-Tyr (4-Bzl) -Phe], en donde Phg significa -HN-CH (C6H5) -CO- y Bzl significa bencilo, y 5
agua, que tiene un pH de entre 3.0 y 7.0, que forma un sistema de depósito de gel después de inyección en contacto con el fluido corporal.
2. La composición farmacéutica líquida de la reivindicación 1, en donde dicha sal es lactato.
3. La composición farmacéutica líquida de la reivindicación 1, en donde dicha sal es acetato.
4. La composición farmacéutica líquida de la reivindicación 1, en donde dicha sal es diaspartato. 10
5. La composición farmacéutica líquida de la reivindicación 1, en donde dicha sal es diglutamato.
6. La composición farmacéutica líquida de la reivindicación 1, en donde dicha sal es disuccinato.
7. La composición farmacéutica líquida de acuerdo con una cualquiera de las reivindicaciones precedentes que tiene un pH de entre aproximadamente 4.0 y 6.0.
8. La composición farmacéutica líquida de acuerdo con cualquier reivindicación precedente que comprende un 15 regulador farmacéuticamente aceptable en una cantidad para proporcionar un pH de entre aproximadamente 3 y 7.
9. La composición farmacéutica de acuerdo con la reivindicación 8 que tiene un pH de entre aproximadamente 4.0 y 5.0.
10. La composición farmacéutica líquida de acuerdo con la reivindicación 8 o 9 en donde el regulador farmacéuticamente aceptable se selecciona de por lo menos uno de un regulador de acetato, un regulador de 20 tartrato, un regulador de glicina y un regulador de lactato.
11. La composición farmacéutica líquida de acuerdo con una cualquiera de las reivindicaciones 8 a 10 en donde el regulador farmacéuticamente aceptable es regulador de acetato.
12. La composición farmacéutica líquida de acuerdo con la reivindicación 11 en donde el regulador de acetato se utiliza en una concentración de aproximadamente 10 mM a 25 mM. 25
13. La composición farmacéutica líquida de acuerdo con una cualquiera de las reivindicaciones precedentes, en donde la sal de análogo de somatostatina tiene una relación sal:base que varía desde 0.1 hasta 2.
14. Una jeringa precargada que comprende la composición farmacéutica líquida de una cualquiera de las reivindicaciones precedentes e instrucciones para uso.
15. Un proceso para preparar la composición farmacéutica líquida de acuerdo con una cualquiera de las 30 reivindicaciones 1 a 12 que comprende i) disolver una sal de análogo de somatostatina de diaspartato, diglutamato, o disuccinato, lactato, acetato en agua, ii) agregar opcionalmente una cantidad farmacéuticamente aceptable de un regulador, y opcionalmente iii) cargar la solución en una jeringa.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]