ANTICUERPOS INJERTADOS CON CDR HUMANOS Y FRAGMENTOS DE ANTÍCUERPO DE LOS MISMOS.
Anticuerpo humano injertado con CDR que reacciona específicamente con una región extracelular del receptor 4 humano de la quimiocina CC (CCR4) pero no reacciona con una plaqueta humana,
que comprende (a) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 8; (b) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; (c) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14; (d) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 9 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; (e) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 9 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14; (f) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 10 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; (g) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 10 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14; (h) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 11 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; o (i) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 11 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14; o su fragmento de anticuerpo seleccionado de entre el grupo constituido por Fab, Fab', F(ab')2, un anticuerpo monocatenario (scFv), un fragmento (Diacuerpo) de la región variable (región V) dimerizado y un fragmento de la región V estabilizado con disulfuro (dsFv)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2002/008828.
Solicitante: KYOWA HAKKO KIRIN CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 1-6-1, OHTEMACHI, CHIYODA-KU TOKYO 100-8185 JAPON.
Inventor/es: SHITARA, KENYA, KOIKE, MASAMICHI, NAKAMURA, KAZUYASU, HOSAKA,Emi, SHIMIZU,Akiko.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Agosto de 2002.
Clasificación Internacional de Patentes:
- C07K14/715H
- C07K16/28H
- G01N33/68D
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K14/715 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para citoquinas; para linfoquinas; para interferones.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/08 C12P 21/00 […] › Anticuerpos monoclonales.
- G01N33/53 G01N 33/00 […] › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356190_T3.pdf
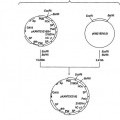
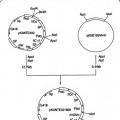
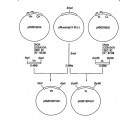

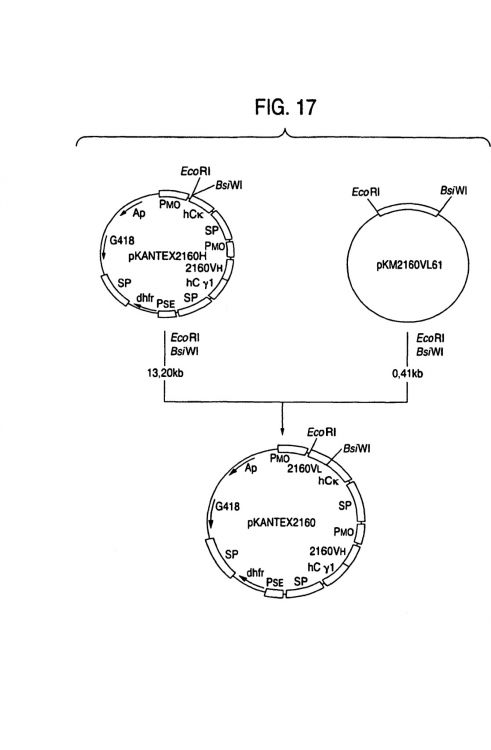
Fragmento de la descripción:
CAMPO TÉCNICO
La presente invención se refiere a un anticuerpo humano injertado con CDR que reacciona específicamente con la región extracelular del receptor 4 humano de quimiocina CC (denominado en adelante "CCR4") pero no reacciona con una plaqueta de la sangre y al fragmento de anticuerpo del mismo. Además, la 5 presente invención se refiere a un anticuerpo humano injertado con CDR que reacciona específicamente con la región extracelular del CCR4 humano pero no tiene actividad inhibidora de un ligando de CCR4 tal como TARC o MDC que se une a CCR4 y al fragmento de anticuerpo del mismo. Por otra parte, la presente invención se refiere a un anticuerpo humano injertado con CDR que reacciona específicamente con la región extracelular de CCR4, tiene actividad citotóxica y una actividad inhibidora de la producción de citocinas por los linfocitos Th2, y comprende una 10 región determinante de complementariedad específica (denominada en adelante "CDR"), y el fragmento de anticuerpo del mismo. Además, la presente invención se refiere a un ADN que codifica el anticuerpo o el fragmento de anticuerpo del mismo. Además, la presente invención se refiere a un vector que comprende el ADN, y a un transformante transformado con el vector. Por otra parte, la presente invención se refiere a un procedimiento para producir un anticuerpo o el fragmento de anticuerpo del mismo utilizando el transformante, y a un medicamento tal 15 como un agente terapéutico, un agente de diagnóstico y similares, para enfermedades inmunitarias mediadas por Th2 tales como las enfermedades alérgicas y similares, que comprende utilizar el anticuerpo o el fragmento de anticuerpo del mismo. Además, la presente invención se refiere a un medicamento, tal como un agente terapéutico, un agente de diagnóstico y similares, para cánceres tales como cánceres de la sangre, por ejemplo, leucemia y linfomatosis que comprende utilizar el anticuerpo o el fragmento de anticuerpo del mismo. 20
ANTECEDENTES DE LA TÉCNICA
Varios factores tales como los eosinófilos, mastocitos e IgE y similares, desempeñan una función en las enfermedades alérgicas tales como el asma bronquial. Los eosinófilos se infiltran en una zona inflamatoria y liberan proteínas citotóxicas básicas tales como MBP (proteína básica principal) o similares por desgranulación y dichas proteínas básicas citotóxicas dañan los tejidos circundantes. Los mastocitos están unidos a un complejo inmunitario 25 antigénico con IgE que es producido por los linfocitos B y liberan histamina de modo que se provoca una reacción alérgica inmediata. La reacción alérgica es controlada por moléculas biológicamente funcionales tales como las citocinas, quimiocinas, y similares, que forman parte en la transducción de señal entre las células. La IL-5 produce diferenciación, supervivencia y desgranulación de eosinófilos. La IL-4 provoca la activación de linfocitos B y la producción de IgE. La IgE producida forma un complejo inmunitario con el antígeno y origina la desgranulacion de 30 los mastocitos. Se ha descubierto que IL-4, IL-13 y similares son también producidas por los mastocitos y contribuyen a la producción de IgE por los linfocitos B (Am. J. Respir. Crit. Care Med., 152, 2059 (1995), Immunol. Today, 15, 19 (1994)). De este modo, una red de citocina-quimiocina elaborada está presente entre las células inflamatorias y mantiene complicados equilibrios.
Las citocinas y las quimiocinas son producidas por los linfocitos T colaboradores que expresan CD4 en la 35 superficie celular (en adelante denominadas "células CD4+Th"). Actualmente, se ha descubierto que la infiltración de linfocitos T colaboradores se encuentra en la zona de inflamación de las vías respiratorias de los pacientes de asma bronquial, en los que un número considerablemente grande de linfocitos T están activados y que la gravedad e hipersensibilidad de las vías respiratorias del paciente con asma se correlaciona con el número de linfocitos T activados, así como los linfocitos T activados aumentan también en la sangre periférica (Am. Rev. Respir. Dis., 145, 40 S22, (1992)).
Los linfocitos T colaboradores se clasifican en linfocitos Th1 y linfocitos Th2, dependiendo del tipo de citocina que produzcan (Annu. Rev. Immunol., 7, 145 (1989)). Los linfocitos Th2 producen IL-4, IL-5, IL-13 y similares. Las citocinas producidas por los linfocitos Th2 son citocinas Th2.
Se ha descubierto que un clon de linfocitos T específico para el antígeno aislado de un paciente de atopia 45 libera citocinas Th2 cuando es estimulado in vitro (Proc. Natl. Acad. Sci. U.S.A., 88:4538, (1991)) y los linfocitos Th2 están presentes en el fluido de lavado bronquioalveolar (denominado en adelante "BAL") y la mucosa de las vías respiratorias de los pacientes con asma (N. Engl. J. Med., 326, 298, (1992), (Eur. J. Immunol., 23, 1445 (1993)). Los niveles de expresión de los ARNm en IL-4 e IL-5 de las citocinas Th2 aumentan cuando las expresiones del ARNm de varias citocinas en células en BAL se examinan utilizando un modelo de animal con inflamación alérgica (Clin 50 Immunol. Immunopathol., 75, 75, (1995)). Además, cuando los linfocitos Th2 se administran por vía intravenosa o intranasal a ratones, se provoca inflamación asmática en los pulmones de manera específica para el antígeno (J. Exp. Med., 186, 1737 (1997), J. Immunol., 160, 1378 (1998)) y se observa eosinofilia (J. Immunol., 161, 3128 (1998)). La expresión de IL-5 se observa en la mucosa de las vías respiratorias de pacientes con asma y lesiones en la piel en pacientes con dermatitis atópica (J. Clin. Invest., 87, 1541, (1991), J. Exp. Med., 173, 775 (1991)), y el 55 nivel de expresión de IL-5 en la mucosa de rinitis alérgica crónica se correlaciona con el nivel de expresión de IL-13, y con las cantidades de IgE total en el suero e IgE específica del antígeno (Therapeutics, 32, 19, (1998)).
Quimiocina es un vocablo general para las proteínas básicas que se unen a la heparina que provoca quimiotaxia y activación de leucocitos, y se clasifica en subfamilias de CXC, CC, C y CX3C dependiendo de la posición de los restos de cisteína en la estructura primaria. Hasta ahora se han identificado 16 de los receptores de 60
quimiocina (Curr. Opi. Immunol., 11, 626, (1999)), y se ha demostrado que la expresión de cada receptor de quimiocina es diferente entre los leucocitos tales como los linfocitos Th1, linfocitos Th2 o similares (Cell Engineering, 17, 1022 (1998)).
El CCR4 humano es un receptor transmembranario con siete dominios acoplado a la proteína G clonado como K5-5 procedente de una estirpe celular humana KU-812 basófila e inmadura. Las zonas transmembranarias 5 de CCR4 se considera que son las posiciones 40 a 67, las posiciones 78 a 97, las posiciones 113 a 133, las posiciones 151 a 175, las posiciones 207 a 226, las posiciones 243 a 270 y las posiciones 285 a 308 en la secuencia de aminoácidos, las regiones extracelulares se consideran que son las posiciones 1 a 39, las posiciones 98 a 112, las posiciones 176 a 206 y las posiciones 271 a 284 en la secuencia de aminoácidos, y las regiones intracelulares son las posiciones 68 a 77, las posiciones 134 a 150, las posiciones 227 a 242 y las posiciones 309 a 10 360 en la secuencia de aminoácidos (J. Biol. Chem., 270, 19495 (1995)). En primer lugar, se dio cuenta de que el ligando de CCR4 es MIP-1α (proteína 1α inflamatoria de macrófago), RANTES (regulado en activación de linfocitos T normales expresado y segregados) o MCP-1 (proteína quimiotáctica de monocitos) (Biochem. Biophys. Res. Commun., 218, 337, (1996), documento WO 96/23068). Sin embargo, se ha descubierto que TARC (quimiocina regulada y activada del timo) producida a partir de células mononucleares de la sangre periférica humana (en 15 adelante denominadas "PBMC") y de las células del timo (J. Biol. Chem., 271, 21514 (1996)) se une específicamente a CCR4 (J. Biol. Chem., 272, 15036 (1997)). Se ha publicado también que la MDC (quimiocina derivada de macrófagos) aislada del macrófagos (J. Exp. Med., 185,1595 (1997)) conocida también como STCP-1 (proteína 1 quimiotáctica de linfocitos T estimulados) (J. Biol. Chem., 272, 25229 (1997)), se une a CCR4 más fuertemente que TARC (J. Biol. Chem., 273, 1764 (1998)). 20
Se ha demostrado que CCR4 se expresa en linfocitos CD4+ Th que producen citocina y/o quimiocina (J. Biol. Chem., 272, 15036 (1997)), y se ha publicado que CCR4 se expresa selectivamente en linfocitos Th2 entre los linfocitos CD4+ Th (J. Exp. Med., 187,129 (1998), J. Immunol., 161, 5111 (1998)). Además, las células CCR4+ se han descubierto... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo humano injertado con CDR que reacciona específicamente con una región extracelular del receptor 4 humano de la quimiocina CC (CCR4) pero no reacciona con una plaqueta humana, que comprende
(a) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 8; 5
(b) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12;
(c) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 4 y una región variable (región V) de la cadena ligera 10 (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14;
(d) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 9 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12;
(e) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia 15 de aminoácidos representada por la SEC. ID. nº 9 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14;
(f) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 10 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; 20
(g) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 10 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14;
(h) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 11 y una región variable (región V) de la cadena ligera 25 (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 12; o
(i) una región variable (región V) de la cadena pesada (cadena H) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 11 y una región variable (región V) de la cadena ligera (cadena L) del anticuerpo que comprende la secuencia de aminoácidos representada por la SEC. ID. nº 14; 30
o su fragmento de anticuerpo seleccionado de entre el grupo constituido por Fab, Fab', F(ab')2, un anticuerpo monocatenario (scFv), un fragmento (Diacuerpo) de la región variable (región V) dimerizado y un fragmento de la región V estabilizado con disulfuro (dsFv).
2. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según la reivindicación 1 que presenta actividad citotóxica contra una célula que expresa a CCR4. 35
3. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 ó 2, en el que la región extracelular es una región extracelular de las posiciones 1 a 39 en la secuencia de aminoácidos representada por la SEC. ID. nº 48.
4. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 3, en el que la región extracelular es un epítopo presente en las posiciones 2 a 29 en la 40 secuencia de aminoácidos representada por la SEC. ID. nº 48.
5. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 4, en el que la región extracelular es un epítopo presente en las posiciones 13 a 29 en la secuencia de aminoácidos representada por la SEC. ID. nº 48.
6. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de 45 las reivindicaciones 1 a 5, en el que la región extracelular es un epítopo presente en las posiciones 13 a 25 en la secuencia de aminoácidos representada por la SEC. ID. nº 48.
7. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 6, que reacciona específicamente con una célula que expresa a CCR4.
8. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de 50 las reivindicaciones 1 a 7, que presenta una actividad citotóxica superior contra una célula que expresa a CCR4 que
un anticuerpo monoclonal producido por un hibridoma de animal no humano.
9. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 2 a 8, en el que la actividad citotóxica es una actividad citotóxica mediada por células dependientes del anticuerpo (ADCC).
10. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según la 5 reivindicación 9, en el que la actividad ADCC es una actividad de inducción de apoptosis de una célula que expresa a CCR4.
11. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 10, que presenta una actividad de eliminación de una célula que expresa a CCR4.
12. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de 10 las reivindicaciones 7 a 11, en el que la célula que expresa a CCR4 es un linfocito Th2.
13. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 12, que presenta una actividad de inhibición de la producción de citocinas de un linfocito Th2.
14. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según la 15 reivindicación 13, en el que la citocina es IL-4, IL-5 o IL-13.
15. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 14, que pertenece a un anticuerpo IgG humano.
16. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo que es producido por un transformante KM8759 (FERM BP-8129) o KM8760 (FERM BP-8130). 20
17. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo en el que el anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 16 está conjugado química o genéticamente con un radioisótopo, una proteína o un agente.
18. Transformante no humano que produce el anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 16. 25
19. Transformante según la reivindicación 18, en el que el transformante es KM8759 (FERM BP-8129) o KM8760 (FERM BP-8130).
20. Procedimiento para producir un anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 16, que comprende cultivar el transformante según la reivindicación 18 ó 19 en un medio para formar y acumular el anticuerpo humano injertado con CDR o el fragmento 30 de anticuerpo del mismo en el cultivo; y recuperar el anticuerpo o el fragmento de anticuerpo del cultivo.
21. ADN que codifica el anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 16.
22. Vector recombinante que comprende el ADN según la reivindicación 21.
23. Transformante no humano que puede obtenerse introduciendo el vector recombinante según la 35 reivindicación 22 en una célula hospedadora.
24. Medicamento que comprende por lo menos uno seleccionado de entre el anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 como principio activo.
25. Agente terapéutico para su utilización en el tratamiento de las enfermedades relacionadas con CCR4, 40 que comprende por lo menos uno seleccionado de entre el anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 como principio activo.
26. Agente terapéutico según la reivindicación 25, en el que la enfermedad relacionada con CCR4 es un cáncer o enfermedades inflamatorias.
27. Agente terapéutico según la reivindicación 26, en el que el cáncer es un cáncer sanguíneo. 45
28. Agente terapéutico según la reivindicación 27, en el que el cáncer sanguíneo es la leucemia o la linfomatosis.
29. Agente terapéutico según la reivindicación 26, en el que la enfermedad inflamatoria es la hipersensibilidad aguda o crónica de las vías respiratorias o el asma bronquial, la atopia cutánea, la rinitis alérgica o
la polenosis.
30. Agente terapéutico para su utilización en el tratamiento de las enfermedades inmunitarias mediadas por Th2, que comprende por lo menos uno seleccionado de entre el anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 como principio activo.
31. Agente terapéutico según la reivindicación 30, en el que la enfermedad inmunitaria mediada por Th2 5 es el asma con hipersensibilidad crónica de las vías respiratorias, el asma bronquial, la atopia cutánea, la rinitis alérgica o la polenosis.
32. Agente de diagnóstico para las enfermedades relacionadas con CCR4, que comprende por lo menos uno seleccionado de entre el anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 como principio activo. 10
33. Agente de diagnóstico según la reivindicación 32, en el que la enfermedad relacionada con CCR4 es un cáncer o una enfermedad inflamatoria.
34. Agente de diagnóstico según la reivindicación 33, en el que el cáncer es un cáncer sanguíneo.
35. Agente de diagnóstico según la reivindicación 33, en el que el cáncer sanguíneo es la leucemia o la linfomatosis. 15
36. Agente de diagnóstico según la reivindicación 33, en el que la enfermedad inflamatoria es el asma con hipersensibilidad crónica de las vías respiratorias, el asma bronquial, la atopia cutánea, la rinitis alérgica o la polenosis.
37. Agente de diagnóstico para las enfermedades inmunitarias mediadas por Th2, que comprende por lo menos uno seleccionado de entre el anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo 20 según cualquiera de las reivindicaciones 1 a 17 como principio activo.
38. Agente de diagnóstico según la reivindicación 17, en el que la enfermedad inmunitaria mediada por Th2 es el asma con hipersensibilidad crónica de las vías respiratorias, el asma bronquial, la atopia cutánea, la rinitis alérgica o la polenosis.
39. Utilización del anticuerpo humano injertado con CDR y del fragmento de anticuerpo del mismo según 25 cualquiera de las reivindicaciones 1 a 17 para la preparación de una composición de diagnóstico destinada a detectar inmunológicamente CCR4.
40. Utilización del anticuerpo humano injertado con CDR o del fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para la preparación de una composición de diagnóstico destinada a detectar inmunológicamente una célula que ha expresado CCR4 en la superficie celular. 30
41. Utilización del anticuerpo humano injertado con CDR o del fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para la preparación de un medicamento destinado a reducir o eliminar una célula que ha expresado CCR4 en la superficie celular.
42. Utilización del anticuerpo humano injertado con CDR o del fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para la preparación de un medicamento destinado a inhibir la producción 35 de citocina de un linfocito Th2.
43. Anticuerpo humano injertado con CDR y el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para su utilización en la detección inmunológicamente de CCR4.
44. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para su utilización en la detección inmunológicamente de una célula que ha expresado 40 CCR4 en la superficie celular.
45. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de las reivindicaciones 1 a 17 para su utilización en la reducción o eliminación de una célula que ha expresado CCR4 en la superficie celular.
46. Anticuerpo humano injertado con CDR o el fragmento de anticuerpo del mismo según cualquiera de 45 las reivindicaciones 1 a 17 para su utilización en la inhibición de la producción de citocina de un linfocito Th2.
Patentes similares o relacionadas:
SISTEMAS Y PROCEDIMIENTO PARA IDENTIFICAR RIESGO DE TRASPLANTE DE ÓRGANOS, del 17 de Enero de 2012, de RENOVAR, INC: Procedimiento de detección de marcadores de rechazo, que comprende la detección de la presencia de un ligando CXCR3, en donde dicho ligando CXCR3 […]
EXPRESIÓN DIFERENCIAL DE LA CITOCINA EN CÁNCER HUMANO, del 29 de Diciembre de 2011, de APOGENIX GMBH: Un método in vitro para diagnosticar un tipo de cáncer, que comprende las etapas: (a) proporcionar una muestra procedente de un tumor epitelial que comprende células tumorales, […]
PROTEÍNAS DE UNIÓN TRIMÉRICAS PARA CITOCINAS TRIMÉRICAS, del 8 de Noviembre de 2011, de ANAPHORE, INC: Un polipéptido trimérico que comprende tres monómeros, comprendiendo cada uno de dichos monómeros un miembro de unión específico que puede unirse […]
DETECCIÓN Y PREDICCIÓN DE PREECLAMPSIA, del 31 de Agosto de 2011, de PERKINELMER LAS, INC.: Método de predicción de preeclampsia (PE) que comprende determinar en una muestra materna obtenida de una paciente que se encuentra entre las 10 y 38 semanas de gestación, […]
PROCEDIMIENTOS PARA EL TRATAMIENTO DE ENFERMEDADES AUTOINMUNITARIAS EN UN SUJETO Y EN ENSAYOS DE DIAGNÓSTICO IN VITRO, del 16 de Agosto de 2011, de BAYLOR RESEARCH INSTITUTE: Uso de (a) al menos un antagonista de interferón que reduce la actividad de un interferón de tipo I, y (b) al menos un antagonista del ligando Flt3 (Flt3L) que reduce […]
PROCEDIMIENTO DE EVALUACIÓN DE LA EFICACIA ADCC MEDIADA POR EL CD16 DE ANTICUERPOS MONOCLONALES O POLICLONALES, del 8 de Julio de 2011, de LFB BIOTECHNOLOGIES: Procedimiento in vitro para evaluar la eficacia ADCC mediada por el CD16 de un anticuerpo monoclonal o policlonal, que comprende la puesta en […]
MARCADORES PARA ATEROSCLEROSIS, del 15 de Junio de 2011, de IMMUNOCLIN LTD: Método para el diagnóstico, prognosis o identificación de una predisposición hacia aterosclerosis y la susceptibilidad al desarrollo de placas ateroscleróticas […]
ANTICUERPOS MONOCLONALES FRENTE A EPHA2 Y PROCEDIMIENTOS DE USO DE LOS MISMOS, del 8 de Febrero de 2012, de MEDIMMUNE, LLC: Un anticuerpo aislado que se une específicamente a EphA2 con una Koff inferior a 3 x 10 -3 s -1 e induce fosforilación de la EphA2, en el […]