Antagonistas de NLRR-1 y sus usos.
Un antagonista de la proteína 1 neuronal con repeticiones ricas en leucina (NLRR-1) para su uso en un método para tratar el cáncer donde las células cancerosas expresan NLRR-1 y EGFR en un sujeto,
comprendiendo el método administrar al sujeto una cantidad eficaz de dicho antagonista de NLRR-1, siendo dicho antagonista un anticuerpo dirigido contra NLRR-1 o un fragmento de unión a antígeno del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/078474.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY SOUTH SAN FRANCISCO, CA 94080 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SMITH, VICTORIA, HONGO,JO-ANNE S, STINSON,SUSANNA, HAZEN,MEREDITH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
- C07K16/30 C07K 16/00 […] › de células tumorales.
- C12N15/113 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
- C12N5/20 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › siendo uno de los integrantes de la fusión un linfocito B.
PDF original: ES-2502217_T3.pdf




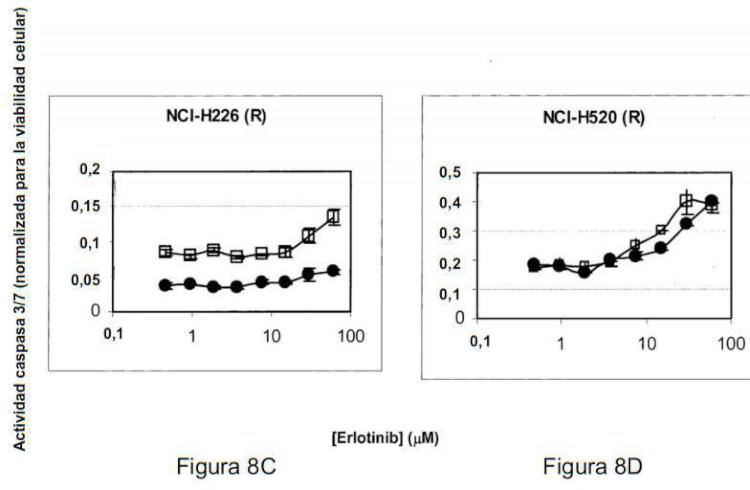
Fragmento de la descripción:
Antagonistas de NLRR-1 y sus usos.
Campo de la invención
La presente invención se refiere a composiciones y métodos útiles para el tratamiento del cáncer y otros trastornos, y en particular a antagonistas de la Proteína 1 Neuronal con Repeticiones Ricas en Leucina.
Antecedente de la invención
Las proteínas neuronales con repeticiones ricas en leucina (NLRR, Neuronal Leudne Rich Repeat) se identificaron en primer lugar a partir de una biblioteca de ADNc de cerebro de ratón y están codificadas por una familia de tres genes (Taguchi y col., 1996; Taniguchi y col., 1996). Constituyen una novedosa familia de proteínas LRR que contiene 11 o 12 LRR, un dominio de ¡nmunoglobulina, y un dominio de fibronectina de tipo III (Bormann y col., 1999; Fukamachi y col., 21; Hayata y col., 1998). A partir de sus características estructurales, se supone que estas proteínas transmembrana glicosiladas juegan papeles en la adhesión, migración, morfogénesis o señalización celular. La expresión embrionaria regulada y la localización celular de las proteínas de la familia NLRR sugieren importantes papeles durante el desarrollo en el control de la adhesión, el movimiento o la señalización celular (Haines y col., 25), pero sus funciones han permanecido elusivas, se ha mostrado que NLRR-3 tiene un papel en la potenciación de la señalización de EGFR en respuesta a concentraciones bajas de EGF promoviendo probablemente la asociación de EGFR y EGF en depresiones y endosomas recubiertos de clatrina de tal manera que no existe evidencia de asociación física con EGFR (Fukamachi y col., 22). Se ha reconocido durante mucho tiempo la endocitosls de EGFR como un mecanismo de atenuación, pero algunos estudios han revelado que los complejos endosómlcos conservan la potencia de señalización y que la ¡nternalización de EGFR puede servir incluso para amplificar la fosforilación de la qulnasa MAP, y estimular las rutas que conducen a la supervivencia celular (Haugh y col., 1999a; Haugh y col., 1999b; Sato y col., 21; Schoeberl y col., 22; Wang y col., 22).
La NLRR-1 (conocida como LRRN1) comparte homología con la NLRR-3, incluyendo la conservación completa del motivo de endocitosls en el extremo C. La NLRR-1 se ha Identificado como un marcador temprano del desarrollo neuroectodérmico (Aubert y col., 23) y también se ha encontrado en un subconjunto de precursores miogénicos durante el desarrollo del somita (Haines y col., 25), pero su función sigue siendo desconocida.
Los datos con respecto a la expresión de proteínas NLRR en patologías humanas son limitados, pero en neuroblastoma, la expresión de NLRR-1, a diferencia de NLRR-3, está significativamente asociada con supervivencia corta y con malos factores de pronóstico (Hamano y col., 24).
La familia del factor de crecimiento epidérmico (EGFR) comprende cuatro receptores estrechamente relacionados (HER1/EGFR, HER2, HER3 y HER4). La familia EGFR y los ligandos asociados estimulan una serie de acontecimientos de señalización intracelulares que regulan la proliferación, la migración, diferenciación y supervivencia celulares (Wells, 1999). La activación de la ruta EGFR juega un papel fundamental en la neoplasia, y los avances recientes en el tratamiento tumoral dirigido contra EGFR han resaltado algunos aspectos de la señalización y activación de EGFR en la tumorigénesis, que incluyen contribuciones de dichos factores como la amplificación genómica, la expresión de proteínas, mutaciones, y efectores en la dirección 3' (Dziadziuszko y col., 26; Eberhard y col., 25; Han y col., 25; Lynch y col., 24; Oliveira y col., 26; Paez y col., 24; Shepherd y col., 25; Tsao y col., 25).
La expresión en exceso de la quinasa de EGFR, o su ligando TGF-alfa, se asocia frecuentemente con muchos cánceres, incluyendo cánceres de pulmón, colorrectal, ovario, carcinoma de células renales, vejiga, cánceres de cabeza y cuello, glioblastomas y astrocitomas, y se cree que contribuyen al crecimiento maligno de estos tumores. Se ha encontrado también que una mutación específica de deleción en el gen EGFR (EGFRvill) aumenta la tumorigenicidad celular. La activación de las rutas de señalización estimuladas por EGFR promueve múltiples procesos que son potencialmente promotores del cáncer, por ejemplo, la proliferación, angiogénesis, angiogénesis, motilidad e invasión celulares, la expresión aumentada de HER1/EGFR se asocia frecuentemente con enfermedad avanzada, metástasis y pronóstico malo. Por ejemplo, en NSCLC y cáncer gástrico, la expresión aumentada de HER1/EGFR ha mostrado estar correlacionada con un elevado índice metastásico, una mala diferenciación celular.
Se han llevado a cabo intensos esfuerzos de investigación para desarrollar agentes antitumorales que inhiban directamente la actividad quinasa del EGFR y anticuerpos que reduzcan la actividad de la quinasa EGFR bloqueando la activación del EGFR (de Bono J.S. y Rowinsky, E.K. (22) Trends in Mol. Medicine 8:S19-S26; Dancey, J. y Sausvllle, E.A. (23) Nature Rev. Drug Discovery 2:92-313). Algunos estudios han demostrado, descrito, o sugerido que algunos inhibidores de la quinasa EGFR pueden mejorar la destrucción originada por las células tumorales o la neoplasia cuando se usan en combinación con determinados agentes anticancerosos o quimioterapéuticos o tratamientos diferentes (por ejemplo, Herbst, R.S. y col. (21) Expert Opin. Biol. Ther. 1:719- 732; Solomon, B. y col (23) Int. J. Radiat. Oncol. Biol. Phys. 55:713-723; Krishnan, S. y col. (23) Frontiers ¡n Bioscience 8, e1 -13; Grunwald, V. e Hidalgo, M. (23) J. Nat. Cáncer Inst. 95:851-867; Seymour L. (23) Current
Opin. Investig. Drugs 4(6):658-666; Khalil, M.Y. y col. (23) Expert Rev. Anticancer Ther.3:367-38; Bulgaru, A.M. y col. (23) Expert Rev. Anticancer Ther.3:269-279; Dancey, J. y Sausville, E.A. (23) Nature Rev. Drug Dlscovery 2:92-313; Ciardiello, F. y col. (2) Clin. Cáncer Res. 6:253-263; y Publicación de Patente N°: US 23/15714).
Erlotinib (por ejemplo, HCI de erlotinib, conocido también como TARCEVA® u OSI-774) es un inhibidor de la quinasa EGFR oralmente disponible. In vitro, erlotinib ha demostrado sustancial actividad inhibidora frente a la quinasa EGFR en numerosas líneas de células tumorales humanas que incluyen cáncer colorrectal y de mama (Moyer J.D. y col. (1997) Cáncer Res. 57(4838), y la evaluación preclínica ha demostrado actividad frente a numerosos xenoinjertos tumorales humanos que expresan EGFR (Pollack, V.A. y col (1999) J. Pharmacol. Exp. Ther. 291:739). Erlotinib ha demostrado actividad en ensayos clínicos en numerosas indicaciones, incluyendo cáncer de cabeza y cuello (Soulieres, D., y col., (24) J. Clin. Oncol. 22(77), NSCLC (Perez-Soler R, y col., (21) Proc. Am. Soc. Clin. Oncol. 2/31a resumen 1235), CRC (Oza, M., y col., (23) Proc. Am. Soc. Clin. Oncol. 22/196a resumen 785) y MBC (Winer, E., y col., (22) Breast Cáncer Res. Treat. 76/5115a resumen 445; Jones, R.J., y col., (23) Proc. Am. Soc. Clin. Oncol. 22/45a resumen 18). En un ensayo clínico en fase III, la monoterapia con erlotinib prolongó significativamente la supervivencia, retrasó la progresión de la enfermedad y retrasó el empeoramiento de los síntomas relacionados con cáncer de pulmón con NSCLC avanzado, resistente al tratamiento (Shepherd, F. y col. (24) J. Clin. Oncology, 22:14S (Suplemento del 15 de julio), Resumen 722). En noviembre de 24 la U.S. Food and Drug Administration (FDA) homologó TARCEVA® para el tratamiento de pacientes para el cáncer de pulmón no microcítico localmente avanzado o metastásico (NSCLC) tras el fracaso de al menos un régimen de quimioterapia previo.
A pesar del significativo avance en el tratamiento del cáncer, se necesitan tratamientos mejorados.
Sumario de la invención
La invención proporciona un antagonista de la Proteína 1 Neuronal con Repeticiones Ricas en Leucina (NLRR-1) para su uso en un método de inhibición de la señalización de EGFR en una célula de mamífero que comprende poner en contacto la célula con una composición que comprende una cantidad eficaz de dicho antagonista (NLRR-1) tal como se define en las reivindicaciones. El antagonista es un anticuerpo dirigido contra NLRR-1 o un fragmento de unión a antígeno del mismo. En algunos casos, el anticuerpo es un anticuerpo monoclonal, tal como el anticuerpo monoclonal 3D1.6.9, producido a partir de células de hlbrldoma que tienen el número de acceso PTA-8732. En otros casos, el anticuerpo compite por la unión con el anticuerpo monoclonal 3D1.6.9 producido a partir de células de hlbrldoma que tienen el número de acceso PTA-8732 de la ATCC. En otros casos más, el anticuerpo es un anticuerpo quimérico, humano, o anticuerpo humanizado, En algunos casos, el anticuerpo quimérico o humanizado comprende un fragmento... [Seguir leyendo]
Reivindicaciones:
1. Un antagonista de la proteína 1 neuronal con repeticiones ricas en leucina (NLRR-1) para su uso en un método para tratar el cáncer donde las células cancerosas expresan NLRR-1 y EGFR en un sujeto, comprendiendo el método administrar al sujeto una cantidad eficaz de dicho antagonista de NLRR-1, siendo dicho antagonista un 5 anticuerpo dirigido contra NLRR-1 o un fragmento de unión a antígeno del mismo.
2. El antagonista de NLRR-1 para el uso de la reivindicación 1, donde el anticuerpo es un anticuerpo monoclonal.
3. El antagonista de NLRR-1 para el uso de la reivindicación 2, donde el anticuerpo monoclonal es 3D1.6.9 10 producido a partir de células de hibridoma que tienen el número de acceso PTA-8732 de la ATCC.
4. El antagonista de NLRR-1 para el uso de la reivindicación 1, donde el anticuerpo compite por la unión con el anticuerpo monoclonal 3D1.6.9 producido a partir de células de hibridoma que tienen el número de acceso PTA-8732 de la ATCC. 15
5. El antagonista de NLRR-1 para el uso de la reivindicación 4, donde el anticuerpo es un anticuerpo quimérico, humano, o anticuerpo humanizado,
6. El antagonista de NLRR-1 para el uso de la reivindicación 5, donde el anticuerpo quimérico o humanizado 20 comprende un fragmento procedente del anticuerpo monoclonal 3D1.6.9 producido a partir de células de hibridoma que tienen el número de acceso PTA-8732 de la ATCC.
7. El antagonista de NLRR-1 para el uso de cualquiera de las reivindicaciones 1-6, donde el receptor del factor de crecimiento epidérmico (EGFR) no se amplifica en el cáncer. 25
8. El antagonista de NLRR-1 para el uso de una cualquiera de las reivindicaciones 1-7, comprendiendo además el método administrar al sujeto una cantidad terapéuticamente eficaz de un antagonista de EGFR, donde dicho antagonista de EGFR es un anticuerpo dirigido contra EGFR o un fragmento de unión a antígeno del mismo, o una molécula pequeña que se une a EGFR. 30
9. El antagonista de NLRR-1 para el uso de la reivindicación 8, donde dicha molécula pequeña que se une a EGFR se selecciona entre el grupo que consiste de: OSI-774 (CP-358774, erlotinib, OSI Pharmaceuticals) ; PD 183805 (CI 1033, 2-propenamida, N-[4-[ (3-cloro-4-fluorofenil) amino]-7-[3- (4-morfolinil) propoxi]-6-quinazolinilo]-, diclorhidrato, Pfizer Inc.) ; Iressa® (ZD1839, gefitinib, AstraZeneca) ; ZM 105180 ( (6-amino-4- (3-metil-fenil-amino) -quinazolina, 35 Zeneca) ; BIBX-1382 (N8- (3-cloro-4-fluoro-fenil) -N2- (1-metil-piperidin-4-il) -pirimido[5, 4-d]pirimidina-2, 8-diamina, Boehringer Ingelheim) ; PKI-166 ( (R) -4-[4-[ (1-feniletil) amino]-1H-pirrolo[2, 3-d]pirimidin-6-il]-fenol) ; (R) -6- (4-hidroxifenil) -4-[ (1-feniletil) amino]-7H-pirrolo[2, 3-d]pirimidina) ; CL-387785 (N-[4-[ (3-bromofenil) amino]-6-quinazolinil]-2-butinamida) ; EKB-569 (N-[4-[ (3-cloro4-fluorofenil) amino]-3-ciano-7-etoxi-6-quinolinil]-4- (dimetilamino) -2-butenamida) ; lapatinib (Tykerb, GlaxoSmithKline) ; ZD6474 (Zactima, AstraZeneca) ; CUDC-101 (Curis) ; canertinib (Cl-1033) ; 40 AEE788 (6-[4-[ (4-etil-1-piperazinil) metil]fenil]-N-[ (1R) -1-feniletil]-7H-pirrolo[2, 3-d]pirimidin-4-amina, WO2003013541, Novartis) y PK1166 4-[4-[
Patentes similares o relacionadas:
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Aril éteres y usos de los mismos, del 22 de Julio de 2020, de Peloton Therapeutics, Inc: Un compuesto de formula Vd: **(Ver fórmula)** ç o una sal farmaceuticamente aceptable del mismo, en donde: R1 es arilo o heteroarilo; […]