Análogos de glucagón.
Un compuesto que tiene la fórmula R1-X-Z-R2
en la que
R1 es H,
alquilo C1-4, acetilo, formilo, benzoílo o trifluoroacetilo;
R2 es OH o NH2;
X es un péptido que tiene la fórmula I:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Ile-Glu- Trp-Leu-Leu-Ser-Ala (SEC ID Nº: 4)
o difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I: el resto en la posición 2 se selecciona de: D-Ser, Aib;
el resto en la posición 16 se selecciona de: Ser, Asp, Lys, Arg;
el resto en la posición 18 es: Ala;
el resto en la posición 20 se selecciona de: Gln, Arg, Glu, Asp;
el resto en la posición 21 es: Glu;
el resto en la posición 23 es: Val;
el resto en la posición 24 se selecciona de: Gln, Asp, Lys, Arg, Ala;
el resto en la posición 27 se selecciona de: Met, Cys, Lys;
el resto en la posición 28 se selecciona de: Asn, Arg, Lys, Ala, Glu, Asp;
y Z está ausente o es una secuencia de 1-20 unidades de aminoácidos seleccionadas del grupo que consiste en Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr y Orn;
o una sal farmacéuticamente aceptable del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2008/004157.
Solicitante: ZEALAND PHARMA A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: Smedeland 36 2600 Glostrup DINAMARCA.
Inventor/es: LARSEN, BJARNE DUE, MEIER, EDDI, RIBER,Ditte, NEERUP,Trine Skovlund Ryge, DAUGAARD,Jens Rosengren, SKOVGAARD,MARIE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/605 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Glucagones.
PDF original: ES-2502218_T3.pdf

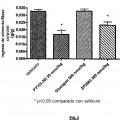


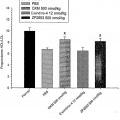
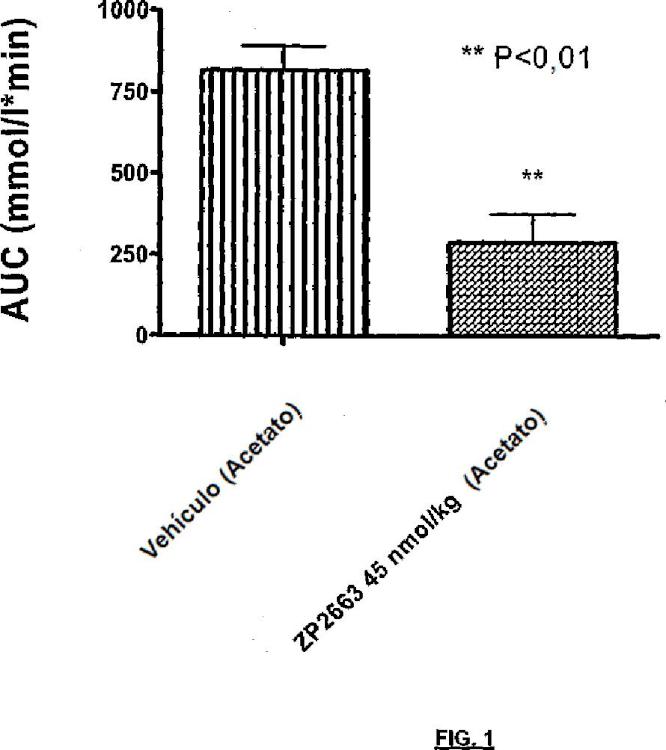
Fragmento de la descripción:
Análogos de glucagón.
Campo de la invención
La presente invención se refiere a análogos de glucagón y a su uso médico, por ejemplo, en el tratamiento de consumo excesivo de alimentos, obesidad y sobrepeso.
Antecedentes de la invención
El preproglucagón es un polipéptido precursor de 158 aminoácidos que se procesa diferencialmente en los tejidos para formar diversos péptidos estructuralmente relacionados derivados del proglucagón, incluyendo glucagón (Glu), péptido 1 similar a glucagón (GLP-1), péptido 2 similar a glucagón (GLP-2) y oxintomodulina (OXM). Estas moléculas están implicadas en una amplia serie de funciones fisiológicas, incluyendo, homeostasis de la glucosa, secreción de insulina, vaciado gástrico y desarrollo intestinal, así como en la regulación de la ingesta de alimentos.
El glucagón es un péptido de 29 aminoácidos que corresponde a los aminoácidos 53 a 81 del pre-proglucagón y tiene la secuencia Hls-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe- Val-Gln-Trp-Leu-Met-Asn-Thr (SEC ID N°: 1). La oxintomodulina (OXM) es un péptido de 37 aminoácidos que incluye la secuencia completa de 29 aminoácidos del glucagón con una extensión octapeptídica (aminoácidos 82 a 89 del pre-proglucagón, que tiene la secuencia Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala (SEC ID N°: 2) en el extremo carboxilo y que se denomina "péptido interviniente 1" o PI-1; la secuencia completa de la oxintomodulina humana es por tanto His-Ser-GIn-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-GIn-Asp-Phe-Val-GIn-Trp- Leu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala) (SEC ID N°: 3). El fragmento principal biológicamente activo del GLP-1 se produce como un péptido amidado en el extremo C, de 3 aminoácidos, que corresponde los aminoácidos 98 a 127 del preproglucagón.
El glucagón ayuda a mantener el nivel de glucemia uniéndose a los receptores de glucagón en los hepatocitos, haciendo que el hígado libere glucosa- almacenada en forma de glucógeno- a través de una glicogenólisis. A medida que estas reservas comienzan a agotarse, el glucagón estimula al hígado para sintetizar glucosa adicional por gluconeogénesls. Esta glucosa se libera en la corriente sanguínea, impidiendo el desarrollo de hipoglucemia.
La OXM se libera en la sangre en respuesta a la ingesta de alimentos y en proporción al contenido calórico de las comidas. Se ha demostrado que la OXM suprime el apetito e inhibe la ingesta de alimentos en seres humanos (Cohén et al, Journal of Endocrinology and Metabolism, 88, 4696-471, 23; WO 23/2234). Además de estos efectos anorexígenos, que son similares a los del GLP-1, la OXM también debe influir en el peso corporal por otro mecanismo, dado que ratas tratadas con oxintomodulina muestran menos aumento de peso corporal que ratas alimentadas en paralelo (Bloom, Endocrinology 24, 145, 2687). El tratamiento de roedores obesos con OXM también mejora su tolerancia a la glucosa (Parlevliet et al, Am J Physiol Endocrinol Metab, 294, E142-7, 28) y suprime el aumento de peso corporal (documento WO 23/2234).
La OXM activa tanto al receptor del glucagón como al del GLP-1 con una fuerza dos veces mayor para el receptor del glucagón sobre el receptor del GLP-1, pero es menos fuerte que el glucagón nativo y que el GLP-1 en sus receptores respectivos. El glucagón humano también puede activar ambos receptores, aunque con una gran preferencia por el receptor del glucagón sobre el receptor del GLP-1. Por otro lado el GLP-1 no puede activar el receptor del glucagón. El mecanismo de acción de la oxintomodulina no se conoce bien. En particular, no se sabe si los efectos de la hormona están mediados a través de los receptores de GLP-1 y los del glucagón, o a través de uno o más receptores no identificados.
Se ha demostrado que otros péptidos se unen y activan tanto al receptor del glucagón como al del GLP-1 (Hjort et al, Journal of Blological Chemistry, 269, 3121-3124) y suprimen el aumento de peso corporal y reducen la Ingesta de alimento (documentos WO 26/13434; WO 27/1535; WO 28/1117).
La obesidad, está clasificada como un problema de salud globalmente en aumento y está asociada con diversas enfermedades, particularmente enfermedad cardiovascular (ECV), diabetes de tipo 2, apnea obstructiva del sueño, determinados tipos de cáncer, y osteoartrltis. Como resultado, se ha descubierto que la obesidad reduce la esperanza de vida. De acuerdo con proyecciones del 25 por la Organización Mundial de la Salud hay 4 millones de personas adultas (edad > 15) clasificadas como obesas en todo el mundo. En los Estados Unidos, actualmente se cree que, después del tabaquismo, la obesidad es la segunda causa principal de muerte prevenible.
El aumento de la obesidad conduce a un aumento de la diabetes, y aproximadamente el 9 % de las personas con diabetes de tipo 2 pueden clasificarse como obesas. Hay 246 millones de personas en todo el mundo con diabetes y se calcula que, en el año 225, 38 millones de personas tendrán diabetes. Muchas de estas personas tienen factores de riesgo cardiovasculares adicionales, Incluyendo niveles altos/aberrantes de LDL y de triglicéridos y niveles bajos de HDL.
Las personas con diabetes tienen de 2 a 4 veces más probabilidades de desarrollar enfermedad cardiovascular que las personas sin diabetes, lo que hace que la complicación de diabetes sea más común La enfermedad cardiovascular representa aproximadamente el 5 % de la mortalidad en las personas con diabetes. Los adultos jóvenes con diabetes tienen tasas de cardiopatía coronaria (CC) 12-4 veces más altas que las de los adultos jóvenes sin diabetes y junto con la alta incidencia y prevalencla de obesidad y de diabetes de tipo 2, los índices de morbidez y mortalidad relacionados con estos trastornos metabólicos acentúan la necesidad médica de opciones de tratamiento eficaces
Por consiguiente, existe una gran necesidad médica para el tratamiento de la obesidad y mejora de la tolerancia a la glucosa.
Sumario de la invención
La invención proporciona un compuesto que tiene la fórmula R1-X-Z-R2 en la que
R1 es H, alquilo C-m, acetilo, formilo, benzoilo o trifluoroacetilo;
R2 es OH o NH2;
X es un péptido que tiene la fórmula I:
His-Ser-GIn-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-lle-Glu-Trp-Leu-Leu- Ser-Ala (SEC ID N°: 4)
o difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I: el resto en la posición 2 se selecciona de: D-Ser, Alb; el resto en la posición 16 se selecciona de: Ser, Asp, Lys, Glu, Arg; el resto en la posición 18 es: Ala;
el resto en la posición 2 se selecciona de: Gln, Arg, Glu, Asp; el resto en la posición 21 es: Glu; el resto en la posición 23 es: Val;
el resto en la posición 24 se selecciona de: Gln, Asp, Lys, Arg, Ala; el resto en la posición 27 se selecciona de: Met, Cys, Lys, Arg, Leu; y el resto en la posición 28 se selecciona de: Asn, Arg, Lys, Glu, Ala, Glu, Asp;
y Z está ausente o es una secuencia de 1-2 unidades de aminoácidos seleccionadas del grupo que consiste en Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr y Orn; o una sal farmacéuticamente aceptable del mismo.
En algunas realizaciones, X difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys; el resto en la posición 2 se selecciona de: Gln, Arg, Glu; el resto en la posición 27 se selecciona de: Met, Cys, Lys; y el resto en la posición 28 se selecciona de: Asn, Arg, Ala.
En algunas de aquellas realizaciones, X puede diferir de la fórmula I hasta en 3 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys; y el resto en la posición 2 se selecciona de: Asn, Arg, Ala.
En realizaciones alternativas, X puede diferir de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys; el resto en la posición 18 es: Ala; y el resto en la posición 2 se selecciona de: Gln, Arg, Glu.
En realizaciones alternativas adicionales, X puede diferir de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 23 es: Val;
el resto en la posición 24 se selecciona de: Gln, Asp, Lys, Arg, Ala;
el... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto que tiene la fórmula R1-X-Z-R2 en la que
R1 es H, alquilo C-m, acetilo, formilo, benzoílo o trifluoroacetilo;
R2 es OH o NH2;
X es un péptido que tiene la fórmula I:
HIs-Ser-GIn-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-lle-Glu- Trp-Leu-Leu-Ser-Ala (SEC ID N°: 4)
o difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys, Arg; el resto en la posición 18 es: Ala;
el resto en la posición 2 se selecciona de: Gln, Arg, Glu, Asp; el resto en la posición 21 es: Glu; el resto en la posición 23 es: Val;
el resto en la posición 24 se selecciona de: Gln, Asp, Lys, Arg, Ala;
el resto en la posición 27 se selecciona de: Met, Cys, Lys;
el resto en la posición 28 se selecciona de: Asn, Arg, Lys, Ala, Glu, Asp;
y Z está ausente o es una secuencia de 1-2 unidades de aminoácidos seleccionadas del grupo que consiste en Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr y Orn; o una sal farmacéuticamente aceptable del mismo.
2. Un compuesto de acuerdo con la reivindicación 1 en el que X difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys;
el resto en la posición 2 se selecciona de: Gln, Arg, Glu;
el resto en la posición 27 se selecciona de: Met, Cys, Lys; y
el resto en la posición 28 se selecciona de: Asn, Arg, Ala.
3. Un compuesto de acuerdo con la reivindicación 2 en el que X difiere de la fórmula I hasta en 3 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Arg, Asp, Lys; y el resto en la posición 2 se selecciona de: Gln, Arg, Glu.
4. Un compuesto de acuerdo con la reivindicación 1 en el que X difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 2 se selecciona de: D-Ser, Aib; el resto en la posición 16 se selecciona de: Ser, Asp, Lys; el resto en la posición 18 es: Ala; y el resto en la posición 2 se selecciona de: Gln, Arg, Glu.
5. Un compuesto de acuerdo con la reivindicación 1 en el que el péptido X difiere de la fórmula I hasta en 4 de las siguientes posiciones, por lo cual, si es diferente de la fórmula I:
el resto en la posición 23 es: Val;
el resto en la posición 24 se selecciona de: Gln, Asp, Lys, Arg, Ala; el resto en la posición 27 se selecciona de: Met, Cys, Lys; y el resto en la posición 28 se selecciona de: Asn, Arg, Ala.
6. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que los restos en las posiciones 16 y 2, y/o 2 y 24 son capaces de formar un puente salino.
7. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que X comprende uno o más de los siguientes grupos de restos:
2-Lys, 24-Glu;
| 2-Lys, | 23-lle, 24-Glu; |
| 16-Glu, | 2-Lys, 24-Glu; |
| 16-Glu, | 2-Lys; |
| 16-Glu, | 2-Lys, 29-Ala; |
| 16-Glu, | 2-Lys, 23-lle, 24-Glu; |
| 2-Lys, | 23-lle, 24-Glu; |
| 27-Leu, | 28-Ser, 29-Ala; |
| 16-Ser; | |
| 2-Gln; | |
| 23-Val; | |
| 24-Gln; | |
| 16-Ser, | 2-Gln; |
| 16-Asp, | 2-Arg, 24-Asp; |
| 16-Lys, | 2-Glu; |
| 24-Arg; | |
| 28-Arg. |
8. Un compuesto de acuerdo con la reivindicación 1 en el que X tiene la secuencia:
HSQGTFTSDYSKYLDSRRAKDFIEWLLSA (SEC ID N°: 13);
HSQGTFTSDYSKYLDERRAQDFIEWLLSA (SEC ID N°: 5);
HSQGTFTSDYSKYLDERRAKDFVEWLLSA (SEC ID N°: 6);
HSQGTFTSDYSKYLDERRAKDFIQWLLSA (SEC ID N°: 7);
HSQGTFTSDYSKYLDSRRAQDFIEWLLSA (SEC ID N°: 8);
HSQGTFTSDYSKYLDDRRARDFIDWLLSA (SEC ID N°: 9);
HSQGTFTSDYSKYLDKRRAEDFIKWLLSA (SEC ID N°: 1);
HSQGTFTSDYSKYLDERRAKDFIRWLLSA (SEC ID N°: 11);
HSQGTFTSDYSKYLDERRAKDFIEWLLRA (SEC ID N°: 12);
HSQGTFTSDYSKYLDERAAKDFIEWLLSA (SEC ID N°: 14);
HSQGTFTSDYSKYLDERRAKDFIDWLLSA (SEC ID N°: 15);
HSQGTFTSDYSKYLDERRAKDFIEWLLAA o (SEC ID N°: 16);
HSQGTFTSDYSKYLDERRAKDFIEWLLSA (SEC ID N°: 17).
9. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que R1 es H.
1. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que R2 es NH2.
11. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que Z tiene una identidad de secuencia no superior al 25 % con la parte correspondiente de la secuencia del PI-1 de la oxlntomodulina humana que tiene la secuencia Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala.
12. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que Z tiene una Cys como resto C terminal.
13. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 1 en el Z está ausente.
14. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores en el que una o más de las cadenas laterales de aminoácidos en el compuesto, por ejemplo en el péptldo X, están conjugadas con un sustituyente lipófilo o con un resto polimérico.
15. Un ácido nucleico que codifica un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores.
16. Un vector de expresión que comprende un ácido nucleico de acuerdo con la reivindicación 15.
17. Una célula hospedadora que comprende un ácido nucleico de acuerdo con la reivindicación 15 o un vector de expresión de acuerdo con la reivindicación 16.
18. Una composición farmacéutica que comprende un compuesto, un ácido nucleico, un vector de expresión o una célula hospedadora de acuerdo con una cualquiera de las reivindicaciones anteriores, en mezcla con un vehículo farmacéuticamente aceptable.
19. El uso de un compuesto, ácido nucleico, vector de expresión o célula hospedadora de acuerdo con una cualquiera de las reivindicaciones 1 a 17 en la preparación de un medicamento para prevenir el aumento de peso, estimular la pérdida de peso, o para el tratamiento de una afección ocasionada por, o asociada con, sobrepeso corporal u obesidad, incluyendo obesidad mórbida, inflamación relacionada con obesidad, enfermedades de la vesícula billar relacionadas con la obesidad y apnea del sueño inducida por obesidad, o para el tratamiento de
resistencia a insulina, intolerancia a glucosa, diabetes de tipo 2, hipertensión, dislipidemia aterogénica, ateroesclerosis, arterieesclerosis, cardiopatía coronaria o ictus.
2. Un compuesto, ácido nucleico, vector de expresión o célula hospedadora de acuerdo con una cualquiera de las 5 reivindicaciones 1 a 17 para su uso en un método de tratamiento médico.
21. Un compuesto, ácido nucleico, vector de expresión o célula hospedadora de acuerdo con una cualquiera de las reivindicaciones 1 a 16 para su uso en un método para prevenir el aumento de peso, estimular la pérdida de peso, o para el tratamiento de una afección ocasionada por, o asociada con, sobrepeso corporal u obesidad, incluyendo
obesidad mórbida, inflamación relacionada con obesidad, enfermedad de la vesícula biliar relacionada con la obesidad y apnea del sueño inducida por obesidad, o para el tratamiento de resistencia a insulina, intolerancia a glucosa, diabetes de tipo 2, hipertensión, dislipidemia aterogénica, ateroesclerosis, arterioesclerosis, cardiopatía coronaria o ictus.
Patentes similares o relacionadas:
Agonistas del receptor de glucagón, del 24 de Junio de 2020, de ELI LILLY AND COMPANY: Un compuesto agonista del receptor de glucagón que comprende la fórmula: YX1QGTFX2SDYSKYLDX3KKAX4EFVX5WLLEX6X7 en la que X1 es Aib; X2 es T o L; X3 es Aib; […]
Profármacos de GLP-1, del 17 de Junio de 2020, de NOVO NORDISK A/S: Un compuesto de GLP-1 de la fórmula general I: R1 -(NHXaa1)-Xaa2-(OHis)-(péptido GLP-1) (Fórmula I) en donde el péptido GLP-1 es […]
Método para preparar semaglutida, del 13 de Mayo de 2020, de Hybio Pharmaceutical Co., Ltd: Método de preparación de semaglutida, que comprende las etapas de: etapa 1: acoplar Gly a una resina mediante síntesis en fase sólida para obtener Gly-resina; y […]
Coagonistas estables del receptor de GLP-1/glucagón basados en GLP-1, del 6 de Mayo de 2020, de NOVO NORDISK A/S: Un derivado de GLP-1 caracterizado por tener la fórmula: amida de Nε34-[2-[2-[2-[[2-[2-[2-[[(4S)-4-carboxi-4- [[(4S)-4-carboxi-4-(17- carboxiheptadecanoilamino)butanoil]amino]butanoil]amino]etoxi]etoxi]acetil]amino]etoxi]etoxi]acetil]- […]
Una composición para el tratamiento de la diabetes que comprende un análogo de oxintomodulina, del 11 de Marzo de 2020, de HANMI PHARM. CO., LTD.: Una composición para su uso en la prevención o el tratamiento de la diabetes, la composición comprende un conjugado de análogo de oxintomodulina como un ingrediente […]
Modificador de exenatida y uso del mismo, del 12 de Febrero de 2020, de BrightGene Bio-Medical Technology Co., Ltd: Un modificador de exenatida o sales farmacéuticamente aceptables del mismo que tienen actividad del agonista del receptor de GLP-1, como se muestra en la fórmula (I): (Ex-4)-L-Y […]
Derivados de GLP-1 doble-acilados, del 4 de Diciembre de 2019, de NOVO NORDISK A/S: Un derivado de un análogo de GLP-1, cuyo análogo comprende un primer residuo de K en una posición correspondiente a la posición 26 de GLP-1 […]
Análogos de glucagón, del 13 de Noviembre de 2019, de ZEALAND PHARMA A/S: Un compuesto que tiene la fórmula: R1-X-Z-R2 en donde R1 es H (es decir, hidrógeno), alquilo C1-4, acetilo, formilo, benzoílo o trifluoroacetilo; […]