Polvos basados en fosfolípidos para administración de fármacos.
Una composición en partículas obtenible por secado por aspersión para administración al sistema pulmonar,
comprendiendo la composición:
partículas que comprenden un fosfolípido saturado y un catión polivalente en una cantidad efectiva para incrementar la temperatura de transición de gel a cristal líquido de las partículas en comparación con partículas y en el catión polivalente en donde la relación molar del catión polivalente al fosfolípido es al menos 0.05, y un agente activo, y en donde el diámetro de partícula geométrico medio de la composición en partículas es menos de 5 μm.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/014703.
Solicitante: NOVARTIS AG.
Inventor/es: SCHUTT, ERNEST G., WEERS, JEFFRY, G., TARARA, THOMAS, E., DELLAMARY, LUIS, A., RIESS, JEAN, G.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/29 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona paratiroidea (paratormona); Péptidos derivados de la hormona paratiroidea.
- A61K47/02 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos inorgánicos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/10 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
- A61K9/127 A61K 9/00 […] › Liposomas.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
- A61M15/00 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › Inhaladores.
PDF original: ES-2525087_T3.pdf
Fragmento de la descripción:
Polvos basados en fosfolípidos para administración de fármacos Campo de la invención La presente invención se relaciona con composiciones en partículas adecuadas para administración de fármacos, preferiblemente a través de inhalación. En particular, la presente invención provee composiciones en partículas que contienen fosfolípidos que comprenden un catión polivalente. Las composiciones en partículas de la presente invención exhiben temperaturas de transición de gel a cristal líquido incrementadas dando como resultado una dispersabilidad mejorada y estabilidad en el almacenamiento.
Antecedentes de la invención Los fosfolípidos son componentes principales de las membranas celulares y de los organelos, lipoproteínas de la sangre y surfactantes de los pulmones. En términos de administración de fármacos pulmonares, los fosfolípidos han sido investigados como agentes terapéuticos para el tratamiento de síndromes de distensión respiratoria (esto es, surfactantes pulmonares exógenos) , y como excipientes adecuados para la administración de ingredientes activos. La interacción de fosfolípidos con agua es crítica para la formación, mantenimiento y función de cada una de estos complejos biológicos importantes (McIntosh y Magid) . A temperaturas bajas en la fase de gel, las cadenas acilo están en un estado bien ordenado conformacionalmente, esencialmente en la configuración todo trans. A temperaturas más altas, por encima de la temperatura de fusión de la cadena, este orden de cadena se pierde, obedeciendo a un incremento en el contenido de conformación izquierda (Seddon y Cevc) .
Se han comercializado varios surfactante pulmonares exógenos que incluyen productos derivados de pulmones bovinos (Survanta®, Abbott Laboratories) , pulmones porcinos (CuroSurf®, Dey Laboratories) , o surfactantes completamente sintéticos sin apoproteínas, por ejemplo, ALEC®, ExoSurf® Glaxo Wellcome) . Hasta la fecha, esto productos han sido utilizados para el tratamiento de síndrome de distensión respiratoria en infantes (IRDS) . Ninguno ha sido exitoso en recibir la aprobación de la FDA para tratamiento de síndrome de distensión respiratoria en adultos (ARDS) . La dosis infantil actual es 100 mg/kg. Para un adulto de 50 kg, esto se traduciría en una dosis de 5
g. Una dosis de esta cantidad puede ser administrada solamente a pacientes de ARDS por instilación directa en el tubo endotraqueal del paciente, o posiblemente a través de nebulización de dispersiones acuosas del material surfactante.
La instilación de surfactantes lleva a la deposición primariamente en las vías respiratorias centrales y solo una pequeña cantidad del fármaco llega hasta los alvéolos, donde se requiere mejorar el intercambio gaseoso en estos pacientes críticamente enfermos. La nebulización del surfactante puede permitir una administración periférica mayor, pero está plagada por el hecho de que (a) los nebulizadores actuales son dispositivos ineficientes y solamente cerca del 10% del fármaco alcanza realmente los pulmones de los pacientes; (b) las soluciones surfactantes forman espuma durante el proceso de nebulización, llevando a complicaciones y a pérdidas adicionales de fármaco. Se cree que tanto como el 99% del surfactante administrado puede ser desperdiciado debido a una pobre administración al paciente. Si se pudiera lograr una administración más efectiva del surfactante, es probable que la dosis administrada y el coste del tratamiento de las ARDS podría disminuirse dramáticamente.
Adicionalmente, los surfactantes pulmonares han demostrado modular el transporte en mucosas en las vías respiratorias. En este aspecto, se ha sugerido la administración crónica de surfactante para el tratamiento de pacientes con enfermedad pulmonar obstructiva crónica (COPD) . Todavía otras indicaciones con dosis significativamente inferiores pueden abrirse al tratamiento si estuviese disponible una forma en polvo seco de un surfactante pulmonar. La formulación de surfactante pulverizado pueda ser puramente sintética (esto es, sin apoproteínas agregadas) . Alternativamente, la formulación en polvo debía contener las apoproteínas hidrófobas SP-B o SP-C o alternativamente imitadores peptídicos recombinantes o sintéticos (por ejemplo KL4) .
Debido a sus características de dispersión sobre los epitelios pulmonares, se han propuesto surfactantes como vehículos ideales para la administración de fármacos al pulmón, y a través del pulmón a la circulación sistémica. Una vez de nuevo es importante alcanzar una administración eficiente al pulmón, especialmente a la luz del alto coste potencial de muchos de los productos actuales. Una forma potencial de administrar fármacos en fosfolípidos es un polvo seco en forma de aerosol al pulmón. La mayor parte de los polvos finos (< 5 μm) exhibe pobre dispersabilidad. Esto puede ser problemático cuando se intenta administrar, formar un aerosol y/o empacar los polvos.
Las fuerzas principales que controlan las interacciones partícula-partícula pueden dividirse en fuerzas de rango corto y largo. Las fuerzas de rango largo incluyen fuerzas atrayentes gravitacionales y electrostáticas, en donde la interacción varía según el cuadrado de la distancia de separación. Las fuerzas de atracción de rango corto dominan los polvos secos e incluyen interacciones de van der Waals, puentes de hidrógeno y puentes líquidos. Los puentes líquidos ocurren cuando las moléculas de agua son capaces de enlazar irreversiblemente las partículas entre sí.
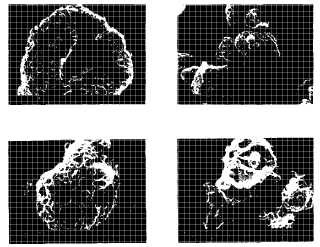
Los fosfolípidos son especialmente difíciles de formular como polvos secos debido a que sus bajos valores de temperatura de transición de gel a cristal líquido (Tm) y su naturaleza amoría llevan a polvos que son muy pegajosos y difíciles de desagregar y formar en aerosol. Los fosfolípidos con valores Tm menores de 10º C (por ejemplo PC de huevo o cualquier lípido insaturado) forman polvos altamente cohesivos después del secado por aspersión. La inspección de los polvos a través de microscopia electrónica de barrido revela partículas altamente aglomeradas con superficies que parecen estar fundidas/fusionadas. La formulación de polvos de fosfolípidos que tiene Tm bajos es problemática, especialmente si se espera alcanzar una cierta morfología de partícula, como es en el caso de la administración por aerosol. Así, será ventajosa encontrar maneras de elevar el Tm de estos lípidos. Ejemplos de composiciones en partículas que incorporan un surfactante están divulgadas en las publicaciones PCT WO 99/16419, WO 99/38493, WO 99/66903, WO 00/10541, y la Patente de los Estados Unidos No. 5, 855, 913.
Actualmente, se suministra surfactante pulmonar a pacientes intubándolos e instilando una suspensión de un surfactante pulmonar directamente en los pulmones. Este es un procedimiento altamente invasivo que generalmente no se lleva a cabo en pacientes conscientes y como la mayoría de los procedimientos, conlleva sus propios riesgos. Las aplicaciones potenciales de surfactantes pulmonares más allá de la indicación actual de síndrome de distensión respiratoria en neonatos están limitadas grandemente por este método de administración. Por ejemplo, el surfactante pulmonar puede ser útil en una variedad de estados de enfermedad que son, en parte, debidos a la presencia disminuida de surfactantes pulmonares en los pulmones. Las Patentes de los Estados Unidos Nos. 5, 451, 569, 5, 698, 537, y 5, 925, 337, y las publicaciones PCT WO 97/26863 y WO 00/27360, por ejemplo, divulgan la administración pulmonar de surfactantes pulmonares para tratar diversas condiciones. Enfermedades que se cree posiblemente son agravadas por deficiencia en surfactantes pulmonares incluyen fibrosis quística, enfermedad pulmonar obstructiva crónica y asma, para nombrar solo unas pocas. La administración de surfactante pulmonar exógeno, de forma tópica, a pacientes que sufren de estas enfermedades pueden mejorar ciertos signos y síntomas de las enfermedades. Para condiciones crónicas, la administración regular (una o más veces por día en una base prolongada) de un surfactante pulmonar a través de entubación e instilación a pacientes ambulatorios en impráctica. Adicionalmente, debido a su alta actividad superficial, las suspensiones de surfactantes pulmonares no son adecuadas para nebulización debido a la formación de espuma. La administración actual de preparaciones basadas en fosfolípidos por instilación o nebulización es altamente eficiente en la administración de material al pulmón periférico. Por lo tanto, la capacidad de administrar surfactantes pulmonares a pacientes a través de inhalación en polvo seria una ventaja tremenda sobre el método actual, puesto que evitaría la necesidad de intubación, expandiendo por los... [Seguir leyendo]
Reivindicaciones:
1. Una composición en partículas obtenible por secado por aspersión para administración al sistema pulmonar, comprendiendo la composición:
partículas que comprenden un fosfolípido saturado y un catión polivalente en una cantidad efectiva para incrementar la temperatura de transición de gel a cristal líquido de las partículas en comparación con partículas y en el catión polivalente en donde la relación molar del catión polivalente al fosfolípido es al menos 0.05, y un agente activo, y en donde el diámetro de partícula geométrico medio de la composición en partículas es menos de 5 μm.
2. Una composición en partículas de acuerdo con la reivindicación 1 en donde dicha temperatura de transición de gel a cristal líquido es superior a la temperatura de almacenamiento para dicha composición en al menos 20º C.
3. Una composición en partículas de acuerdo con la reivindicación 2 en donde dicha temperatura de transición de gel a cristal líquido es mayor que la temperatura de almacenamiento para dicha composición en al menos 40º C.
4. Una composición en partículas de acuerdo con cualquiera de las reivindicaciones 1 a 3 que comprende adicionalmente un surfactante seleccionado del grupo consistente de detergentes no iónicos, copolímeros de bloque no iónicos, surfactantes iónicos y combinaciones de los mismos.
5. Una composición en partículas de acuerdo con la reivindicación 4 en donde el surfactante es seleccionado del grupo consistente de ésteres de sorbitano, ésteres de sorbitano etoxilado, ácidos grasos, sales, ésteres de azúcares, óxidos de etileno y combinaciones de los mismos.
6. Una composición en partículas de acuerdo con cualquiera de las reivindicaciones 1 a 5 en donde el catión polivalente es un catión divalente.
7. Una composición en partículas de acuerdo con la reivindicación 6 en donde el catión divalente es seleccionado del grupo consistente de calcio, magnesio o zinc.
8. Una composición en partículas de acuerdo con cualquiera de las reivindicaciones 1 a 7 en donde la relación molar de catión divalente a fosfolípido es 0.05 – 2.0.
9. Una composición en partículas de acuerdo con cualquiera de las reivindicaciones 1 a 7 en donde la relación molar de catión divalente a fosfolípido es 0.25 – 1.0.
10. Una composición en partículas de acuerdo con la reivindicación 9 en donde el catión divalente es calcio.
11. Una composición en partículas de acuerdo con la reivindicación 10 en donde la relación molar de calcio a fosfolípido es aproximadamente 0.50.
12. Una composición en partículas de acuerdo con la reivindicación 1 en donde el fosfolípido comprende un surfactante pulmonar natural o sintético.
13. Una composición en partículas de acuerdo con la reivindicación 1 en donde el agente activo es seleccionado del grupo consistente de nicotina, hormona de crecimiento humana, hormona paratiroide, leuprolide, budesonide, tobramicina, albuterol y sales de los mismos.
14. Una composición en partículas de acuerdo con cualquiera de las reivindicaciones 1 a 13 que comprende adicionalmente un polímero seleccionado del grupo consistente de polisacáridos, alcohol polivinílico, polivinilpirrolidona, poililáctidos, poliglicólidos, polietilen glicol o mezclas de los mismos.
15. Una composición en partículas de acuerdo con la reivindicación 1 en donde las partículas comprenden un diámetro aerodinámico de menos de 10 μm.
16. Una composición en partículas de acuerdo con la reivindicación 15 en donde el diámetro aerodinámico está dentro de 0.5 – 5 μm.
17. Una composición en partículas de acuerdo con la reivindicación 1 que comprende una dosis emitida definida como la relación de la dosis administrada por un dispositivo inhalador a la masa de polvo por unidad de dosis colocada en el dispositivo inhalador antes de disparar de al menos de 40%.
18. Una composición en partículas de acuerdo con la reivindicación 1 que comprende adicionalmente un medio de suspensión no acuoso.
19. Una composición en partículas de acuerdo con la reivindicación 1 que comprende adicionalmente un excipiente seleccionado del grupo consistente de aminoácidos, carbohidratos, sales inorgánicas, sales orgánicas, ácidos carboxílicos y mezclas de los mismos.
20. Una composición en partículas de acuerdo con la reivindicación 19 en donde el excipiente es seleccionado del
grupo consistente de aminoácidos hidrófobos, monosacáridos, disacáridos, polisacáridos, citrato de sodio, ácido cítrico, carbonato de amonio, acetato de amonio y cloruro de amonio.
21. Una composición en partículas de acuerdo con la reivindicación 1 en donde la composición es un polvo con una densidad en volumen de menos de 0.5 g/cm3.
22. Una composición en partículas de acuerdo con la reivindicación 1, en donde el fosfolípido saturado comprende 10 una fosfatidilcolina.
23. Una composición en partículas de acuerdo con la reivindicación 22 en donde el fosfolípido comprende dipalmitoilfosfatidilcolina o diestearoilfosfatidilcolina.
24. Una composición en partículas de acuerdo con la reivindicación 1 que comprende:
partículas biodegradables que comprenden un fosfolípido y un catión polivalente, en donde la composición 15 comprende una temperatura de transición Tm de gel a líquido y una temperatura de almacenamiento Ts en donde Tm es mayor que Ts en al menos 20º C.
25. Un método para producir una composición en partículas de acuerdo con la reivindicación 1, comprendiendo dicho método:
agregar un catión polivalente a una formulación que comprende un fosfolípido;
secar por aspersión dicha formulación para formar una composición en partículas seca.
26. Un método de acuerdo con la reivindicación 25, en donde el proceso de secado por aspersión comprende agregar un agente de soplado a la materia prima.
Patentes similares o relacionadas:
 Inhalador, del 29 de Julio de 2020, de Norton (Waterford) Limited: Un módulo electrónico para un inhalador , comprendiendo el módulo electrónico:
una tapa del módulo electrónico que comprende una guía […]
Inhalador, del 29 de Julio de 2020, de Norton (Waterford) Limited: Un módulo electrónico para un inhalador , comprendiendo el módulo electrónico:
una tapa del módulo electrónico que comprende una guía […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Inhalador de polvo seco de dosis única, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco que comprende:
un alojamiento con una parte de alojamiento inferior para formar por […]
Inhalador de polvo seco de dosis única, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco que comprende:
un alojamiento con una parte de alojamiento inferior para formar por […]
 Inhalador, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Inhalador para la inhalación de una formulación desde un soporte preferentemente en forma de banda, en forma de tira, a modo de blíster […]
Inhalador, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Inhalador para la inhalación de una formulación desde un soporte preferentemente en forma de banda, en forma de tira, a modo de blíster […]
Inhalador de polvo seco, del 29 de Julio de 2020, de Iconovo AB: Inhalador de polvo seco con un extremo distal y un extremo proximal, comprendiendo el inhalador de polvo seco: por lo menos una entrada […]
Inhalador de polvo seco que comprende un mecanismo de bloqueo, del 22 de Julio de 2020, de Iconovo AB: Inhalador de medicamento en polvo seco para medir una inhalación de un medicamento en polvo seco, que comprende: por lo menos una entrada […]
Pulverizador de aerosol aséptico, del 22 de Julio de 2020, de JOHNSON & JOHNSON CONSUMER INC: Un dispositivo de pulverización portátil (también llamado 'pulverizador', 'nebulizador' o 'atomizador') que comprende un armazón que incluye una […]
Dispositivo dispensador de doble cámara, del 1 de Julio de 2020, de Cambium Medical Technologies LLC: Un dispositivo dispensador de un solo uso que comprende: una cámara seca que comprende material liofilizado; una cámara húmeda […]