Método para la producción de conjugados de factor I de crecimiento similar a la insulina y polietilenglicol.
Método para la producción de un IGF-I o variante de IGF-I PEGilado en las lisinas,
comprendiendo dicha varianteuno o dos aminoácidos seleccionados de entre el grupo que consiste de lisina 27, 65 y/o 68 sustituidosindependientemente por otro aminoácido polar, caracterizado porque:
a) se cultiva una célula huésped procariótica que comprende un vector de expresión que comprende un ácidonucleico codificante de una proteína de fusión que comprende dicho IGF-I o variante de IGF-I unido Nterminalmenteal extremo C-terminal de un propéptido, en el que Gly-Pro son los dos primeros aminoácidos deIGF-I,
b) en el que dicho propéptido termina C-terminalmente con aminoácidos -Y-Pro, en donde Y se selecciona deentre el grupo que consiste de Pro, Pro-Ala, Arg-Pro o Pro-Arg-Pro,
c) se recupera y PEGila dicha proteína de fusión,
d) se corta dicha proteína de fusión PEGilada con IgA proteasa, en el que dicha IgA proteasa presenta lasecuencia SEC ID nº 26, y
e) se recupera dicho IGF-I o variante de IGF-I PEGilado.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/007540.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL SUIZA.
Inventor/es: LANG, KURT, SCHANTZ, CHRISTIAN, FISCHER, STEPHAN, SCHAUBMAR,ANDREAS, HESSE,FRIEDERIKE, REGULA,Joerg Thomas, METZGER,FRIEDRICH, KNOETGEN,HENDRIK, SCHOENFELD,HANS JOACHIM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
- C07K14/65 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de crecimiento de tipo insulina (Somatomedinas), p. ej. IGF-1, IGF-2.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N9/52 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › que provienen de bacterias.
PDF original: ES-2397660_T3.pdf
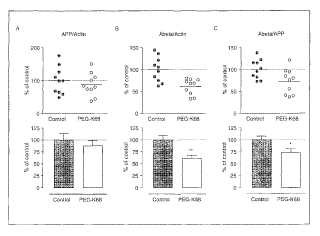
Fragmento de la descripción:
Método para la producción de conjugados de factor I de crecimiento similar a la insulina y polietilenglicol
La presente invención se refiere a métodos para la producción de conjugados de factor I de crecimiento similar a la insulina (IGF-I) con polietilenglicol (PEG) , a composiciones farmacéuticas que contienen dichos conjugados y a métodos de utilización de dichos conjugados.
Antecedentes de la invención La enfermedad de Alzheimer (EA) es una forma crecientemente prevalente de neurodegeneración que explica aproximadamente 50% a 60% de los casos totales de demencia entre personas de más de 65 años. Se estima que actualmente afecta a 15 millones de personas en todo el mundo y debido al relativo incremento de personas de edad avanzada en la población, es probable que se incremente su prevalencia en las próximas 2 a 3 décadas. La EA es un trastorno progresivo con una duración media de aproximadamente 8, 5 años desde la aparición de los síntomas clínicos hasta la muerte. La muerte de neuronas piramidales y la pérdida de sinapsis neuronales en regiones cerebrales asociadas a funciones mentales superiores resulta en los síntomas típicos de alteraciones gruesas y progresivas de la función cognitiva (Francis P.T. et al., J. Neurol. Neurosurg. Psychiatr y 66:137-147, 1999) . La EA es la forma más común de demencia tanto senil como presenil y se reconoce clínicamente como demencia inexorablemente progresiva que se presenta con pérdida creciente de la memoria, de la función intelectual y alteraciones del habla (Merritt, A Textbook of Neurology, 6a edición, Lea & Febiger, Philadelphia, 1979, páginas 484 a 489) . Neuropatológicamente las características principales de la EA son la presencia de dos lesiones típicas: las placas seniles de amiloide y los ovillos neurofibrilares (ONF) . Mientras que las placas se depositan en el exterior de las neuronas, los ovillos se observan en el interior de las mismas en el cerebro post mortem. Uno de los componentes principales del núcleo de las placas amiloides es el péptido de pequeñas dimensiones beta-amiloide (ºA) depositado patológicamente, el cual es cortado por secretasas a partir de la proteína precursora amiloide (PPA) (Selkoe D.J., Physiol. Rev. 81:741-766, 2001; Hardy J. y Selkoe D.J., Science 297:353-356, 2002; Bush A.I. y Tanzi R.E., Proc. Natl. Acad. Sci. USA 99:7317-7319, 2002) . El ºA es un péptido autoagregante de 39 a 43 residuos (PM ~4 kDa) sintetizado como parte del péptido de mayor tamaño PPA (110 a 120 kDa) . El PPA es una glucoproteína integral de membrana de tipo I con un dominio extracelular N-terminal de gran tamaño, un único dominio transmembranal y una cola citoplasmática corta. La región ºA abarca partes de los dominios extracelular y transmembranal del PPA. La hipótesis más habitual sobre la participación del PPA en la muerte de las células neuronales en la EA es la hipótesis del amiloide. Esta hipótesis postula que los depósitos de placa amiloide o de ºA soluble parcialmente agregado desencadenan una cascada neurotóxica, provocando de esta manera una neurodegeneración similar a la patología de la EA (Selkoe D.J., Physiol. Rev. 81:741-766, 2001; Hardy J. y Selkoe D.J., Science 297:353-356, 2002) .
El factor I de crecimiento similar a la insulina (IGF-I) humano es una hormona circulante estructuralmente relacionada con la insulina. IGF-I ha sido considerado tradicionalmente como el principal mediador de las acciones de la hormona del crecimiento sobre los tejidos periféricos. IGF-I consiste de 70 aminoácidos y también se denomina somatomedina C y ha sido definido como SwissProt nº P01343. El uso, actividad y producción se mencionan en, por ejemplo, le Bouc Y. et al., FEBS Lett. 196:108-112, 1986; de Pagter-Holthuizen P. et al., FEBS Lett. 195:179-184, 1986; Sandberg Nordqvist A.C. et al., Brain Res. Mol. Brain Res. 12:275-277, 1992; Steenbergh P.H. et al., Biochem. Biophys. Res. Commun. 175:507-514, 1991; Tanner J.M. et al., Acta Endocrinol. (Copenh.) 84:681-696, 1977; Uthne K. et al., J. Clin. Endocrinol. Metab. 39:548-554, 1974; patentes EP nº 0 123 228 y nº 0 128 733, US nº 5.861.373, US nº 5.714.460, EP nº 0 597 033, WO 02/32449 y WO nº 93/02695.
La regulación de la función del IGF-I es bastante compleja. En circulación, sólo el 0, 2% de IGF-I existe en forma libre, mientras que la mayor parte se encuentra unida a proteínas de unión a IGF (IGFBP) , que presentan afinidades muy elevadas para los IGF y que modulan la función del IGF-I. El factor puede ser liberado localmente mediante mecanismos que liberan IGF-I, tales como la proteolisis de las IGFBP por proteasas.
El IGF-I desempeña un papel paracrino en el cerebro en desarrollo y maduro (Werther G.A. et al., Mol. Endocrinol. 4:773-778, 1990) . Los estudios in vitro indican que IGF-I es un potente agente trófico no selectivo para varios tipos de neuronas en el SNC (Knusel B. et al., J. Neurosci. 10:558-570, 1990; Svrzic D. y Schubert D., Biochem. Biophys. Res. Commun. 172:54-60, 1990) , incluyendo las neuronas dopaminérgicas (Knusel B. et al., J. Neurosci. 10:558570, 1990) y los oligodendrocitos (McMorris F.A. y Dubois-Dalcq M., J. Neurosci. Res. 21:199-209, 1988; McMorris F.A. et al., Proc. Natl. Acad. Sci. USA 83:822-826, 1986; Mozell R.L. y McMorris F.A., J. Neurosci. Res. 30:382-390, 1991) . La patente US nº 5.093.317 menciona que la supervivencia de las células neuronales colinérgicas resulta incrementada por la administración de IGF-I. Es conocido además que IGF-I estimula la regeneración de los nervios periféricos (Kanje M. et al., Brain Res. 486:396-398, 1989) y que incrementa la actividad de la ornitina descarboxilasa (patente US nº 5.093.317) . Las patentes US nº 5.861.373 y WO nº 93/02695 mencionan un método para tratar lesiones o enfermedades del sistema nervioso central que afectan predominantemente a las células
gliales y/o a las células neuronales no colinérgicas mediante el incremento de la concentración o concentraciones activas de IGF-I y/o análogos del mismo en el sistema nervioso central del paciente. La patente WO nº 02/32449 se refiere a métodos para reducir o prevenir el daño isquémico en el sistema nervioso central de un mamífero mediante la administración en la cavidad nasal del mamífero de una composición farmacéutica que comprende una cantidad terapéuticamente efectiva de IGF-I o de un derivado biológicamente activo del mismo. El IGF-I o variante del mismo resulta absorbido en la cavidad nasal y transportado al sistema nervioso central del mamífero en una cantidad efectiva para reducir o prevenir el daño isquémico asociado a un suceso isquémico. La patente EP nº 0 874 641 reivindica la utilización de un IGF-I o un IGF-II para la preparación de un medicamento destinado al tratamiento o prevención del daño neuronal en el sistema nervioso central, debido a demencia relacionada con el SIDA, EA, enfermedad de Parkinson, enfermedad de Pick, enfermedad de Huntington, encefalopatía hepática, síndromes ganglionares corticales-basales, demencia progresiva, demencia familiar con paraparesia espástica, parálisis supranuclear progresiva, esclerosis múltiple, esclerosis cerebral de Schilder o encefalomielitis hemorrágica necrotizante, en las que el medicamento se encuentra en una forma destinada a la administración parenteral de una cantidad efectiva de dicho IGF fuera de la barrera hematocefálica o de la barrera hematomedular.
La reducción de los niveles cerebrales y séricos de IGF-I libre se ha relacionado con la patogénesis de las formas esporádicas y hereditarias de EA. Además, IGF-I protege a las neuronas frente a la neurotoxicidad inducida por A (Niikura T. et al., J. Neurosci. 21:1902-1910, 2001; Dore S. et al., Proc. Natl. Acad. Sci. USA 94:4772-4777, 1997; Dore S. et al., Ann. NY Acad. Sci. 890:356-364, 1999) . Recientemente se ha demostrado que el IGF-I administrado periféricamente es capaz de reducir los niveles cerebrales de ºA en ratas y ratones (Carro E. et al., Nat. Med. 8:1390-1397, 2002) . Además, el estudio ha demostrado que en un modelo de ratón transgénico de la EA, el tratamiento prolongado de IGF-I reduce significativamente la carga de placas amiloides en el cerebro. Estos datos proporcionan fuerte soporte a la idea de que el IGF-I es capaz de reducir los niveles cerebrales de ºA y la demencia cerebral asociada a las placas mediante la eliminación del A en el cerebro.
La modificación covalente de proteínas con polietilenglicol (PEG) ha demostrado ser un método útil para extender las vidas medias circulantes de las proteínas en el cuerpo (Hershfield MS. et al., N. Engl. J. Med. 316:589-596, 1987; Meyers F.J. et al., Clin. Pharmacol. Ther. 49:307-313, 1991; Delgado C. et al., Crit. Rev. Ther. Drug Carrier Syst. 9:249-304, 1992; Katre, Advanced Drug Deliver y Reviews 10:91-114,... [Seguir leyendo]
Reivindicaciones:
1. Método para la producción de un IGF-I o variante de IGF-I PEGilado en las lisinas, comprendiendo dicha variante uno o dos aminoácidos seleccionados de entre el grupo que consiste de lisina 27, 65 y/o 68 sustituidos independientemente por otro aminoácido polar, caracterizado porque:
a) se cultiva una célula huésped procariótica que comprende un vector de expresión que comprende un ácido nucleico codificante de una proteína de fusión que comprende dicho IGF-I o variante de IGF-I unido Nterminalmente al extremo C-terminal de un propéptido, en el que Gly-Pro son los dos primeros aminoácidos de IGF-I, b) en el que dicho propéptido termina C-terminalmente con aminoácidos -Y-Pro, en donde Y se selecciona de entre el grupo que consiste de Pro, Pro-Ala, Arg-Pro o Pro-Arg-Pro, c) se recupera y PEGila dicha proteína de fusión, d) se corta dicha proteína de fusión PEGilada con IgA proteasa, en el que dicha IgA proteasa presenta la secuencia SEC ID nº 26, y e) se recupera dicho IGF-I o variante de IGF-I PEGilado.
2. Método según la reivindicación 1, caracterizado porque el propéptido está representado por la fórmula:
Met-X1-Hisn-X2-Y-Pro-, en la que:
• Met es metionina,
• X1 es un enlace, serina o asparagina,
• His es histidina,
• n es un número entre 0 y 10,
• X2 es un péptido conector, seleccionado de entre el grupo que consiste de los péptidos SEC ID nº 6-10,
• Pro es prolina, y
• Y se selecciona de entre el grupo que consiste de Pro, Pro-Ala, Arg-Pro o Pro-Arg-Pro.
3. Método según las reivindicaciones 1 a 2, caracterizado porque el propéptido no comprende un residuo de lisina.
4. Método según las reivindicaciones 1 a 3, caracterizado porque dicho aminoácido o aminoácidos polares son, independientemente, arginina, glutamina o asparagina.
5. Método según las reivindicaciones 1 a 4, caracterizado porque la variante de IGF-I PEGilada en las lisinas se encuentra monoPEGilada o diPEGilada en los residuos de lisina 65 y 68.
6. Método según la reivindicación 5, caracterizado porque la variante de IGF-I PEGilada en las lisinas porta los aminoácidos R27, R65, K68 (RRK) y dicha variante se encuentra monoPEGilada en el residuo de lisina 68 o la variante de IGF-I PEGilada en las lisinas porta los aminoácidos R27, K65, R68 (RKR) y dicha variante se encuentra monoPEGilada en el residuo de lisina 65.
7. Método según la reivindicación 5, caracterizado porque la variante de IGF-I PEGilada en las lisinas porta los aminoácidos R27, K65, K68 (RKK) y dicha variante se encuentra monoPEGilada o diPEGilada en los residuos de lisina 65 y 68.
8. Método según la reivindicación 5, caracterizado porque la variante de IGF-I PEGilada en las lisinas es una mezcla de una variante que porta los aminoácidos R27, R65, K68 (RRK) , una variante que porta los aminoácidos R27, K65, R68 (RKR) o una variante que porta los aminoácidos R27, K65, K68 (RKK) y dicha variante se encuentra monoPEGilada o diPEGilada en el residuo o residuos de lisina 65 y 68.
9. Método según las reivindicaciones 1 a 4, caracterizado porque la variante de IGF-I PEGilada en las lisinas se encuentra monoPEGilada o diPEGilada.
10. Método según las reivindicaciones 1 a 9, caracterizado porque dicho PEG presenta un peso molecular global de entre 20 y 100 kDa.
11. Método según las reivindicaciones 1 a 10, caracterizado porque el grupo o grupos polietilenglicol son grupos polietilenglicol ramificados.
12. Proteína de fusión que comprende un IGF-I o variante de IGF-I PEGilado en las lisinas, comprendiendo dicha
variante uno o dos aminoácidos seleccionados de entre el grupo que consiste de las lisinas 27, 65 y/o 68 sustituidas independientemente por otro aminoácido polar, unido N-terminalmente con el extremo C-terminal de un propéptido, en el que Gly-Pro son los primeros dos aminoácidos de IGF-I, caracterizado porque dicho propéptido finaliza Cterminalmente con los aminoácidos -Y-Pro, en el que Y se selecciona de entre el grupo que consiste de Pro, Pro-Ala, Arg-Pro o Pro-Arg-Pro.
13. Proteína de fusión según la reivindicación 12, caracterizada porque dicho propéptido presenta una longitud de hasta 30 aminoácidos.
14. Proteína de fusión según la reivindicación 12 ó 13, caracterizada por la fórmula:
Met-X1-HiSn-X2-Y-Pro-[IGF-I o variante de IGF-I],
en la que:
• IGF-I se refiere a IGF-I humano y variante de IGF-I se refiere a IGF-I en el que uno o dos aminoácidos seleccionados de entre el grupo que consiste de las lisinas 27, 65 y/o 68 han sido sustituidas independientemente por otro aminoácido polar,
• Met es metionina,
• X1 es un enlace, serina o asparagina,
• His es histidina,
• n es un número entre 0 y 10,
• X2 es un péptido conector, seleccionado de entre el grupo que consiste de los péptidos SEC ID nº 6-10,
• Pro es prolina, y
• Y se selecciona de entre el grupo que consiste de Pro, Pro-Ala, Arg-Pro o Pro-Arg-Pro.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]