Promotores específicos de cáncer.
Un constructo polinucleotídico que comprende una secuencia de control específica de cáncer de mama,
comprendiendo dicha secuencia de control una porción seleccionada del promotor de topoisomerasa IIα o unaporción seleccionada del receptor de transferrina, y comprendiendo adicionalmente una secuencia de amplificacióntranscripcional en dos etapas (TSTA), incluyendo dicha secuencia de TSTA un dominio de unión a ADN y undominio de activación, y comprendiendo el elemento regulador postranscripcional del virus de la hepatitis demarmota (WPRE).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/011067.
Solicitante: BOARD OF REGENTS THE UNIVERSITY OF TEXAS SYSTEM.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 201 WEST 7TH STREET 7TH FLOOR AUSTIN, TX 78701 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HUNG, MIEN-CHIE, LI,ZHENG, DAY,Chi-Ping, RAU,Kun-Ming, XIE,Xiaoming.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C07K14/705 C07 […] › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C07K14/82 C07K 14/00 […] › Productos de traducción de oncogenes.
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/10 C12N 15/00 […] › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- C12N9/22 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Ribonucleasas.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2385492_T3.pdf
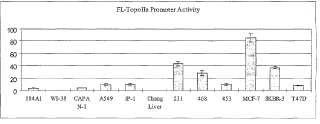
Fragmento de la descripción:
Promotores específicos de cáncer
Campo de la invención
La presente invención está dirigida a los campos de la biología celular, biología molecular, biología del cáncer y 5 medicina. Más particularmente, la presente invención se refiere a secuencias reguladoras específicas de cáncer para la regulación de la expresión de un polinucleótido terapéutico útil para la terapia del cáncer.
Antecedentes de la invención
La capacidad de controlar la expresión de polinucleótidos particulares tras transferencia génica es una función útil, particularmente para aplicaciones en que se desea una actividad localizada específica. Este es el caso del cáncer, 10 en que es prudente confinar los productos génicos destructivos o letales a las células cancerosas, evitando al menos en parte dicha actividad en células normales.
Expresión específica de tejido de cáncer de mama
Las terapias actuales de cáncer de mama, tales como quimioterapia (QT) y radioterapia, tienen una baja selectividad por las células tumorales y efectos secundarios para los tejidos normales. Para minimizar los efectos secundarios, 15 estas terapias se administran generalmente de manera intermitente, permitiendo recuperarse a las células normales entre los ciclos de tratamiento. Sin embargo, durante el periodo de recuperación, algunas células cancerosas supervivientes se vuelven más resistentes al tratamiento debido a mutaciones genéticas. Por consiguiente, puede aparecer la recurrencia o progresión del cáncer. La terapia génica orientada a tumor minimiza los efectos secundarios del tratamiento y el riesgo de desarrollar resistencia al actuar sobre rutas de señalización específicas de tumor.
Un promotor específico de cáncer de mama descrito en la presente memoria comprende porciones seleccionadas del gen de topoisomerasa IIα. Aunque la región flanqueante 5’ del gen de topoisomerasa IIα es conocida desde hace algún tiempo (Hochhauser et al., 1992) , no se ha demostrado que una región activa particular descrita en la presente memoria fuera útil para tejido de cáncer de mama, siquiera ligada con potenciador de citomegalovirus (Mo et al.,
25 1998) .
Otro promotor específico de cáncer de mama descrito en la presente memoria comprende porciones seleccionadas del promotor de receptor de transferrina. La expresión del receptor de transferrina se ha localizado en tejido de mama (Fuernkranz et al., 1991; Shterman et al., 1991) y en cáncer de mama (Bauman et al., 1997; Shindelman et al., 1981) , pero no se ha dado a conocer una región particular que proporcione dicha actividad.
30 Expresión específica de tejido de cáncer de próstata
Se han desarrollado recientemente promotores específicos de próstata tales como PSA, probasina y hK2. Las actividades de estos promotores son dependientes de andrógeno y el uso de vectores sensibles a andrógeno para dirigir la expresión de genes terapéuticos a tejido prostático es útil para numerosas etapas de la enfermedad. Aunque dichos promotores específicos de próstata sensibles a receptor de andrógeno se han desarrollado por los 35 presentes inventores (Xie et al., Cancer Res. 2001) y otros grupos (Zhang et al., Mol. Endocrinol. 2000) , estos promotores dependientes de andrógeno pueden ser menos activos después de castración o terapia de ablación androgénica, que son las modalidades principales de tratamiento de cáncer de próstata progresivo. En los pacientes tratados con composiciones que comprenden estos promotores, este tipo de terapia puede fracasar y morir de cáncer de próstata independiente de andrógeno (CPIA) recurrente. Falta en la técnica un promotor novedoso para terapia génica de cáncer de próstata que sea activo tanto en CPDA como en CPIA para tratar el cáncer de próstata refractario a hormonas metastásico y recurrente.
Expresión específica de tejido de cáncer pancreático
El cáncer pancreático es una de las malignidades humanas más agresivas y la quinta causa de muerte por cáncer, dado que no están disponibles modalidades eficaces. La presente invención se enfrenta a dicha necesidad 45 proporcionando un promotor eficaz para regular la expresión de un polinucleótido terapéutico específicamente en células de cáncer pancreático.
Breve sumario de la invención
La presente invención proporciona promotores específicos de tejido novedosos para la regulación de la expresión de un polinucleótido terapéutico. Estas composiciones y procedimientos terapéuticos que las utilizan son útiles para el 50 tratamiento del cáncer, y un especialista en la materia reconocerá que cualquier medio adicional en el arsenal para combatir el cáncer es beneficioso para la salud pública.
En particular, la invención proporciona composiciones, tales como composiciones terapéuticas, y procedimientos de uso de las mismas dirigidas a la expresión regulada específica del cáncer de un polinucleótido terapéutico en terapia génica del cáncer, tal como al menos cáncer de ovario, mama, pancreático y de próstata, por ejemplo.
Por tanto, la presente invención se refiere en general a procedimientos para inhibir la proliferación en una célula cancerosa y/o célula tumoral, comprendiendo el procedimiento poner en contacto la célula con un polipéptido terapéutico en una cantidad eficaz para inhibir la proliferación utilizando un promotor específico de cáncer, tal como uno descrito en la presente memoria. La inhibición de la proliferación puede indicarse, por ejemplo, por una inducción de la apoptosis de una célula tal como, por ejemplo, en cultivo celular, la inhibición del crecimiento de una línea celular cancerosa, la reducción del tamaño de un tumor y/o el aumento de la supervivencia, en realizaciones ejemplares. Más preferiblemente, en algunas realizaciones las células en que se va a inhibir la proliferación es una célula en un organismo vivo, por ejemplo un ser humano. La inhibición de dicha transformación tiene una gran utilidad en la prevención y/o tratamiento de eventos activados por la transformación tales como cáncer, tumorigénesis y/o metástasis.
La presente invención engloba constructos polinucleotídicos que comprenden secuencias de control que dirigen la expresión de un polinucleótido terapéutico en un tejido y/o tipo de célula particular. El polinucleótido puede ponerse en contacto con, o introducirse en, una célula mediante cualquiera de una variedad de maneras conocidas por los especialistas. El polinucleótido terapéutico puede introducirse mediante introducción directa de polinucleótido en una célula o tejido de interés. En este caso, el polinucleótido terapéutico puede obtenerse mediante cualquier procedimiento conocido en la materia.
En aspectos específicos de la invención, pueden introducirse en la célula ARN o ADN que comprenden el polinucleótido terapéutico mediante cualquier manera conocida en la materia. En ciertas realizaciones preferidas, se introduce el polipéptido terapéutico en la célula mediante la introducción de un segmento de ADN que codifique el producto génico terapéutico. En algunas de dichas realizaciones, se prevé que el segmento de ADN que comprende el polinucleótido terapéutico esté ligado operativamente con las secuencias de control de la invención. La construcción de dichos constructos génicos/de ADN de secuencia de control es bien conocida en la materia y se describe con detalle en la presente memoria.
En ciertas realizaciones, para la introducción, el segmento de ADN puede estar localizado en un vector, por ejemplo, un vector plasmídico o un vector vírico. El vector vírico puede ser, por ejemplo, un retrovirus, adenovirus, herpesvirus, virus Vaccinia y virus adenoasociados. Dicho segmento de ADN puede usarse en la variedad de procedimientos relacionados con la invención. El vector puede usarse para suministrar un polinucleótido bik mutante a una célula en una de las realizaciones de terapia génica de la invención en realizaciones específicas. Dichos vectores pueden usarse también para transformar células cultivadas, y dichas células cultivadas podrían usarse, entre otras cosas, para la expresión de Bik mutante in vitro.
Un especialista en la materia reconocerá que los promotores de la invención son útiles en cualquier contexto, incluyendo la expresión específica de células no cancerosas o incluso la expresión de un polinucleótido que no sea de naturaleza específica de célula o tejido.
En una realización particular,... [Seguir leyendo]
Reivindicaciones:
1. Un constructo polinucleotídico que comprende una secuencia de control específica de cáncer de mama, comprendiendo dicha secuencia de control una porción seleccionada del promotor de topoisomerasa IIα o una porción seleccionada del receptor de transferrina, y comprendiendo adicionalmente una secuencia de amplificación transcripcional en dos etapas (TSTA) , incluyendo dicha secuencia de TSTA un dominio de unión a ADN y un dominio de activación, y comprendiendo el elemento regulador postranscripcional del virus de la hepatitis de marmota (WPRE) .
2. El constructo de la reivindicación 1, en el que la porción seleccionada del promotor de topoisomerasa IIα comprende la SEQ ID NO: 12.
3. El constructo de la reivindicación 1, en el que la porción seleccionada del receptor de transferrina comprende la SEQ ID NO: 13.
4. El constructo de una cualquiera de las reivindicaciones 1 a 3, que comprende adicionalmente un potenciador.
5. El constructo de la reivindicación 4, en el que el potenciador comprende potenciador de citomegalovirus 15 (CMV) , promotor de gliceraldehído-3-fosfato deshidrogenasa (GAPDH) o el promotor de β-actina.
6. El constructo según una cualquiera de las reivindicaciones 1 a 5 para uso en el tratamiento de cáncer de mama.
7. Un constructo polinucleotídico que comprende una secuencia de control específica de cáncer de próstata, comprendiendo dicha secuencia de control 20 una secuencia de control específica de tejido de próstata junto con y/o
una secuencia de control específica de cáncer; una secuencia de amplificación transcripcional en dos etapas (TSTA) , incluyendo dicha secuencia de TSTA un dominio de unión a ADN y un dominio de activación, y un elemento regulador postranscripcional del virus de la hepatitis de marmota (WPRE) .
8. El constructo 8 de la reivindicación 7, en el que dicha secuencia de control específica de tejido de próstata comprende la SEQ ID NO: 17.
9. El constructo de la reivindicación 7, en el que dicha secuencia de control específica del cáncer comprende la SEQ ID NO: 18.
10. El constructo de una cualquiera de las reivindicaciones 7 a 9 para uso en el tratamiento de cáncer de 30 próstata.
11. Un constructo polinucleotídico que comprende una secuencia de control específica de cáncer pancreático, comprendiendo dicha secuencia de control: una secuencia de control específica de tejido pancreático y una secuencia de amplificación transcripcional en dos etapas (TSTA) , incluyendo dicha secuencia de TSTA un dominio de unión a ADN y un dominio de activación; y un elemento regulador postranscripcional del virus de la hepatitis de marmota (WPRE) .
12. El constructo de la reivindicación 11, en el que dicha secuencia de control específica de tejido pancreático comprende la SEQ ID NO: 14.
13. El constructo de la reivindicación 11 o 12 para uso en el tratamiento de cáncer pancreático. 40 14. El constructo de las reivindicaciones 1 a 13, en el que el dominio de unión a ADN es Gal1, Gal4 o LexA.
15. El constructo de las reivindicaciones 1 a 14, en el que el dominio de activación es VP2 o VP16.
16. El constructo de las reivindicaciones 1 a 15, en el que la secuencia de TSTA es GAL4-VP2 o GAL4-VP16.
17. El constructo de una cualquiera de las reivindicaciones 1 a 16, en el que dicha secuencia de control está ligada operativamente con un polinucleótido que codifica un producto génico terapéutico.
18. El constructo de la reivindicación 17, en el que el producto génico terapéutico es un inhibidor de la proliferación celular, un regulador de la muerte celular programada o un supresor tumoral.
19. El constructo de una cualquiera de las reivindicaciones 1 a 18, definido adicionalmente por estar comprendido en un liposoma.
20. Un procedimiento de inhibición de la proliferación de células de cáncer de mama in vitro, que comprende poner en contacto una célula de cáncer de mama con una cantidad eficaz de un constructo polinucleotídico como se define en la reivindicación 1, estando dicha porción seleccionada ligada operativamente con un polinucleótido que codifica un producto génico eficaz para inhibir la proliferación celular.
21. Un procedimiento de inhibición de la proliferación de células de cáncer de próstata in vitro, que comprende poner en contacto una célula de cáncer de próstata con una cantidad eficaz de un constructo polinucleotídico como se define en la reivindicación 7, en el que las secuencias están ligadas operativamente con un polinucleótido que codifica un producto génico eficaz para inhibir la proliferación de células de cáncer de próstata.
22. El procedimiento de la reivindicación 21, en el que el constructo comprende adicionalmente una secuencia de control postranscripcional ligada operativamente con un polinucleótido que codifica un producto génico eficaz 15 para inhibir la proliferación de células de cáncer de próstata.
23. Un procedimiento de inhibición de la proliferación de células de cáncer pancreático in vitro, que comprende poner en contacto una célula de cáncer pancreático con una cantidad eficaz de un constructo polinucleotídico como se define en la reivindicación 11 ligado operativamente con un polinucleótido que codifica un producto génico eficaz para inhibir la proliferación celular.
24. El procedimiento de la reivindicación 23, en el que el constructo comprende adicionalmente una secuencia de control postranscripcional ligada operativamente con un polinucleótido que codifica un producto génico eficaz para inhibir la proliferación celular.
Patentes similares o relacionadas:
 Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]