MÉTODOS PARA LA PRODUCCIÓN DE COMPLEJOS DE MOLÉCULAS ANTÍGENAS DE ALFA (2) MACROGLOBULINA.
Un método para preparar una composición que comprende complejos purificados alfa (2) macroglobulinamoléculaantigénica que comprende
(a) Purificar complejos alfa (2) macroglobulina-molécula antigénica a partir de suero de un paciente que tiene unalesión precancerosa,
un tumor canceroso o una enfermedad infecciosa, en donde dichos complejos se encuentranen y se derivan de dicho suero, y en donde dichos complejos comprenden una molécula antigénica que tiene laantigenicidad de dicha lesión precancerosa, dicho tumor canceroso, o dicha enfermedad infecciosa,respectivamente, y
(b) formular los complejos purificados alfa (2) macroglobulina-molécula antigénica en un vehículo farmacéuticamentecompatible
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/005110.
Solicitante: UNIVERSITY OF CONNECTICUT HEALTH CENTER.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 263 FARMINGTON AVENUE FARMINGTON, CT 06030 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SRIVASTAVA, PRAMOD, K., BINDER,Robert J.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/17 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
PDF original: ES-2385933_T3.pdf
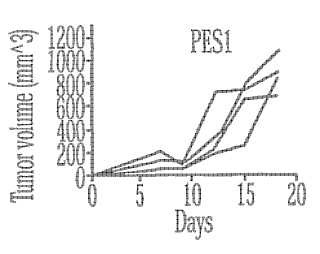
Fragmento de la descripción:
1. INTRODUCCIÓN
La presente invención se refiere a un método para preparar una composición que comprende complejos de moléculas antígenas de alfa (2) macroglobulina purificados aislados a partir del suero de un paciente.
2. ANTECEDENTES DE LA INVENCIÓN
2.1 ALFA (2) MACROGLOBULINA
La a-macroglobulinas son elementos de una superfamilia de proteínas de proteínas estructuralmente relacionadas que también abarca los componentes C3, C4 y C5 de complemento. La de la proteína alfa (2) macroglobulina (a2M) del plasma humano es una proteína homotetramérica de 720 kDa principalmente conocida como un inhibidor de la proteasa y una molécula barredora de proteasa de fluido inflamatorio y plasma (para revisión ver Chu y Pizzo, 1994, Lab. Invest. 71:792) . a2M se sintetiza como un precursor que tiene 1.474 residuos de aminoácidos. Los primeros 23 aminoácidos funcionan como una secuencia de señal que se rompe para producir una proteína madura con 1.451 residuos de aminoácidos (Kan et al., 1985, Proc. Natl. Acad. Sci.. EE.UU. 82:2282-2286) .
Alfa (2) macroglobulina se une promiscuamente a proteínas y péptidos con cadenas laterales de aminoácidos nucleófilos de una manera covalente (Chu et al., 1994, Ann. NY Acad. Sci.. 737:291-307) y los dirige a las células que expresan CD91 (también llamado el receptor a2M o a2MR;. Chu y Pizzo, 1993, J. Immunol 150:48) . La unión de a2M de CD91 está mediada por la porción carboxi-terminal de a2M (Holtet et al., 1994, FEBS Lett. 344:242-246) y se han determinado residuos clave (Nielsen et al., 1996, J. Biol. Chem. 271:12909-12912)
Generalmente conocida por inhibir la actividad de la proteasa, a2M se une a una variedad de proteasas a través de múltiples sitios de unión (véase, por ejemplo, Hall et al., 1981, Biochem. Biophys. Res.. Commun. 100 (1) :8-16) . La interacción de proteasa con a2M resulta en una reordenacíón estructural compleja llamada transformación, que es el resultado de una escisión dentro de la región "cebo" de a2M después de que la proteasa queda "atrapada" por tioésteres. El cambio conformacional expone residuos necesarios para la unión al receptor, lo que permite al complejo a2M-proteasa unirse a la a2MR. Metilamina puede inducir cambios conformacionales y división similares a la inducida por proteasas. La forma no escindida de a2M, que no es reconocida por el receptor, se refiere a menudo como la forma "lenta" (s-a2M) . La forma escindida se conoce como la la forma "rápida" (f-a2M) (revisado por Chu et al., 1994, Ann. NY Acad. Sci.. 737:291-307) . Recientemente, también se ha demostrado que la a2MR puede unirse a HSP, como gp96, HSP90, HSP70, y calreticulina (Basu et al., 2001, Immunity 14 (3) :303-13) .
Los estudios han demostrado que, además de sus funciones inhibidoras de proteasa, a2M, cuando complejada con antígenos, pueden mejorar la capacidad de los antígenos de ser captados por células que presentan antígenos, como macrófagos y presentados a hibridomas de células T in vitro en hasta dos órdenes de magnitud (Chu y Pizzo, de 1994, de Lab. Invest. 71:792) , e inducir la proliferación de células T (Osada et al., 1987, Biochem. Biophys. Res.. Commun.146 :26-31) . Otras pruebas sugieren que el antígeno complejante con a2M aumenta la producción de anticuerpos por las células de bazo crudas in vitro (Osada et al., 1988, Biochem. Biophys. Res.. Commun. 150:883) , provoca unas respuestas de anticuerpos in vivo en conejos de experimentación (Chu et al., 1994, J. Immunol. 152:1538-1545) y ratones (Mitsuda et al., 1993, Biochem. Biophys. Res.. Commun. 101:13261331) . También se han mostrado que complejos péptidos antigénicos de a2M inducen una respuesta in vivo de célula T citotóxica (Binder et al., 2001, J. Immunol. 166:4698-49720) .
2.2. PROTEÍNAS DE CHOQUE TÉRMICO
[0006], las proteínas de choque térmico (HSP) , también conocidAS como proteínas de estrés, se identificARON por primera vez como proteínas sintetizadas por células en respuesta a choque térmico. HSP se han clasificado en cinco familias, en función del peso molecular, Hsp100, Hsp90, Hsp70, Hsp60 y smHsp. Se encontró después que muchos elementos de estas familias son inducidos en respuesta a otros estímulos estresantes tales como la privación de nutrientes, alteración metabólica, radicales de oxígeno, y la infección por patógenos intracelulares o extracelulares (véase Welch, 1993, Scientific American 56-64; Young, 1990, Annu. Rev. Immunol 8:... 401-420; Craig, 1993, Science 260:1902-1903; Gething et al, 1992, Nature 355:33-45; y Lindquist et al, 1988, Annu Rev. Genética.. 22:631677)
[0007], las proteínas de choque térmico se encuentran entre las proteínas más altamente conservadas en existencia. Por ejemplo, DnaK, la Hsp70 de E. coli tiene alrededor de 50% de identidad de secuencia de aminoácidos con las proteínas Hsp70 de excoriados (Bardwell et al., 1984, Proc. Natl. Acad. Sci.. 81:848-852) . Las familias Hsp60 y Hsp90 también muestran igualmente altos niveles de conservación dentro de la familia (Hickey et al, 1989, Mol Cell Biol 9:2615-2626; Jindal, de 1989, Mol Cell Biol 9:2279-2283. ) . Además, se ha descubierto que las familias Hsp60, Hsp70 y Hsp90 se componen de proteínas que están relacionadas con las proteínas de estrés en secuencia, por ejemplo, que tiene más de 35% de identidad de aminoácidos, pero cuyos niveles de expresión no son alterados por el estrés .
Los estudios sobre la respuesta celular al choque térmico y otros factores de estrés fisiológico revelaron que los HSPs están involucrados no sólo en la protección celular frente a estas condiciones adversas, sino también en procesos bioquímicos e inmunológicos esenciales en las células no estresadas. HSPs realizan diferentes tipos de funciones chaperonas. Por ejemplo, elementos de la familia Hsp70, que se encuentran en el citoplasma, núcleo, mitocondrias, o retículo endoplásmico de la célula (Lindquist et al., 1988, Ann. Rev. Genética 22:631-677) , están involucrados en la presentación de antígenos a las células del sistema inmune, y también están involucrados en la transferencia, plegado y montaje de proteínas en las células normales. HSPs son capaces de unir proteínas o péptidos, y liberar proteínas o péptidos unidos en presencia de trifosfato de adenosina (ATP) o pH bajo.
2.3. INMUNOGENICIDAD DE COMPLEJOS HSP-PÉPTIDO
Srivastava et al. demostraron la respuesta inmune a sarcomas inducidos por metilcolantreno de ratones consanguíneos (1988, Immunol. Hoy 9:78-83) . En estos estudios, se encontró que las moléculas responsables de la inmunogenicidad individualmente distinta de estos tumores son glicoproteínas de 96kDa (gp96) y proteínas intracelulares de 84 a 86kDa (Srivastava et al., 1986, Proc. Natl. Acad. Sci.. EE.UU. 83:3407-3411; Ullrich et al, 1986, Proc Natl Acad Sci EE.UU. 83:3121-3125) . La inmunización de ratones con gp96 o p84/86 aisladas de un tumor particular hizo a los ratones inmunes a ese tumor en particular, pero no a tumores diferentes antigénicamente. El aislamiento y caracterización de genes que codifican gp96 y p84/86 reveló homología significativa entre ellos, y mostró que gp96 y p84/86 fueron, respectivamente, las contrapartes endoplásmico reticular y citosólica de las mismas proteínas de choque térmico (Srivastava et al., 1988, Inmunogenética 28:205-207; Srivastava et al, 1991, Curr Top Microbiol Immunol 167:109-123) . Además, se mostró que la Hsp70 provocaba inmunidad contra el tumor del que se aisló, pero no a tumores antigénicamente diferentes. Sin embargo, se encontró que la Hsp70 vaciada de péptidos perdía su actividad inmunogénica (Udono y Srivastava, 1993, J. Exp. Med. 178:1391-1396) . Estas observaciones sugerían que las proteínas de choque térmico no son inmunogénicas per se, sino que forman complejos no covalentes con péptidos antigénicos, y los complejos pueden provocar la inmunidad específica a los péptidos antigénicos (Srivastava, 1993, Adv Cancer Res. 62:153-177; Udono et al, 1994, J. Immunol, 152:53985403; Suto et al, 1995, Science, 269:1585-1588) .
Complejos covalentes de HSP y el péptido, purificados de células cancerosas, pueden ser utilizado para el tratamiento y prevención del cáncer y se han descrito en las publicaciones PCT WO 96/10411, de 11 de abril de 1996, y WO 97/10001, de fecha 20 de marzo 1997 (Patente de EE.UU. N º 5.750.119 concedida 12 de Abril 1998, y de patente de EE.UU. N º 5837251 concedida en Noviembre 17 de 1998, respectivamente) . El aislamiento y purificación complejos péptido-proteína de estrés se ha descrito, por ejemplo, a partir de células infectadas por gérmenes patógenos, y pueden... [Seguir leyendo]
Reivindicaciones:
1. Un método para preparar una composición que comprende complejos purificados alfa (2) macroglobulinamolécula antigénica que comprende
(a) Purificar complejos alfa (2) macroglobulina-molécula antigénica a partir de suero de un paciente que tiene una lesión precancerosa, un tumor canceroso o una enfermedad infecciosa, en donde dichos complejos se encuentran en y se derivan de dicho suero, y en donde dichos complejos comprenden una molécula antigénica que tiene la antigenicidad de dicha lesión precancerosa, dicho tumor canceroso, o dicha enfermedad infecciosa, respectivamente, y
(b) formular los complejos purificados alfa (2) macroglobulina-molécula antigénica en un vehículo farmacéuticamente compatible.
2. El método de la reivindicación 1, donde la etapa de purificar los complejos alfa (2) macroglobulina-molécula antigénica de dicho suero comprende:
(a) poner en contacto una fase sólida que contiene una molécula ligante de alfa (2) macroglobulina con el suero durante un período de tiempo suficiente para permitir la unión de los complejos alfa (2) macroglobulina - molécula antigénica con la fase sólida,
(b) eliminar el material no ligado a la fase sólida, y
(c) eluir los complejos alfa (2) macroglobulina - molécula antigénica de la fase sólida.
3. El método de la reivindicación 2, en donde la molécula ligante de alfa (2) macroglobulina es un anticuerpo específico para alfa (2) macroglobulina.
4. El método de la reivindicación 2, en donde la molécula ligante de alfa (2) macroglobulina es un fragmento de CD91de unión al ligando.
5. El método de cualquiera de las reivindicaciones 1 a 4, en donde la etapa de purificación comprende el fraccionamiento del suero para enriquecer en complejos alfa (2) macroglobulina - molécula antigénica.
6. El método de la reivindicación 1, en donde la etapa de purificación comprende usar cromatografía de intercambio aniónico o catiónico.
7. El método de la reivindicación 1, en donde dicha etapa de purificación comprende usar cromatografía de lectina.
8. El método de la reivindicación 1, en donde dicha etapa de purificación comprende usar cromatografía de afinidad.
9. El método de la reivindicación 1, en donde dicha etapa de purificación comprende usar técnicas de separación de unión a filtro.
10. El método de cualquiera de las reivindicaciones 1 a 9, que comprende además la etapa de poner en contacto el suero con un agente que estimula la formación de enlaces covalentes entre la alfa (2) macroglobulina y las moléculas antigénicas.
11. El método de la reivindicación 10, en donde el agente es una proteasa, amoníaco, metilamina o etilamina.
12. El método de cualquiera de las reivindicaciones 1 a 11, en donde el vehículo farmacéuticamente compatible es una solución fisiológicamente compatible.
13. El método de cualquiera de las reivindicaciones 1 a 11, en donde dicho paciente tiene dicho tumor canceroso, y en donde dichos complejos comprenden una molécula antigénica que tiene la antigenicidad de dicho tumor canceroso.
14. El método de cualquiera de las reivindicaciones 1 a 13, en donde el paciente es humano.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]