COMBINACIÓN DE FOSFOMICINA/AMINOGLUCÓSIDO AEROSOLIZADA PARA EL TRATAMIENTO DE LAS INFECCIONES RESPIRATORIAS BACTERIANAS.
Formulación en polvo seco de aerosol para la prevención y el tratamiento de la infección causada por bacterias sensibles en el tracto respiratorio de un paciente,
comprendiendo dicha formulación de 1 mg a 300 mg de fosfomicina, 1 mg a 300 mg de tobramicina, y excipientes farmacéuticamente aceptables, presentando dicha formulación un tamaño de partícula de entre 1 y 5 µm; y estando dicha formulación adaptada para la administración en las vías respiratorias pulmonares con un inhalador de polvo seco, en la que la proporción en peso de fosfomicina a tobramicina es de 5 a 9 partes de fosfomicina a de 1 a 5 partes de tobramicina
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/014690.
Solicitante: GILEAD SCIENCES, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 333 Lakeside Drive Foster City, CA 94404.
Inventor/es: BAKER,William,Ph.,D. Corus Pharma, MACLEOD,David.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Mayo de 2005.
Clasificación PCT:
- A61K38/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que contienen radicales sacárido; Sus derivados.
- A61K38/16 A61K 38/00 […] › Péptidos que tienen más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2358024_T3.pdf




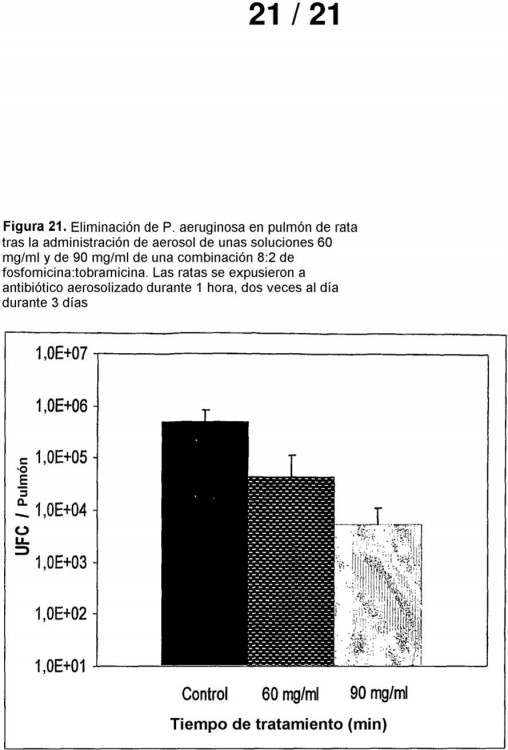
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a una formulación nueva, segura, no irritante y fisiológicamente compatible inhalable de una combinación de fosfomicina y aminoglucósido que resulta adecuada para el tratamiento de infecciones respiratorias bacterianas causadas por las bacterias Gram-negativas, tales como Burkholderia cepacia, especies de 5 Citrobacter, Escherichia coli, especies de Enterobacter, especies de Fusobacterium, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella oxytoca, Moraxella catarrhalis, Proteus mirabilis, especies de Prevotella, Pseudomonas aeruginosa, Serratia marcescens, Stenotrophomonas maltophilia, Alcaligenes xylosoxidans y bacterias Gram-positivas, tales como Staphylococcus aureus resistente a la meticilina, Staphylococcus aureus sensibles a la meticilina, Streptococcus pneumoniae y especies β-hemolíticas de Streptococcus. 10
ANTECEDENTES DE LA INVENCIÓN
La terapia más ampliamente aceptada para el tratamiento de las infecciones respiratorias causadas por bacterias Gram-negativas en pacientes de fibrosis quística implica la administración intravenosa de un único antibiótico o de combinaciones de antibióticos (Gibson et al., 2003; Ramsey, 1996). Este método de tratamiento presenta varias limitaciones significativas, que comprenden: (1) un espectro reducido de actividad de los antibióticos existentes, (2) 15 concentraciones insuficientes de antibiótico que alcanza el tracto respiratorio para garantizar un rápido inicio y unas tasas elevadas de eliminación bacteriana, y (3) el desarrollo de efectos secundarios negativos debido a concentraciones sistémicas elevadas del fármaco.
La administración en aerosol de antibióticos (Conway, 2005; O'Riordan, 2000) resuelve varias limitaciones de la administración parenteral (Flume y Klepser, 2002; Kuhn, 2001). Permite la administración tópica de concentraciones 20 elevadas de fármaco en los espacios endobronquiales y reduce los efectos secundarios al reducir la exposición sistémica al antibiótico. Sin embargo, los pacientes de fibrosis quística reciben típicamente terapias antibióticas prolongadas y repetidas durante toda su vida (Gibson et al., 2003; Ramsey, 1996). Por lo tanto, la toxicidad acumulativa de aminoglucósido y el desarrollo de resistencias resulta todavía un problema significativo.
Fosfomicina 25
La fosfomicina es un antibiótico de ácido fosfórico de amplio espectro (Kahan et al., 1974; Woodruff et al., 1977) que presenta actividad bactericida contra las bacterias Gram-negativas, incluyendo Citrobacter spp., E. coli, Enterobacter spp., K. pneumoniae, P. aeruginosa, Salmonella spp., Shigella spp. y S. marcescens (Greenwood et al., 1992; Rimm, 1979; Marchese et al., 2003; Schulin, 2002), así como bacterias Gram-positivas, que comprenden enterococos resistentes a vancomicina, S. aureus resistente a meticilina (MRSA), S. aureus sensible a meticilina (MSSA) y 30 S. pneumoniae (Greenwood et al., 1992; Grimm, 1979; Perri et al., 2002). La fosfomicina presenta su actividad máxima contra E. coli, Proteus spp., Salmonella spp., Shigella spp. y S. marcescens, que resultan generalmente inhibidos a concentraciones de fosfomicina ≤64 µg/ml (Forsgren y Walder, 1983). La fosfomicina es moderadamente activa contra P. aeruginosa (Forsgren y Walder, 1983), particularmente en comparación con la tobramicina (Schulin, 2002).
La fosfomicina es bactericida, pero muestra una eliminación dependiente del tiempo de E. coli y S. aureus (Grif et al., 35 2002). La tasa y el grado de eliminación dependen del periodo de tiempo durante el que la fosfomicina se encuentra en contacto con el organismo diana (Craig, 1998; Mueller et al., 2004). El incremento de la concentración de fosfomicina no produce un incremento correspondiente de la tasa o el grado de actividad de eliminación. Esta característica resulta significativa debido a que resulta preferido tratar las infecciones por P. aeruginosa con antibióticos que muestran una actividad de eliminación bactericida dependiente de la concentración (Craig, 1998; Mueller et al., 2004). 40
La monoterapia de fosfomicina se utiliza comúnmente en el tratamiento de infecciones no complicadas del tracto urinario causadas por E. coli, y menos frecuentemente en el tratamiento de infecciones respiratorias bacterianas, que comprende a los pacientes con fibrosis quística (Kamijyo et al., 2001; Katznelson et al., 1984; Kondo et al., 1996; Reeves, 1994; Bacardi et al., 1977; Bonora et al., 1977; Honorato et al., 1977; Menendez et al., 1977). Sin embargo, la fosfomicina sola no ha sido muy utilizada para tratar infecciones causadas por P. aeruginosa. La fosfomicina ha sido 45 administrada parenteralmente en combinación con antibióticos de diferentes clases para tratar la endocarditis (Moreno et al., 1986) y la fibrosis quística (Mirakhur et al., 2003) pero no se ha administrado directamente en el ambiente pulmonar mediante la administración por aerosol.
La fosfomicina se encuentra disponible en formulaciones tanto orales (fosfomicina calcio y forfomicina trometamol) e intravenosa (fosfomicina disódica) (Woodruff et al., 1977). La fosfomicina trometamol es la formulación preferida para la 50 administración oral debido a que se absorbe más fácilmente en la sangre en comparación con la fosfomicina calcio. Tras una única dosis intravenosa o intramuscular de 2 g de fosfomicina, las concentraciones séricas máximas alcanzan valores comprendidos entre 25 y 95 µg/ml en 1-2 horas (Woodruff et al., 1977). En contraste, las concentraciones alcanzan valores de 1 a 13 µg/ml en el pulmón normal tras la administración parenteral de una dosis comparable de fosfomicina (Bonora et al., 1977), lo que resulta insuficiente para eliminar la mayoría de los patógenos bacterianos, en 55 particular P. aeruginosa (Forsgren y Walder, 1983; Schulin, 2002). Los pacientes con fibrosis quística presentan una farmacocinética alterada, caracterizada por un volumen incrementado de distribución y tasa de eliminación (Tan et al., 2003), que probablemente reduciría adicionalmente la eficacia de la fosfomicina administrada parenteralmente.
La fosfomicina se encuentra ampliamente distribuida en diversos tejidos y líquidos corporales, pero no se une significativamente a las proteínas plasmáticas (Mirakhur et al., 2003). En consecuencia, la fosfomicina se encuentra disponible para ejercer efectos antibacterianos en el caso de que alcance concentraciones suficientes en el sitio de la infección. El tracto respiratorio de los pacientes con fibrosis quística se encuentra obstruido por secreciones viscosas denominadas esputo (Ramsey, 1996). La efectividad de varias clases de antibióticos, tales como aminoglucósidos y β-5 lactamos se encuentra reducida debido a la pobre penetración en el esputo. Además, la actividad de estos antibióticos se reduce adicionalmente debido a la unión a componentes del esputo (Hunt et al., 1995; Kuhn, 2001; Ramphal et al., 1988; Mendelman et al., 1985).
El desarrollo de resistencia en bacterias aisladas de pacientes tratados con fosfomicina para las infecciones del tracto urinario se produce muy infrecuentemente (Marchese et al., 2003). La resistencia cruzada con otras clases de 10 antibióticos inhibidores de la pared celular no se produce debido a que la fosfomicina actúa sobre el enzima fosfoenolpiruvato (UDP-N-acetilglucosamina enolpiruvato-transferasa), que no es diana para otros antibióticos (Kahan et al., 1974; Woodruff et al., 1977). La fosfomicina resulta activamente incorporada en las células bacterianas mediante dos sistemas de transporte; un transporte de L-α-glicerofosfato constitutivamente funcional y el sistema de incorporación de hexosas fosfato (Kahan et al., 1974). En el caso de que surja resistencia a la fosfomicina, típicamente 15 se debe a una mutación genética en uno o ambos sistemas de transporte codificados cromosómicamente, y menos comúnmente, debido a enzimas modificadores (Arca et al., 1997; Nilsson et al., 2003).
Tobramicina
La tobramicina es un antibiótico aminoglucósido que es activo contra los bacilos aeróbicos Gram-negativos, incluyendo P. aeruginosa, E. coli, Acinetobacter spp., Citrobacter spp., Enterobacter spp., K. pneumoniae, Proteus spp., 20 Salmonella spp., S. marcescens y Shigella spp. (Vakulenko y Mobashery, 2003). En particular, la tobramicina es altamente activa contra P. aeruginosa. Las concentraciones inhibidoras mínimas (MIC) de la tobramicina de P. aeruginosa sensible típicamente son inferiores a 2 µg/ml (Shawar et al., 1999; Spencker et al., 2002; Van Eldere, 2003). La mayoría de bacterias Gram-positivas... [Seguir leyendo]
Reivindicaciones:
1. Formulación en polvo seco de aerosol para la prevención y el tratamiento de la infección causada por bacterias sensibles en el tracto respiratorio de un paciente,
comprendiendo dicha formulación de 1 mg a 300 mg de fosfomicina, 1 mg a 300 mg de tobramicina, y excipientes farmacéuticamente aceptables, 5
presentando dicha formulación un tamaño de partícula de entre 1 y 5 µm; y
estando dicha formulación adaptada para la administración en las vías respiratorias pulmonares con un inhalador de polvo seco,
en la que la proporción en peso de fosfomicina a tobramicina es de 5 a 9 partes de fosfomicina a de 1 a 5 partes de tobramicina. 10
2. Formulación de aerosol para la prevención y el tratamiento de la infección causada por bacterias sensibles en el tracto respiratorio de un paciente,
comprendiendo dicha formulación de 1 mg a 300 mg de fosfomicina, 1 mg a 300 mg de tobramicina, y 0,5 a 7 ml de solución que contiene una concentración de cloro >30 mM;
estando dicha formulación adaptada para la administración en las vías respiratorias pulmonares mediante 15 aerosolización utilizando un nebulizador que puede producir un aerosol con una distribución de tamaños de partícula predominantes de entre 1 y 5 µm; y
en la que la proporción en peso de fosfomicina a tobramicina es de 5 a 9 partes de fosfomicina a de 1 a 5 partes de tobramicina.
3. Formulación según la reivindicación 1 ó 2, en la que la proporción en peso de fosfomicina a tobramicina es de 7 a 9 20 partes de fosfomicina a de 1 a 3 partes de tobramicina.
4. Formulación según la reivindicación 1 ó 2, en la que la proporción en peso de fosfomicina a tobramicina es de 8 partes de fosfomicina a 2 partes de tobramicina.
5. Formulación de aerosol según cualquiera de las reivindicaciones 2 a 4, en la que dicha formulación es acondicionada en una ampolla de soplado-llenado-sellado doble de manera que cada antibiótico se formula 25 individualmente en agua y el pH se ajusta de manera que la solución de fosfomicina presente un pH de entre 8 y 13 y la solución de tobramicina presente un pH de entre 1 y 6 y, cuando la ampolla doble es abierta y el contenido es reconstituido, la solución resultante presenta un pH de entre 4,5 y 8,0.
6. Formulación según cualquiera de las reivindicaciones 2 a 4 en forma de una solución reconstituida de 1 a 300 mg de fosfomicina y 1 a 300 mg de tobramicina suspendidos en 0,5 a 7 ml de una solución fisiológicamente adecuada. 30
7. Utilización de una formulación de aerosol que comprende 1 a 300 mg de fosfomicina más 1 a 300 mg de tobramicina suspendidos en 0,5 a 7 ml de una solución fisiológicamente adecuada, para la preparación de un medicamento destinado a la prevención y el tratamiento de las infecciones del tracto respiratorio causadas por bacterias y adecuada para la administración a un paciente que necesita dicho tratamiento, en la que la proporción en peso de fosfomicina a tobramicina es de 5 a 9 partes de fosfomicina a de 1 a 5 partes de tobramicina. 35
8. Utilización según la reivindicación 7, en la que la proporción en peso de fosfomicina a tobramicina es de 7 a 9 partes de fosfomicina a de 1 a 3 partes de tobramicina.
9. Utilización según la reivindicación 7, en la que la proporción en peso de fosfomicina a tobramicina es de 8 partes de fosfomicina a 2 partes de tobramicina.
10. Utilización según cualquiera de las reivindicaciones 7 a 9, en la que dicha formulación presenta un pH de entre 4,5 40 y 8,0 en agua con una concentración de cloro >30 mM.
11. Utilización según cualquiera de las reivindicaciones 7 a 9, en la que dicha formulación está destinada a la administración mediante aerosolización utilizando un nebulizador de chorro, ultrasónico, presurizado o poroso vibratorio,
y comprendiendo el aerosol una distribución de tamaños de partícula predominantemente entre 1 y 5 µm. 45
12. Utilización según cualquiera de las reivindicaciones 7 a 9, en la que las infecciones están causadas por la bacteria P. aeruginosa o S. aureus.
13. Utilización según cualquiera de las reivindicaciones 7 a 9, en la que el tratamiento de las infecciones del tracto respiratorio se seleccionan de entre el grupo constituido por sinusitis bacteriana, fibrosis quística, Pseudomonas pulmonar crónica, bronquiectasia, neumonía hospitalaria y extrahospitalaria y neumonía asociada al respirador. 50
Patentes similares o relacionadas:
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]