ROS quinasa mutante y de translocación en el carcinoma pulmonar no microcítico humano.
Un polinucleótido aislado que comprende una secuencia de nucleótidos al menos 95% idéntica a una secuencia seleccionada del grupo que consiste en:
(a) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos de SEQ ID NO:1 o SEQ ID NO:3;
(b) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS, comprendiendo dicha secuencia de nucleótidos la secuencia de nucleótidos de SEQ ID NO:2 o SEQ ID NO:4;
(c) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos N-terminal de SLC34A2 que consiste en los restos 1-126 de SEQ ID NO:5, y el dominio quinasa de ROS que consiste en los restos 1945-2222 de SEQ ID NO:7;
(d) una secuencia de nucleótidos que comprende la secuencia de nucleótidos N-terminal de SLC34A2 que consiste en los nucleótidos 1-378 de SEQ ID NO:6, y la secuencia de nucleótidos del dominio quinasa de ROS que consiste en los nucleótidos 6032-6865 de SEQ ID NO:8; y
(e) una secuencia de nucleótidos complementaria con cualquiera de las secuencias de nucleótidos de (a)-(d).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/001360.
Solicitante: CELL SIGNALING TECHNOLOGY, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3 TRASK LANE DANVERS, MA 01923 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GUO,AILAN, POSSEMATO,ANTHONY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/82 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Productos de traducción de oncogenes.
PDF original: ES-2539830_T3.pdf



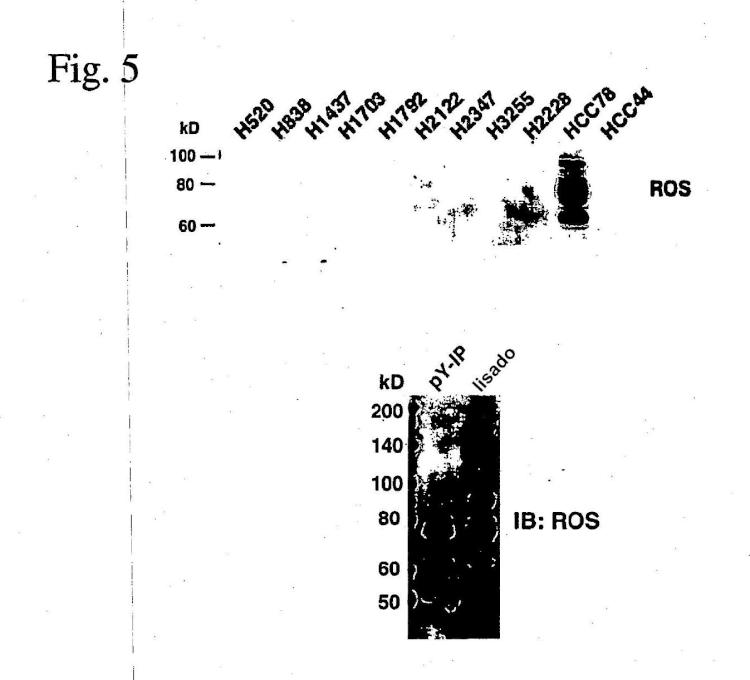
Fragmento de la descripción:
ROS quinasa muíante y de translocación en el carcinoma pulmonar no microcítico humano Solicitudes relacionadas
Esta solicitud reivindica la prioridad y el beneficio del documento USSN 6/76.634, presentado el 2 de enero de 26.
Campo de la invención
La invención se refiere, en general, a proteínas y genes implicado en el cáncer, y a la detección, el diagnóstico y el tratamiento del cáncer.
Antecedentes de la invención
Muchos cánceres se caracterizan por alteraciones en las vías de señalización celular que conducen a un control aberrante de los procesos celulares, o a un crecimiento y proliferación descontrolados de células. Estas alteraciones a menudo son provocadas por cambios en la actividad de proteínas de señalización concretas, tales como quinasas. Entre estos cánceres se encuentra el carcinoma pulmonar no microcítico (NSCLC). El NSCLC es la principal causa de muerte por cáncer en EEUU, y supone aproximadamente 87% de todos los cánceres de pulmón. Se producen aproximadamente 151. nuevos casos anuales de NSCLC en EEUU, y se calcula que más de 12. pacientes mueren al año por esta enfermedad solo en EEUU. Véase "Cáncer Facts and Figures 25", American Cáncer Society. El NSCLC, que comprende tres subtipos diferenciados, a menudo solo se detecta después de que haya metastatizado, y así la tasa de mortalidad es del 75% en los dos años siguientes al diagnóstico.
Se sabe que las translocaciones de genes que producen proteínas de fusión de quinasas con una actividad de señalización aberrante pueden conducir directamente a ciertos cánceres. Por ejemplo, se ha demostrado directamente que la oncoproteína BCR-ABL, una proteína de fusión de tirosina quinasa, es el agente causativo en la leucemia mielógena crónica humana (CML). La oncoproteína BCR-ABL, que se encuentra en al menos 9-95% de los casos de CML, es generada por la translocación de secuencias génicas desde la proteína tirosina quinasa c-ABL sobre el cromosoma 9 hacia las secuencias BCR sobre el cromosoma 22, produciendo el denominado cromosoma Filadelfia. Véase, por ejemplo, Kurzock et al., N. Engl. J. Med., 319: 99-998 (1988). También se observa translocación en casos de leucemia linfocítica aguda y AML.
Se han descrito translocaciones de genes que conducen a proteínas mutantes o de fusión implicadas en una diversidad de otros cánceres distintos. Por ejemplo, Falini et al., Blood, 99(2): 49-426 (22), analizan las translocaciones que se sabe que aparecen en cánceres hematológicos. Hasta la fecha, sólo se ha descrito un número limitado de translocaciones de genes y proteínas mutantes que aparecen en cánceres de pulmón, incluyendo la translocación t(15; 19) que implica a Notch3. Véase Dang et al., J. Nati. Can. Instit., 92(16): 1355-1357 (2). Se han descubierto defectos en la expresión y/o la actividad de la proteína de unión a ARN-6 (RBM-6) en carcinomas pulmonares microcíticos y no microcíticos. Véase Drabkin et al., Oncogene, 8(16): 2589-2597 (1999). Sin embargo, hasta la fecha no se han descrito translocaciones en el cáncer de NSCLC humano que impliquen a proteína quinasas.
Se han encontrado defectos en la expresión y/o la activación de SLC34A2 en el cáncer ovárico humano. Véase Rangel et al., Oncogene, 22(46): 7225-7232 (23). De forma similar, se han descrito defectos en la expresión de ROS quinasa que surgen de la translocación de FIG-ROS del(6)(q21,q21) en el glioblastoma. Véase Charest etal., Genes Chromos. Cañe., 37(1): 58-71 (23). También se ha descrito una forma truncada de ROS quinasa capaz de dirigir el crecimiento tumoral en ratones. Véase Birchmeier ef al., Mol. Cell. Bio., 6(9): 319-3115 (1986). Hasta la fecha, no se conocen mutaciones puntuales activantes que aparezcan en ROS quinasa.
Charest A. etal., Proceedings ofthe National Academy of Sciences, 1(3): 916-921 (23), describen una proteína oncogénica que comprende el dominio quinasa de c-ROS.
Nagarajan L. et al., Proceedings ofthe National Academy of Sciences, 83(17): 6568-6572 (1986), y Xu H. et al., Genomics, 62(2): 281-284 (1999), describen sondas adecuadas para detectar polinucleótidos de SLC34A2 y ROS.
Birchmeier C. et al., BioEssays: News and Reviews in Molecular Cellular and Developmental Biology, 15(3): 185-19 (1993), describen el control del receptor de c-ROS de la morfogénesis y el crecimiento epitelial.
El documento W24/23973 describe las secuencias del polinucleótido y del polipéptido de SLC34A2 y ROS.
La identificación de translocaciones y mutaciones en cánceres humanos es muy deseable, porque esto puede conducir al desarrollo de nuevos productos terapéuticos que se dirijan a dichas proteínas de fusión o mutantes, y a nuevos diagnósticos para identificar pacientes que tengan estas translocaciones de genes. Por ejemplo, BCR-ABL se ha convertido en una diana para el desarrollo de productos terapéuticos para tratar la leucemia. En fechas más recientes, Gleevec® (mesilato de imatinib, STI-571), un inhibidor de molécula pequeña de la ABL quinasa, ha sido
aprobado pare el tratamiento de la CML. Este fármaco es el primero de una nueva clase de agentes antiproliferatlvos diseñados para interferir con las vías de señalización que dirigen el crecimiento de las células tumorales. El desarrollo de este fármaco representa un avance significativo frente a las terapias convencionales para la CML y ALL, la quimioterapia y la radiación, que están plagadas de efectos secundarios muy conocidos y a menudo tienen un efecto limitado, puesto que no están dirigidas específicamente a las causas subyacentes de las malignidades. De modo similar, se han descrito reactivos y métodos para detectar específicamente proteínas de fusión de BCR-ABL en pacientes, para identificar a los pacientes que responden con mayor probabilidad a los inhibidores dirigidos, tales como Gleevec®.
Por consiguiente, sigue siendo necesaria la identificación de nuevas translocaciones o mutaciones de genes que produzcan proteínas de fusión o mutantes implicadas en el avance de los cánceres humanos, que incluyen cánceres de pulmón, tales como NSCLC, y el desarrollo de nuevos reactivos y métodos para el estudio y la detección de dichas proteínas de fusión. La identificación de estas proteínas de fusión permitirá desarrollar de modo deseable, entre otras cosas, nuevos métodos para seleccionar pacientes para las terapias dirigidas, así como la selección de nuevos fármacos que inhiban estas proteínas mutantes/de fusión.
Sumario de la invención
Según la invención, ahora se ha identificado una nueva translocación génica, (4p15, 6q22), en el carcinoma pulmonar no microcítico (NSCLC) que produce proteínas de fusión que combinan parte de la proteína de isoforma NaPi-3b transportadora de fosfato dependiente de sodio (SLC34A2) con la quinasa del precursor de la tirosina proteína quinasa ROS de protooncogén (ROS). Se espera que las dos proteínas de fusión de SLC34A2-ROS conserven la actividad de ROS tirosina quinasa y que dirijan la proliferación y la supervivencia de NSCLC en un subconjunto de aquellos cánceres en los que se expresa la proteína de fusión.
Por tanto, la invención proporciona, en parte, polinucleótidos aislados según la reivindicacióbn 1 y vectores que codifican los polipéptidos de ROS mutantes descritos, es decir, los polipéptidos de fusión de quinasa SLC34A2- ROS, sondas y ensayos para detectarlos, polipéptidos de ROS mutantes aislados, polipéptidos mutantes recombinantes, y reactivos para detectar los polinucleótidos y polipéptidos de ROS mutantes. La identificación descrita de las nuevas proteínas de ROS quinasa mutantes y la translocación de SLC34A2 permite desarrollar nuevos métodos para determinar la presencia de polinucleótidos o polipéptidos de ROS mutantes en una muestra biológica, métodos para seleccionar compuestos que inhiban las proteínas de quinasa mutantes, y métodos para inhibir el avance de un cáncer que se caracteriza por la expresión de polinucleótidos o polipéptidos de ROS mutantes, que también son proporcionados por la invención. Los aspectos y las realizaciones de la invención se describen con más detalle a continuación.
Breve descripción de los dibujos
Figura 1: Muestra la localización del gen SLC34A2 y el gen ROS sobre los cromosomas 4p y 6q, respectivamente (panel A), y las localizaciones del dominio de las proteínas de SLC34A2 y ROS de longitud completa, así como las de los dos variantes de la proteína de fusión de SLC34A2-ROS (paneles B y C). En el primer variante (largo), la zona de unión de la fusión aparece en el resto 175 cadena arriba del dominio transmembrana de ROS, mientras que el segundo variante (corto) aparece en el resto 1853.
Figura 2A: Es la secuencia de aminoácidos... [Seguir leyendo]
Reivindicaciones:
1.- Un polínucleótido aislado que comprende una secuencia de nucleótidos al menos 95% idéntica a una secuencia seleccionada del grupo que consiste en:
(a) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos de SEQ ID NO:1 o SEQ ID NO:3;
(b) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS, comprendiendo dicha secuencia de nucleótidos la secuencia de nucleótidos de SEQ ID NO:2 o SEQ ID NO:4;
(c) una secuencia de nucleótidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos N-terminal de SLC34A2 que consiste en los restos 1-126 de SEQ ID NO:5, y el dominio quinasa de ROS que consiste en los restos 1945-2222 de SEQ ID NO:7;
(d) una secuencia de nucleótidos que comprende la secuencia de nucleótidos N-terminal de SLC34A2 que consiste en los nucleótidos 1-378 de SEQ ID NO:6, y la secuencia de nucleótidos del dominio quinasa de ROS que consiste en los nucleótidos 632-6865 de SEQ ID NO:8; y
(e) una secuencia de nucleótidos complementaria con cualquiera de las secuencias de nucleótidos de (a)-(d).
2.- El polinucleótido aislado de la reivindicación 1, en el que dicha secuencia de nucleótidos de (b) comprende la secuencia de nucleótidos codificadora del clon de ADNc contenido en ATCC n.° de depósito PTA-7877.
3.- Un método para producir un vector recombinante que comprende insertar una molécula de ácido nucleico aislada de la reivindicación 1 en un vector.
4.- Un vector recombinante que comprende una molécula de ácido nucleico aislada según la reivindicación 1.
5.- Un método para fabricar una célula hospedante recombinante que comprende introducir el vector recombinante de la reivindicación 4 en una célula hospedante.
6.- Una célula hospedante recombinante transformada con el vector recombinante de la reivindicación 4.
7.- Un polipéptido aislado que comprende una secuencia de aminoácidos al menos 95% idéntica a una secuencia seleccionada del grupo que consiste en:
(a) una secuencia de aminoácidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos de SEQ ID NO:1 o SEQ ID NO:3; y
(b) una secuencia de aminoácidos que codifica un polipéptido de fusión de SLC34A2-ROS que comprende la secuencia de aminoácidos N-terminal de SLC34A2 que consiste en los restos 1-126 de SEQ ID NO:5, y el dominio quinasa de ROS que consiste en los restos 1945-2222 de SEQ ID NO:7.
8.- Un método para producir el polipéptido de fusión de SLC34A2-ROS de la reivindicación 7, comprendiendo dicho método cultivar una célula hospedante recombinante que comprende un vector recombinante que codifica dicho polipéptido de fusión bajo condiciones adecuadas para la expresión de dicho polipéptido de fusión, y recuperar dicho polipéptido.
9.- Un reactivo aislado que se une específicamente o detecta un polipéptido de fusión de SLC34A2-ROS de la reivindicación 7, pero que no se une ni detecta la SLC34A2 de tipo salvaje ni la ROS de tipo salvaje, en el que dicho reactivo es un anticuerpo.
1.- Un reactivo que detecta un polinucleótido de la reivindicación 1 en un ensayo de PCR, que comprende un primer oligonucleótido en la orientación sentido y un segundo oligonucleótido en la orientación antisentido.
11.- Un reactivo que detecta un polinucleótido de la reivindicación 1, que comprende una molécula de ácido nucleico aislada que comprende al menos 15 nucleótidos contiguos, o uno de sus complementos, que incluye los restos de la zona de unión de la fusión 376-381 de SEQ ID NO:2, o los restos 376-381 de SEQ ID NO:4 de un polinucleótido de fusión de SLC34A2-ROS.
12.- Un método para determinar la presencia de un polinucleótido de ROS mutante en una muestra biológica procedente de un cáncer de mamífero, comprendiendo dicho método detectar un polinucleótido según la reivindicación 1 en dicha muestra para determinar si un polinucleótido de ROS mutante está presente en dicha muestra.
13.- Un método para determinar la presencia de un polipéptido de ROS mutante en una muestra biológica
procedente de un cáncer de mamífero, comprendiendo dicho método detectar un polipéptido según la reivindicación 7 en dicha muestra para determinar si un polinucleótido de ROS mutante está presente en dicha muestra.
14.- El método de la reivindicación 12 o 13, en el que dicho cáncer es un cáncer de pulmón.
15.- El método de la reivindicación 14, en el que dicho cáncer de pulmón es un carcinoma de pulmón no microcítico (NSCLC).
16.- El método de la reivindicación 14, en el que la presencia de un polinucleótido o un polipéptido de ROS mutante identifica a dicho cáncer como un cáncer que es probable que responda a una composición que comprende al menos un producto terapéutico inhibidor de la ROS quinasa.
17.- El método de la reivindicación 14, puesto en práctica en un formato de ensayo de citometría de flujo (FC), de inmunohistoquímica (IHC), de inmunofluorescencia (IF), un formato de hibridación in situ de fluorescencia (FISH), o un formato de ensayo de reacción en cadena de polimerasa (POR).
18.- El método de la reivindicación, 13, en el que se detecta la actividad ROS quinasa de dicho polipéptido en el cáncer.
19.- Un método para determinar si un compuesto inhibe el avance de un cáncer, que comprende la etapa de determinar si dicho compuesto inhiben la expresión y/o la actividad ROS quinasa de un polipéptido según la reivindicación 7 en dicho cáncer.
2.- El método de la reivindicación 19, en el que se determina la inhibición de la expresión y/o la actividad ROS quinasa de dicho polipéptido empleando al menos un reactivo que detecta un polinucleótido de la reivindicación 1 y/o al menos un reactivo según una cualquiera de las reivindicaciones 9-11.
21.- Un anticuerpo dirigido que se une a ROS e inhibe la actividad ROS quinasa, para su uso en un método para inhibir el avance de un cáncer que expresa un polipéptido de fusión de SLC34A2-ROS según la reivindicación 7, comprendiendo dicho método la etapa de inhibir la expresión y/o la actividad ROS quinasa de dicho polipéptido de fusión de SLC34A2-ROS en dicho cáncer.
22.- El anticuerpo de la reivindicación 21 para su uso en un método según la reivindicación 21, en el que dicho cáncer es cáncer de pulmón.
23.- El anticuerpo de la reivindicación 22 para su uso en un método según la reivindicación 21, en el que dicho cáncer de pulmón es un carcinoma pulmonar no microcítico (NSCLC).
24.- Un kit para la detección de un polinucleótido y/o un polipéptido de fusión de SLC34A2-ROS en una muestra biológica, comprendiendo dicho kit al menos un polinucleótido de la reivindicación 1 y/o al menos un reactivo según una cualquiera de las reivindicaciones 9-11, y uno o más reactivos secundarios.
Patentes similares o relacionadas:
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]
Receptores de células T anti-KRAS mutado, del 8 de Enero de 2020, de The United States Of America, As Represented By The Secretary, Department Of Health And Human Services (100.0%): Receptor de células T (TCR) aislado que tiene especificidad antigénica para un epítopo mutado presentado en el contexto de una molécula de HLA-A11, consistiendo […]
Vacuna peptídica que comprende péptido ras mutante y agente quimioterapéutico, del 18 de Junio de 2019, de TARGOVAX ASA: Al menos un péptido, adecuado para provocar una respuesta inmunitaria, en el que el o cada péptido corresponde a un fragmento de una proteína RAS de tipo silvestre pero tiene […]
Proteína Brachyury, vectores adenovirales que codifican proteína Brachyury y su uso, del 5 de Junio de 2019, de The U.S.A. as represented by the Secretary, Department of Health and Human Services: Una cantidad eficaz de un vector adenoviral que codifica (a) una proteína que comprende una secuencia de aminoácidos idéntica al menos en un 90 % a […]
Nuevo antígeno de cáncer EEF2, del 17 de Abril de 2019, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica para su uso en el tratamiento o prevención de cánceres en un sujeto positivo para HLA-A*2402, en donde dicha composición farmacéutica […]
Moléculas de fusión KIF5B-RET y usos de las mismas, del 14 de Marzo de 2019, de Foundation Medicine, Inc: Un agente anticáncer para su uso en un procedimiento de tratamiento a un sujeto que tiene un cáncer colorrectal con una fusión del miembro de la […]
Polipéptidos y polinucleótidos, y usos de los mismos como una diana farmacológica para producir fármacos y agentes biológicos, del 9 de Enero de 2019, de COMPUGEN LTD: Un anticuerpo monoclonal o policlonal o un fragmento de unión a antígeno del mismo que se une al ectodominio de C1ORF32 o porciones o variantes del mismo y bloquea la interacción […]
Una mezcla de péptidos, del 18 de Septiembre de 2018, de TARGOVAX ASA: Una mezcla de péptidos adecuada para desencadenar una respuesta inmunitaria que comprende un primer, segundo, tercer, cuarto, quinto, sexto, séptimo y octavo péptido, cada […]