Nuevos péptidos antimicrobianos.
Un péptido antimicrobiano activado con ácido que comprende una secuencia de aminoácidos seleccionada entre el grupo que consiste en HHFFHHFHHFFHHF (SEC ID Nº:
109) (AA-1), FHFFHHFFHFFHHF (SEC ID Nº: 110) (AA- 2), KLLKGATFHFFHHFFHFFHHF (SEC ID Nº: 111) (AA-3), KLLKFHFFHHFFHFFHHF (SEC ID Nº: 112) (AA-4), y FHFFHHFFHFFHHFKLLK (SEC ID Nº: 113) (AA-5), donde dicho péptido muestra mayor actividad antimicrobiana frente a S. mutans a pH 4,9 que a pH 7,4.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/051101.
Solicitante: THE REGENTS OF THE UNIVERSITY OF CALIFORNIA.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1111 FRANKLIN STREET, 12TH FLOOR OAKLAND, CA 94607 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HE,JIAN, ECKERT,RANDAL H, SHI,WENYUAN, ANDERSON,MAXWELL H, QI,FENGXIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K7/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
- C07K7/08 C07K 7/00 […] › con 12 a 20 aminoácidos.
PDF original: ES-2548767_T3.pdf

Fragmento de la descripción:
Nuevos péptidos antimicrobianos Campo de la invención
La presente invención pertenece al campo de compuestos antimicrobianos. En particular, la presente invención pertenece a la identificación de nuevos péptidos antimicrobianos eficaces frente a Streptococcus mutans y otras bacterias.
Antecedentes de la invención
Los péptidos antimicrobianos (AMP) han llegado recientemente a la vanguardia como posibles sustitutos de antibióticos debido a su fuerte actividad de eliminación frente a un amplio espectro de especies bacterianas que incluyen cepas resistentes a fármacos. Los AMP son moléculas genéticamente comunes de inmunidad innata que se han descubierto en formas unicelulares y pluricelulares de vida (Tossi et al. (2000) Biopolimers 55: 4-30; Diamond (2001) Biologist (Londres) 48: 209-212; Lehrer y Ganz (2002) Curr. Opin. Immunol. 14: 96-102; Brogden et al. (2003) Int. J. Antimicrob. Agents 22: 465-478). Aunque pueden diferir drásticamente por la secuencia de péptidos y modificación después de la traducción (lineal, circular, etc), parece que la mayoría de los AMP eliminan las bacterias mediante la alteración de las membranas lipídicas, aunque parece que los detalles de este mecanismo varían ampliamente (Shai (2002) Biopolimers 66: 236-248; Brogden (2005) Nat. Rev. Microbiol. 3: 238-250). Las observaciones anteriores han indicado el papel crítico del carácter hidrófobo y catiónico en general en la función de AMP, incluyendo la contribución significativa de restos de Trp aromático y Arg catiónica encontrados en muchos AMP (Chan et al. (2007) Biochim Biophys Acta. 51 (4): 1351-1359; Wei et al. (2006) J. Bacteriol. 188: 328-334). A pesar de su pequeño tamaño (la mayoría de los AMP tienen menos de 50 aminoácidos), también parece que la estructura secundaria desempeña un papel Importante en la actividad. Ciertos AMP lineales pueden adoptar una conformación helicoidal a o de hebra después de la interacción con entornos hidrófobos (tales como detergentes o vesículas de lípidos) que imitan a las membranas bacterianas, lo que sugiere que estos cambios conformaclonales son necesarios para la función antimicrobiana (Klyota et al. (1996) Biochemistry 35: 13196-13204; Wei et al. (2006) J. Bacteriol. 188: 328-334; Wimmer et al. (2006) Biochemistry 45: 481-497). Además, parece que la formación de una hélice a de membrana activa (y otras estructuras) requiere una disposición espacial antipática de los restos, es decir, un gradiente de hldrofoblcldad a través de la superficie del péptido (Kiyota et al. (1996) Biochemistry 35: 13196-13204; Shai (1999) Biochim Biophys Acta 1462: 55-70; Lee (2002) Curr Pharm Des 8: 795-813).
Anteriormente, el diseño racional de péptidos antimicrobianos se ha centrado principalmente en la variación de secuencias naturales existentes, o el desarrollo de nuevos péptidos procedentes de grandes bibliotecas combinatorias (Kiyota et al. (1996) Biochemistry 35: 13196-13204; Blondelle y Lohner(2000) Biopolimers 55: 74-87; Hong et al. (2001) Peptides 22: 1669-1674; Sawai et al. (2002) Protein Eng. 15: 225-232). Estos esfuerzos han proporcionado una Información valiosa sobre actividad y estructura de AMP.
El Streptococcus mutans, un patógeno oral común y el agente causante de la caries dental, ha persistido e incluso prosperado en la superficie de los dientes a pesar de los esfuerzos constantes para eliminarlo o erradicarlo. Son muy necesarias nuevas terapias contra este organismo, ya que S. mutans es un colonizador persistente de la superficie del diente en presencia de azúcares de la dieta y puede permanecer en la microflora oral (conocida como placa dental) a pesar de la eliminación mecánica dedicada (cepillado de dientes) y los esfuerzos antisépticos en general (Keene y Shklair (1974) J. Dent. Res. 53: 1295). Payne et al., Oral Mlcroblology and Immunology, 1991; 6 (3): 169- 176 divulgan los efectos selectivos de ciertos pollpéptldos ricos en histidina en la agregación y viabilidad de Streptococcus mutans y Streptococcus sanguis. Helmerhorst, Blochemlcal Journal, 1997; 326 (1): 39-45 divulgan ciertos análogos de histatina sintética con amplio espectro de actividad antlmlcroblana. Lee et al., Infection and Immunity, 1997; 65 (7): 2898-2903 divulgan los efectos del pH y la salinidad sobre las propiedades antlmlcroblanas de clavaninas especiales. Rydengard et al., FEBS Journal, 2006; 274 (2): 377-389 divulgan que una gllcoproteína rica en histidina en particular ejerce actividad antlbacterlana. Masón et al., Antlmlcroblal Agents and Chemotherapy, 2006; 50 (10): 3305-3311 divulgan un aumento de la alteración de la membrana y una acción antlblótlca frente a bacterias patógenas mediante péptidos ricos en histidina diseñados específicamente a pH ácido.
Sumario de la invención
La presente invención pertenece al descubrimiento de nuevos péptidos antlmlcroblanos. En ciertas realizaciones, los péptidos muestran una actividad significativa frente a bacterias Gram positivas, en particular frente a bacterias Gram positivas en la cavidad oral (por ejemplo, Streptococcus mutans). Los péptidos son eficaces en la formulación de diversas composiciones antimicrobianas y/o en la prevención o reducción de la Incidencia de caries dental.
Por consiguiente, en ciertos casos, se proporciona un péptido antlmlcroblano activado con ácido que comprende una secuencia de aminoácidos seleccionada entre el grupo que consiste en HHFFHHFHHFFHHF (SEC ID N°: 109) (AA- 1), FHFFHHFFHFFHHF (SEC ID N°: 110) (AA-2), KLLKGATFHFFHHFFHFFHHF (SEC ID N°: 111) (AA-3), KLLKFHFFHHFFHFFHHF (SEC ID N°: 112) (AA-4), y FHFFHHFFHFFHHFKLLK (SEC ID N°: 113) (AA-5), donde
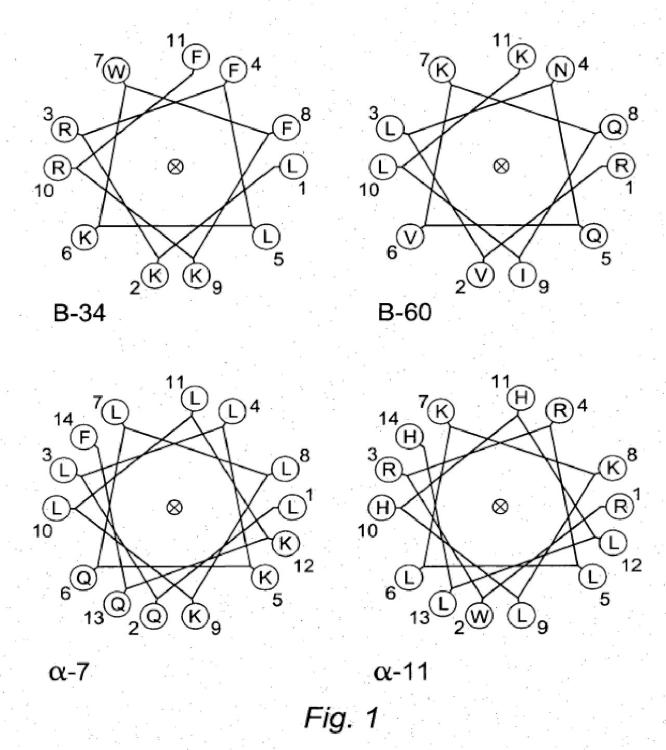
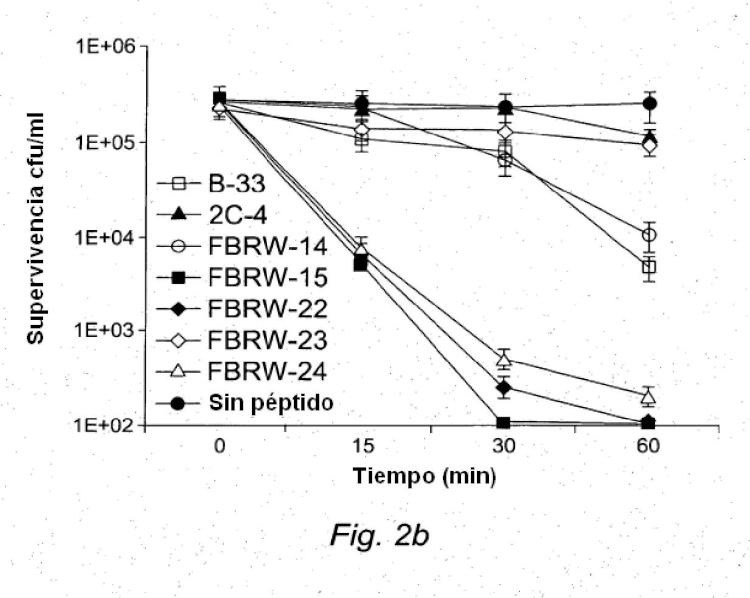
repetido muestra mayor actividad antimicrobiana frente a S. mutans a pH 4,9 que a pH 7,4. En el presente documento también se describe un péptido antimicrobiano, péptido que comprende el siguiente motivo de aminoácido o una permutación circular del siguiente motivo de aminoácido: (H1C1C2H2H3C3H4H5C4C5)n, donde n varía de 1 a 5 y puede aumentar en unidades de 0,1; H1, H2, H3, H4, y H5 son aminoácidos hidrófobos o hidrófilos seleccionados independientemente; C1, C2, C3, C4, y C5 son aminoácidos sin carga, aminoácidos con carga positiva, o aminoácidos con carga negativa seleccionados independientemente; el péptido forma una hélice alfa; y el péptido es eficaz para eliminar o inhibir el crecimiento y/o proliferación de Streptococcus mutans en cultivo. En ciertos casos C1, C2, C3, C4, y C5 son aminoácidos con carga positiva, o aminoácidos con carga negativa seleccionados independientemente. En ciertos casos los aminoácidos sin carga se seleccionan independientemente entre el grupo que consiste en S, T, e Y (o análogos, derivados, o sustituciones conservativas de los mismos), y/o los aminoácidos con carga positiva se seleccionan independientemente entre el grupo que consiste en K, R, y H (o análogos, derivados, o sustituciones conservativas de los mismos), y/o los aminoácidos con carga negativa se seleccionan independientemente entre el grupo que consiste en N, Q, D, y E (o análogos, derivados, o sustituciones conservativas de los mismos), y/o los aminoácidos hidrófobos o hidrófilos se seleccionan independientemente entre el grupo que consiste en usando L, I, V, W, y F (o análogos, derivados, o sustituciones conservativas de los mismos). En ciertos casos, el péptido tiene al menos una carga positiva neta de +3 a pH fisiológico. En ciertos casos, n es 1,1; y el péptido comprende el motivo H1C1C2H2H3C3H4H5C4C5H6, donde H6 es un aminoácido hidrófobo seleccionado independientemente. Algunos péptidos con n = 1,1 ilustrativos incluyen, pero no se limitan a FKKFWKWFRRF (SEC ID N°: 31) (B-33), LKRFLKWFKRF (SEC ID N°: 32) (B-34), KLFKRWKHLFR (SEC ID N°: 33) (B-35), RLLKRFKHLFK (SEC ID N°: 34) (B-36), FKTFLKWLHRF (SEC ID N°: 35) (B-37), IKQLLHFFQRF
(SEC ID N°: 36) (B-38), KLLQTFKQIFR (SEC ID N°: 37) (B-39), RILKELKNLFK (SEC ID N°: 38) (B-40),
LKQFVHFIHRF (SEC ID N°: 39) (B-41), VKTLLHIFQRF (SEC ID N°: 40) (B-42), KLVEQLKEIFR (SEC ID N°: 41) (B- 43), RVLQEIKQILK (SEC ID N°: 42) (B-44), VKNLAELVHRF (SEC ID N°: 43) (B-45), ATHLLHALQRF
(SEC ID N°: 44) (B-46), KLAENVKEILR (SEC ID N°: 45) (B-47), RAL-HEAKEALK (SEC ID N°: 46) (B-48),
FHYFWHWFHRF (SEC ID N°: 47) (B-49), LYHFLHWFQRF (SEC ID N°: 48) (B-50), YLFQTWQHLFR
(SEC ID N°: 49) (B-51), YLLTEFQHLFK (SEC ID N°: 50) (B-52), FKTFLQWLHRF (SEC ID N°: 51) (B-53),
IKTLLHFFQRF (SEC ID N°: 52) (B-54), KLLQTFNQIFR (SEC ID N°: 53) (B-55), TILQSLKNIFK (SEC ID N°: 54) (B- 56), LKQFVKFIHRF (SEC ID N°: 55) (B-57), VKQLLKIFNRF (SEC ID N°: 56) (B-58), KLVQQLKNIFR (SEC ID N°: 57) (B-59), RVLNQVKQILK (SEC ID N°: 58) (B-60), VKKLAKLVRRF (SEC ID N°: 59) (B-61), AKRLLKVLKRF
(SEC ID N°: 60) (B-62), KLAQKVKRVLR (SEC ID N°:... [Seguir leyendo]
Reivindicaciones:
1. Un péptido antimicrobiano activado con ácido que comprende una secuencia de aminoácidos seleccionada entre el grupo que consiste en HHFFHHFHHFFHHF (SEC ID N°: 109) (AA-1), FHFFHHFFHFFHHF (SEC ID N°: 110) (AA- 2), KLLKGATFHFFHHFFHFFHHF (SEC ID N°: 111) (AA-3), KLLKFHFFHHFFHFFHHF (SEC ID N°: 112) (AA-4), y FHFFHHFFHFFHHFKLLK (SEC ID N°: 113) (AA-5), donde dicho péptido muestra mayor actividad antlmlcroblana frente a S. mutans a pH 4,9 que a pH 7,4.
2. Un péptido antimicrobiano de acuerdo con la reivindicación 1, donde dicho péptido porta uno o más grupos protectores.
3. Un péptido antimicrobiano de acuerdo con la reivindicación 2, donde dicho péptido porta uno o más grupos protectores seleccionados entre el grupo que consiste en acetilo (Ac), amida, un grupo alquilo con 3 a 20 carbonos, Fmoc, Tboc, grupo 9-fluorenoacetilo, grupo 1-fluorenocarboxilico, grupo 9-fluorenocarboxílico, grupo 9-fluorenona-1- carboxíllco, benciloxicarbonllo, Xantilo (Xan), Tritilo (Trt), 4-met¡ltr¡t¡lo (Mtt), 4-metoxitritilo (Mmt), 4-metox¡-2,3,6- trlmetll-bencenosulfonilo (Mtr), Mesitileno-2-sulfonilo (Mts), 4,4-dimetoxibenzhidrilo (Mbh), Tosilo (Tos), 2,2,5,7,8- pentametil croman-6-sulfonilo (Pmc), 4-metllbencilo (MeBzl), 4-metoxibencilo (MeOBzl), Benciloxi (BzlO), Bencilo (Bzl), Benzoílo (Bz), 3-nitro-2-piridinasulfenilo (Npys), 1-(4,4-d¡mentil-2,6-diaxociclohexiliden)et¡lo (Dde), 2,6- diclorobencilo (2,6-DICI-Bzl), 2-clorobenclloxlcarbonilo (2-CI-Z), 2-bromobenciloxicarbonilo (2-Br-Z), Benciloximetilo (Bom), t-butoxi-carbonllo (Boc), ciclohexiloxi (cHxO), t-butoximetilo (Bum), t-butoxi (tBuO), t-Butilo (tBu), y Trifluoroacetilo (TFA).
4. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido comprende la secuencia HHFFHHFHHFFHHF (SEC ID N°: 109) (AA-1).
5. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido consiste en la secuencia HHFFHHFHHFFHHF (SEC ID N°: 109) (AA-1).
6. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido comprende la secuencia FHFFHHFFHFFHHF (SEC ID N°: 110)(AA-2).
7. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido consiste en la secuencia FHFFHHFFHFFHHF (SEC ID N°: 110)(AA-2).
8. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido comprende la secuencia KLLKGATFHFFHHFFHFFHHF (SEC ID N°: 111) (AA-3).
9. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido consiste en la secuencia KLLKGATFHFFHHFFHFFHHF (SEC ID N°: 111) (AA-3).
10. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido comprende la secuencia KLLKFHFFHHFFHFFHHF (SEC ID N°: 112) (AA-4).
11. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido consiste en la secuencia KLLKFHFFHHFFHFFHHF (SEC ID N°: 112) (AA-4).
12. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido comprende la secuencia FHFFHHFFHFFHHFKLLK (SEC ID N°: 113) (AA-5).
13. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la secuencia de aminoácidos de dicho péptido consiste en la secuencia FHFFHHFFHFFHHFKLLK (SEC ID N°: 113) (AA-5).
14. Una formulación farmacéutica que comprende un péptido antimicrobiano de acuerdo con cualquiera de las reivindicaciones 1-13; y un excipiente farmacéuticamente aceptable.
15. Una formulación farmacéutica de acuerdo con la reivindicación 14, donde:
(i) dicha formulación es una formulación de dosificación unitaria; o
(ii) dicho excipiente es aceptable para administración a una mucosa oral.
16. Un producto para el cuidado de la salud que comprende
un péptido antimicrobiano de acuerdo con cualquiera de las reivindicaciones 1-13, donde dicho péptido antimicrobiano está contenido en un producto seleccionado entre el grupo que consiste en pasta de dientes, enjuague bucal, una tira o solución de blanqueado de dientes, un almacenamiento de lentes de contacto, solución humectante o de limpieza, hilo dental, un palillo de dientes, una cerda de cepillo de dientes, una pulverización oral, una pastilla para chupar oral, una pulverización nasal, un pulverizador para aplicación oral y/o nasal, y un apósito
para heridas.
17. Un péptido antimicrobiano de acuerdo con una cualquiera de las reivindicaciones 1-13 para uso en un método para inhibir el crecimiento y/o la proliferación de una bacteria, comprendiendo dicho método poner en contacto dicha 5 bacteria con una cantidad suficiente para inhibir el crecimiento y/o proliferación de dicha bacteria.
Patentes similares o relacionadas:
Péptido basado en colágeno tipo II alfa-1 útil para el tratamiento de una enfermedad de la superficie ocular, del 15 de Julio de 2020, de EYEBIO KOREA: Un péptido que consiste en una secuencia de aminoácidos representada por SEQ ID NO: 1.
Péptido que tiene actividad antiinflamatoria, y uso del mismo, del 8 de Julio de 2020, de CAREGEN CO., LTD: Un péptido que consiste en una secuencia de aminoácidos de SEQ ID NO: 1, SEQ ID NO: 2 o SEQ ID NO: 3.
Péptido que tiene actividades antiinflamatoria, osteogénica y promotora del crecimiento del cabello, y uso del mismo, del 24 de Junio de 2020, de CAREGEN CO., LTD: Un péptido que tiene actividad antiinflamatoria, que consiste en la secuencia de aminoácidos SEQ ID NO: 2.
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]
Anticuerpos monoclonales humanizados y quiméricos para CD99, del 17 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un anticuerpo monoclonal humanizado aislado que se une específicamente a CD99 humano, y comprende: (a) una cadena ligera que comprende la secuencia de aminoácidos expuesta […]
Péptido con eficacia antiobesidad y antidiabética y uso del mismo, del 17 de Junio de 2020, de CAREGEN CO., LTD: Un péptido que consiste en la secuencia de aminoácidos de SEQ ID NO: 1 o SEQ ID NO: 2.
Péptido que tiene actividades antiinflamatoria, osteogénica y de fomento del crecimiento del pelo, y uso del mismo, del 17 de Junio de 2020, de CAREGEN CO., LTD: Péptido que tiene actividad antiinflamatoria, que consiste en secuencias de aminoácidos de SEQ ID NO: 3.
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]