Método de detección de niveles muy bajos de analito en una muestra fluida de película delgada contenida en una cámara de pequeño espesor.
Un método para realizar un inmunoensayo de una muestra de fluido biológico para la cuantificación de un analito diana en una cámara de muestra de película delgada en el que la cámara tiene un espesor de 10 μ
m o menos, comprendiendo dicho método las etapas de:
proporcionar una pluralidad de anticuerpos o ligandos (6) de captura específicos del analito diana, suficiente para unir todo el analito (12) diana añadido, los cuales están fijos a una superficie (4) de una cámara de prueba (2) de la muestra de película delgada o a estructuras inmovilizadas en la cámara de análisis (2), siendo dichos anticuerpos o ligandos (6) de captura específicos de un primer epítopo o epítopos en las moléculas (12) de analito diana que están presentes en dicha muestra de fluido biológico;
llenar dicha cámara (2) de prueba de la muestra con una mezcla de dicha muestra de fluido biológico y nanopartículas fluorescentes (8, 8', 10, 10') acopladas a anticuerpos que se unen selectivamente a un segundo epítopo o epítopos de las moléculas (12) de analito diana, que están presentes en dicha muestra de fluido biológico; y
fotografiar dicha muestra quiescente en dicha cámara (2) de prueba de la muestra y contar las moléculas de analito diana (12) que son capturadas por dichos anticuerpos o ligandos (6) de captura inmóviles y haciéndolos detectables fotografiando las nanopartículas fluorescentes inmovilizadas (10, 10') acopladas a anticuerpos que están unidos a un segundo epítopo sobre el analito diana inmovilizado (12).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/039283.
Solicitante: ABBOTT POINT OF CARE, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 400 COLLEGE ROAD EAST PRINCETON, NJ 08540 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WARDLAW, STEPHEN C., LEVINE, ROBERT A..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- B82Y15/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano tecnología para interactuar, detectar o actuar, p. ej. puntos cuánticos como marcadores en ensayos de proteínas o motores moleculares.
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/58 G01N 33/00 […] › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
PDF original: ES-2548133_T3.pdf
Fragmento de la descripción:
Método de detección de niveles muy bajos de analito en una muestra fluida de película delgada contenida en una cámara de pequeño espesor
ANTECEDENTES DE LA INVENCIÓN
1. Campo técnico
Esta invención se refiere a un método y a un aparato para la detección y cuantificación de niveles muy bajos de un analito diana utilizando un sistema de imagen tal como el divulgado en la patente US-6.929.953. El documento WO 95/17675 describe un método de ensayo. El documento W02005/012505 describe la detección basada en nanopartículas y micropartículas de productos celulares. En el caso de algunos analitos tales como ciertas hormonas, por ejemplo TSH, sus niveles pueden ser tan bajos como varias decenas de miles de moléculas por microlitro. Estos niveles extremadamente bajos pueden ser medidos mediante el uso de la presente invención para contar las moléculas individuales del analito. La invención también tiene la ventaja de ser un método cuantitativo primario, y por lo tanto, no necesita normalización.
RESUMEN DE LA INVENCIÓN
De acuerdo con un primer aspecto de la invención, se proporciona un método como se reivindica en la reivindicación 1.
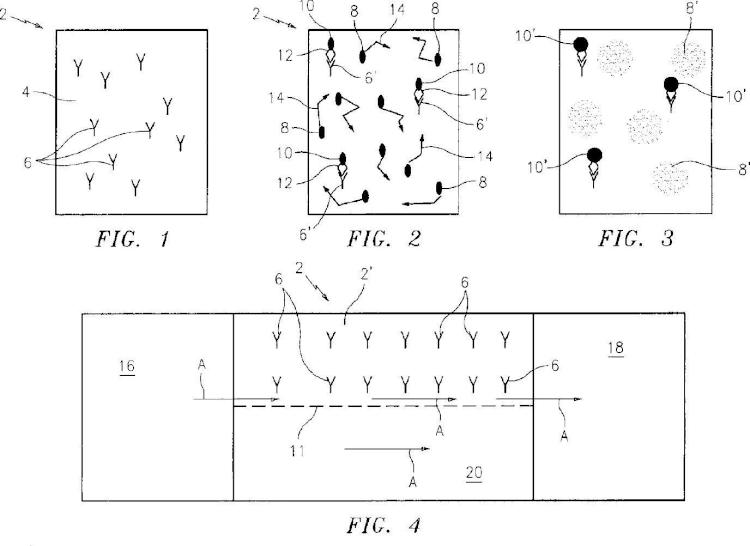
El método es para la detección y cuantificación de un analito diana definido dispuesto, por ejemplo, como una muestra de fluido biológico de película delgada contenida en una cámara plana de espesor delgado de generalmente aproximadamente dos mieras (2 p) a diez mieras (10 p) de espesor. El analito diana tiene al menos dos epítopos. El método funciona mediante la unión de moléculas individuales del analito diana definido a un sustrato inmóvil aunque en un ensayo se pueden emplear aglutinantes dirigidos contra más de un epítopo. El sustrato tiene un anticuerpo de captura o ligando unido al mismo. Los anticuerpos o ligandos se dirigen contra un primer epítopo o epítopos del analito diana, y son operables para inmovilizar el analito y prevenir su difusión; es decir, para enlazar el analito diana al sustrato. El analito diana unido se detecta a continuación mediante el uso de una sonda marcada. La sonda contiene uno o más anticuerpos o ligandos unidos a su superficie, cuyo anticuerpo o ligando está dirigido contra un segundo epítopo o epítopos del analito diana.
El primer y segundo epítopos tipo deben estar espacialmente situados en los analitos diana de manera que la unión de un epítopo no impide la unión del segundo epítopo. El término "anticuerpo" y "ligando" se referirá a cualquier sustancia capaz de unirse fuertemente y específicamente a un epítopo diana e incluirán inmunoglobulinas, aptímeros y cualesquiera agentes de unión biológicos de alta afinidad de unión similar.
Este método es adecuado para detectar e identificar cualquier analito diana que tenga al menos dos epítopos accesibles. Un ejemplo de un analito diana tal es la TSH (hormona estimulante del tiroides). Una muestra de espécimen de fluido biológico, preferiblemente plasma o suero sanguíneo, se introduce en una cámara cuyas dimensiones superficiales se eligen para permitir el número contable máximo de moléculas del analito diana por unidad de área de la muestra como se describe a continuación.
La superficie inferior o superior de la cámara está formada por una lámina de plástico a la que están unidos anticuerpos anti-alfa-TSH, en una cantidad en exceso de la necesaria para capturar la mayor cantidad del analito diana que se desea medir. Los anticuerpos de captura deben estar unidos de manera irrevocable al sustrato inmóvil, de forma que durante el ensayo, los anticuerpos no dejan la superficie a la que están unidos. Esta zona se llama el área de captura.
La muestra de plasma sanguíneo o suero se añade a la cámara y todas las moléculas de TSH de la muestra se unirán al sustrato inmóvil que contiene los anticuerpos de captura, inmovilizando de ese modo todas las moléculas presentes en la muestra. El espesor de la cámara delgada (generalmente menos de diez mieras (10 pm) permite la difusión molecular vertical rápida, de modo que la difusión entre las dos capas de la cámara delgada se produce rápidamente, permitiendo así que todas las moléculas del analito entren en contacto con la superficie del anticuerpo de captura. Idealmente, el plasma, u otro fluido biológico a examinar, debe ser transparente y estar libre de partículas tales como las células que podrían interferir con la unión del analito o la detección de la señal en el ensayo.
Al mismo tiempo, o después de un breve período de incubación inicial, se añaden las nanopartículas fluorescentes que se unen a anticuerpos, tales como anticuerpos anti-beta-TSH, que son específicos de un segundo epítopo del analito, a la muestra, también en cantidad en exceso de la necesaria para unir el número máximo de moléculas a ser contadas. Las nanopartículas son preferiblemente de diez a 100 nanómetros (10 a 100 nm) de diámetro y consisten en un material fluorescente de europio, o cualquier nanopartícula detectable, tales como las llamadas puntos cuánticos u otras nanopartículas fluorescentes (Sigma Aldrich, St. Louis, MO, EE.UU. es un proveedor). Estas
nanopartículas fluorescentes deben ser lo suficientemente pequeñas y de tal densidad que permanezcan en suspensión coloidal a menos que su anticuerpo unido a la superficie se una a un analito inmovilizado.
Una sola nanopartícula fluorescente que contiene un anticuerpo/ligando dirigido contra el segundo epítopo de los analitos de TSH se unirá a cada molécula de TSH que está unida al sustrato. Esas nanopartículas fluorescentes que no están inmovilizados en virtud de su adhesión al analito inmovilizado seguirán estando en suspensión coloidal y se moverán debido al movimiento browniano. Para distinguir las nanopartículas unidas de las nanopartículas no unidas, se toma una imagen de la cámara de prueba con iluminación fluorescente adecuada, en el plano focal de las partículas unidas, después de la incubación durante un periodo de tiempo que es el tiempo suficiente para conseguir un aumento medible en la señal debido a las nanopartículas que emiten luz inmóvil, en comparación con las nanopartículas que emiten luz en movimiento, lo cual provocará una luz de fondo debido a las nanopartículas que generan una señal no unida. Este tiempo de exposición se puede determinar de forma adaptativa con el instrumento de medición, pero limitado en su extensión superior ya que es posible que las áreas no tengan nanopartículas unidas. Esas nanopartículas que permanecen en un solo lugar, ya están fijas al sustrato, pondrán todos sus fotones en tan sólo unos pocos píxeles, mientras que las que "bailan" alrededor debido a movimiento browniano distribuirán su brillo sobre un área mucho más grande, de modo que es posible la detección de partículas inmóviles. Un área superficial de la cámara que está libre de anticuerpos de captura puede servir como el área de control.
Usando esta técnica, la concentración de las nanopartículas en el área de la imagen debe ser lo suficientemente pequeña para que no se superpongan por completo y disminuyan la capacidad del sensor para distinguir las partículas inmóviles. El número de partículas fluorescentes distinguibles inmóviles individuales es, por lo tanto, igual al número de moléculas del analito diana contenidas en el volumen de la cámara por encima o por debajo de los anticuerpos de captura dentro del área de captura. Dado que el volumen del fluido por encima del área de control es relativamente pequeño en comparación con el volumen por encima del anticuerpo de captura inmovilizado o ligando, este puede ser ignorado a efectos de calcular el volumen total de la cámara o paso estrecho, actuando como una barrera de difusión que separa el área de control del área de captura, que puede usarse para obtener un volumen de cámara exacto sobre el área de captura. Como alternativa, puede emplearse una barrera impermeable real para separar el área de captura del área de control. El número máximo de moléculas que se pueden medir en la muestra contenida está definido por el área de captura de la cámara y el aumento de píxeles. La concentración del analito diana será el número de moléculas detectadas dividido por el contenido de la muestra en la cámara por encima del área de captura. El volumen de la cámara se define por la altura conocida de la cámara y el área de la muestra, que puede definirse por el número de píxeles dentro del área de la muestra/factor de aumento de píxel. Por lo tanto, si se conocen la altura de la cámara y el aumento, la cantidad de volumen de la muestra también se puede determinar por el instrumento de análisis. Es necesario que las moléculas unidas estén unidas a una distancia suficiente entre sí de modo que... [Seguir leyendo]
Reivindicaciones:
1. Un método para realizar un inmunoensayo de una muestra de fluido biológico para la cuantificación de un analito diana en una cámara de muestra de película delgada en el que la cámara tiene un espesor de 10 pm o menos, comprendiendo dicho método las etapas de:
proporcionar una pluralidad de anticuerpos o ligandos (6) de captura específicos del analito diana, suficiente para unir todo el analito (12) diana añadido, los cuales están fijos a una superficie (4) de una cámara de prueba (2) de la muestra de película delgada o a estructuras inmovilizadas en la cámara de análisis (2), siendo dichos anticuerpos o ligandos (6) de captura específicos de un primer epítopo o epítopos en las moléculas (12) de analito diana que están presentes en dicha muestra de fluido biológico;
llenar dicha cámara (2) de prueba de la muestra con una mezcla de dicha muestra de fluido biológico y nanopartículas fluorescentes (8, 8', 10, 10') acopladas a anticuerpos que se unen selectivamente a un segundo epítopo o epítopos de las moléculas (12) de analito diana, que están presentes en dicha muestra de fluido biológico; y
fotografiar dicha muestra quiescente en dicha cámara (2) de prueba de la muestra y contar las moléculas de analito diana (12) que son capturadas por dichos anticuerpos o ligandos (6) de captura inmóviles y haciéndolos detectables fotografiando las nanopartículas fluorescentes inmovilizadas (10, 10') acopladas a anticuerpos que están unidos a un segundo epítopo sobre el analito diana inmovilizado (12).
2. El método de la reivindicación 1 en el que dichas nanopartículas (8, 8', 10, 10') son puntos cuánticos.
3. El método de la reivindicación 1 en el que las nanopartículas fluorescentes (10, 10') que se han inmovilizado debido a la unión a moléculas de analito diana capturadas en la muestra pueden ser fotométricamente distinguidas de las nanopartículas libres (8, 8') en la muestra como resultado del movimiento de las nanopartículas libres (8, 8') debido al fenómeno de movimiento browniano en la muestra.
4. El método de la reivindicación 1 en el que las nanopartículas fluorescentes (10, 10') son puntos cuánticos que se han convertido en inmovilizados debido a la unión a las moléculas (12) de analito diana capturadas en la muestra y que pueden distinguirse fotométricamente de las nanopartículas libres (8, 8') en la muestra debido al movimiento de las nanopartículas libres (8, 8') que resultan del fenómeno de movimiento browniano en la muestra.
5. El método de la reivindicación 1, en el que el material ensayado está sin diluir.
6. El método de la reivindicación 1, en el que la cámara (2) contiene un área de control libre de anticuerpos o ligandos (6) de captura.
7. El método de la reivindicación 6, en el que el número de señales discretas detectables por área fotografiada en el área de captura es mayor que las señales discretas detectables por área fotografiada en el área de control y la diferencia por área multiplicado por el área del área de captura es igual al número de moléculas de analito diana capturadas.
8. El método de la reivindicación 6, en el que el número de señales discretas detectables por área fotografiada en el área de captura es mayor que el de las señales discretas detectables por área fotografiada en el área de control y es proporcional al número de moléculas de analito diana capturadas en el área de captura.
9. El método de la reivindicación 6 en el que el número de señales discretas detectables por área fotografiada en el área de captura es mayor que el de las señales discretas detectables por área fotografiada en el área de control y que es indicativo de la presencia del analito diana en la muestra.
10. El método de la reivindicación 1 en el que el volumen de la muestra aplicado es mayor que el volumen de la cámara de análisis (2).
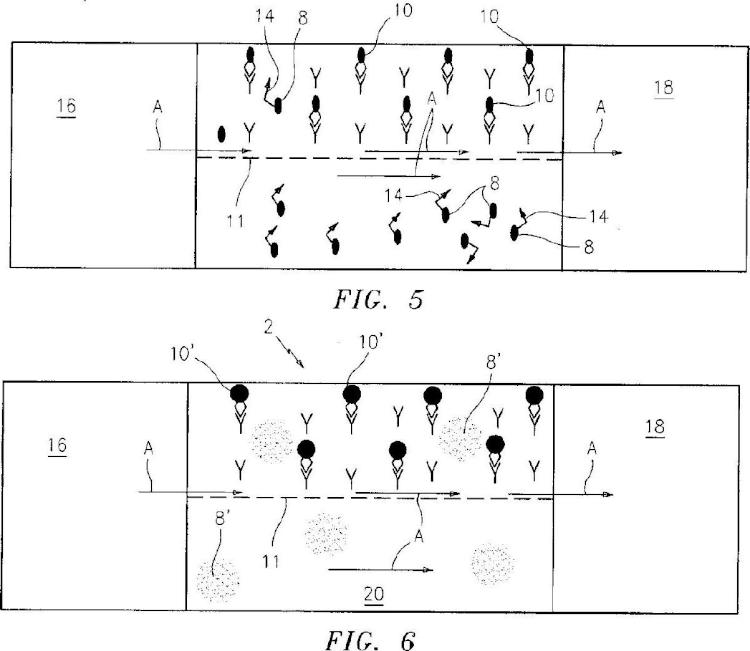
11. Un método para realizar un inmunoensayo de una muestra de fluido biológico para la cuantificación de un analito diana en una cámara de la muestra de película delgada, comprendiendo dicho método las etapas de:
proporcionar un suministro de una mezcla de dicha muestra de fluido biológico y nanopartículas fluorescentes (8, 8', 10, 10') acopladas a anticuerpos que se unen selectivamente a un segundo epítopo o epítopos de las moléculas (12) de analito diana (12) que están presentes en dicha muestra de fluido biológico, teniendo dicho suministro una capacidad de muestra que es mayor que la capacidad de la muestra de dicha cámara (2) de muestra de película delgada;
proporcionar una pluralidad de anticuerpos o ligandos (6) de captura específicos del analito diana, suficiente para unir todo el analito (12) diana añadido, estando dichos anticuerpos o ligandos (6) fijos a una superficie (2') de una cámara de prueba (2) de la muestra de película delgada o a estructuras inmovilizadas en la cámara de análisis (2), siendo dichos anticuerpos o ligandos (6) de captura específicos de un primer epítopo o epítopos de las moléculas (12) de analito diana que están presentes en dicha muestra de fluido biológico;
movilizar dicha mezcla de dicho suministro a través de dicha cámara (12) de prueba de la muestra dentro de un depósito de recepción de la muestra (18), donde dicho analito diana (12), si está presente en dicha muestra, se unirá a dichos anticuerpos o ligandos (6) de captura en dicha cámara de muestra (2); y
fotografiar dicha cámara (2) de prueba de la muestra y contar las moléculas (12) de analito diana que son 5 capturadas por dichos anticuerpos o ligandos (6) de captura inmóviles y haciéndolos detectables fotografiando
las nanopartículas fluorescentes Inmovilizadas (10, 10') acopladas a anticuerpos que están unidos a dicho primer epítopo del analito diana Inmovilizado (12).
12. El método de la reivindicación 11, en el que dichas nanopartículas (8, 8', 10, 10') son puntos cuánticos.
13. El método de la reivindicación 11, en el que las nanopartículas (10, 10') fluorescentes que se han inmovilizado debido a la unión a moléculas (12) de analito diana capturadas en la muestra pueden distinguirse fotométricamente de las nanopartículas (8, 8') libres en la muestra como un resultado del movimiento de las nanopartículas (8, 8') libres debido al fenómeno de movimiento brownlano en la muestra.
14. El método de la reivindicación 11, en el que las nanopartículas fluorescentes (10, 10') son puntos cuánticos que se han Inmovilizado debido a la unión a moléculas (12) de analito diana capturadas en la muestra y que se pueden distinguir fotométricamente de las nanopartículas libres (8, 8') en la muestra debido al movimiento de las nanopartículas libres (8, 8') resultante del fenómeno de movimiento browniano en la muestra.
15. El método de la reivindicación 1, en el que el número de señales discretas detectables por área fotografiada en el área de captura es mayor que el de las señales discretas detectables por área fotografiada en el área de control (20) en comparación con una curva estándar realizada para calibrar la cámara de prueba con el fin de determinar la concentración de analito en la muestra.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]