Preparación sólida que contiene una forma única de cristal de un derivado de ácido tiazolcarboxílico.
Un comprimido que comprende una forma única de cristal A de ácido 2-(3-ciano-4-isobutiloxifenil)-4-metil-5-tiazol carboxílico,
que tiene un patrón de difracción de polvo de rayos X que tiene picos específicos en un ángulo de reflejo 2θ2º, 7,18º, 12,80º, 13,26º, 16,48º, 19,58º, 21,92º, 22,68º, 25,84º, 26,70º, 29,16º y 36,70º, n excipiente y un agente desintegrante, donde el tamaño medio de partícula de dicha forma única de cristal es de 3 μ50 μ
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2003/003962.
Solicitante: TEIJIN PHARMA LIMITED.
Nacionalidad solicitante: Japón.
Dirección: 2-1, KASUMIGASEKI 3-CHOME CHIYODA-KU TOKYO 100-0013 JAPON.
Inventor/es: NAKAMURA, KAZUHIRO, DOHI, MASAHIKO, MOCHIZUKI, SEIJI, IWAI,MICHIO, MOCHIZUKI,HIROKO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/426 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,3-Tiazoles.
- A61K47/04 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › No-metales; Sus compuestos.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- A61P19/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › Agentes antigotosos, p.ej.agentes antihiperuricémicos o uricosúricos.
- A61P43/00 A61P […] › Medicamentos para usos específicos, no previstos en los grupos A61P 1/00 - A61P 41/00.
- A61P7/00 A61P […] › Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular.
PDF original: ES-2505690_T3.pdf





Fragmento de la descripción:
Preparación sólida que contiene una forma única de cristal de un derivado de ácido tiazolcarboxílico Descripción Campo técnico La presente invención se refiere a una preparación sólida que comprende ácido 2- (3-ciano-4isobutiloxifenil) -4-metil-5-tiazol carboxílico como una forma única de cristal, y un método para producir la misma de acuerdo con las reivindicaciones 1 a 10.
Técnica anterior El ácido 2- (3-ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico tiene una fuerte actividad para inhibir xantina oxidasa o la acción decreciente de ácido úrico, y se espera que es un agente terapéutico para gota o hiperuricemia, y se ha descrito en la Publicación Internacional WO99/65885 y EP0779074.
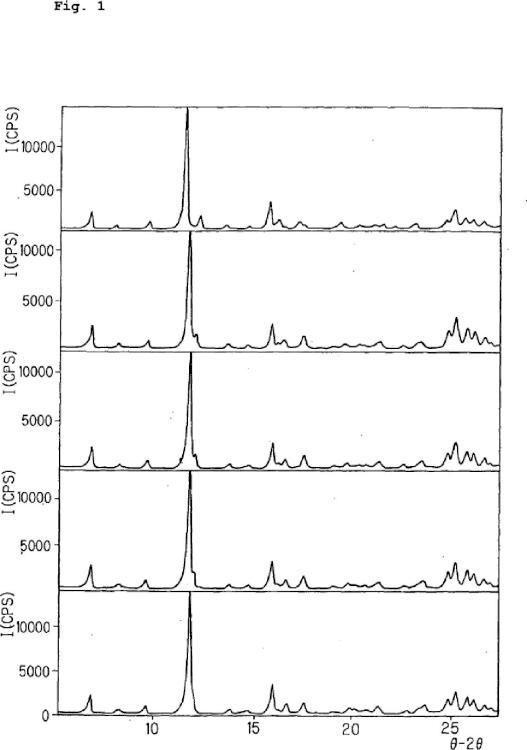
En la Publicación Internacional WO99/65885, se han descrito seis polimorfos cristalinos de ácido 2- (3ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico, esto es, un polimorfo que muestra un patrón de difracción de polvos de rayos X que tiene picos específicos en un ángulo de reflejo 2Î, de aproximadamente 6, 62º , 7, 18º , 12, 80º , 13, 26º , 16, 48º , 19, 58º , 21, 92º , 22, 68º , 25, 84º , 26, 70º , 29, 16º y 36, 70º (cristal A) ; una polimorfo que tiene picos específicos en un ángulo de reflejo 2 Î de aproximadamente 6, 76º , 8, 08º , 9, 74º , 11, 50º , 12, 22º , 13, 56º , 15, 76º , 16, 20º , 17, 32º , 19, 38º , 21, 14º , 21, 56º , 23, 16º , 24, 78º , 25, 14º , 25, 72º , 26, 12º , 26, 68º y 28, 36º (cristal B) ; un polimorfo que tiene picos específicos en un ángulo de reflejo 2Î de aproximadamente 6, 62º , 10, 82º , 13, 36º , 15, 52º , 16, 74º , 17, 40º , 18, 00º , 18, 70º , 20, 16º , 20, 62º , 21, 90º , 23, 50º , 24, 78º , 25, 18º , 34, 08º , 36, 72º y 38, 04º (cristal C) ; un polimorfo que tiene picos específicos en un ángulo de reflejo 2Î de aproximadamente 8, 32º , 9, 68º , 12, 92º , 16, 06º , 17, 34º , 19, 38º , 21, 56º , 24, 06º , 26, 00º , 30, 06º , 33, 60º y 40, 34º (cristal D) , y un polimorfo que tiene picos específicos en un ángulo de reflejo 2Î de aproximadamente 6, 86º , 8, 36º , 9, 60º , 11, 76º , 13, 74º , 14, 60º , 15, 94º , 16, 74º , 17, 56º , 20, 00º , 21, 26º , 23, 72º , 24, 78º , 25, 14º , 25, 74º , 26, 06º , 26, 64º , 27, 92º , 28, 60º , 29, 66º y 29, 98º (cristal G) , y un amorfo (también referido como cristal E) .
En dicha Publicación Internacional WO99/65885, se describe que los cristales A, C y G son útiles en vista de su retención de una forma de cristal en almacenamiento a largo plazo. Entre ellos, el cristal A es preferente en vista de su superioridad industrial.
Sin embargo, la publicación no dice nada sobre los medios de superioridad industrial. Además, la publicación no tiene pruebas (datos) que apoyen el hecho de que el cristal A es preferente en vista de su superioridad industrial.
EP 0 779 074 y EP 0 513 379 desvelan comprimidos que contienen ácido 2- (3-ciano-4-isobutiloxifenil) -4metil-5-tiazol carboxílico como posible principio activo. EP1020454 desvela la forma correspondiente de cristal A con el patrón de difracción de polvo de rayos X.
Los presentes inventores investigaron este problema y descubrieron que, al formular ácido 2- (3-ciano-4isobutiloxifenil) -4-metil-5-tiazol carboxílico, no es posible obtener preparaciones que no tengan variación en los perfiles de disolución de fármacos, incluso si tal forma de cristal se usa como se piensa por ser la más estable en una prueba de estabilidad física. Además, descubrieron que hay una forma de cristal que es adecuada para preparar preparaciones, con independencia de las características de los cristales (incluyendo amorfo) de las sustancias fármacos y han alcanzado la invención.
Un objeto de la invención es, por lo tanto, proporcionar preparaciones sólidas de ácido 2- (3-ciano-4isobutiloxifenil) -4-metil-5-tiazol carboxílico que sean estables y que tengan poca variación en los perfiles de disolución.
Divulgación de la invención La invención proporciona preparaciones sólidas que contienen una forma única de cristal A de ácido 2- (3ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico, excipientes y agentes desintegrantes donde el tamaño medio de partícula de dicha forma única de cristal es de 3 μm a 50 μm de acuerdo con la reivindicación 1.
Además, la invención proporciona un proceso para producir preparaciones sólidas que contienen una forma única de cristal A de ácido 2- (3-ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico, excipientes y agentes desintegrantes donde el tamaño medio de partícula de dicha forma única de cristal es de 3 μm a 50 μm de acuerdo con la reivindicación 10.
Breve descripción de los dibujos La Fig. 1 es un patrón de difracción de polvos de rayos X que muestra la transformación de cristal B en el Ejemplo Referencial 1.
La Fig. 2 es un patrón de difracción de polvos de rayos X que muestra la transformación de cristal D en el Ejemplo Referencial 1.
La Fig. 3 es un patrón de difracción de polvos de rayos X que muestra la transformación de cristal E en el Ejemplo Referencial 1.
La Fig. 4 son datos que muestran la velocidad de transformación de cristal B en el Ejemplo Referencial 1 (estado abierto a 40 º C/75% HR) .
La Fig. 5 son datos que muestran la velocidad de transformación de cristal D en el Ejemplo Referencial 1 (estado abierto a 40 º C/75% HR) .
La Fig. 6 son datos que muestran la velocidad de transformación de cristal E en el Ejemplo Referencial 1 (estado abierto a 40 º C/75% HR) .
La Fig. 7 muestra perfiles de disolución de comprimidos que contienen cristal A (partículas 1 a 4) en el Ejemplo 4, teniendo cada uno un tamaño de partícula medio diferente.
Mejor modo de realizar la invención La forma única de cristal A del ácido 2- (3-ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico (también referido como sustancia fármaco de la invención) en el comprimido de la invención es aquella que tiene un espectro característico cuando la sustancia fármaco se analiza mediante una RMN sólida o que tiene picos específicos cuando se analiza mediante una difracción de polvo de rayos X.
El cristal de la invención, esto es, el cristal A de la sustancia fármaco de la invención tiene, cuando se analiza mediante un 15N-RMN sólida, un espectro que tiene señales específicas en 226 ppm, 228 ppm, 276 ppm y 282 ppm. Cuando se analiza mediante una 13C-RMN sólida, el cristal A tiene aproximadamente un pico doblete equivalente en 20 ppm.
Además, el cristal de la sustancia fármaco de la invención muestra un patrón de difracción de polvo de rayos X que tiene picos específicos en un ángulo de reflejo de 2Î, de aproximadamente 6, 62º , 7, 18º , 12, 80º , 13, 26º , 16, 48º , 19, 58º , 21, 92º , 22, 68º , 25, 84º , 26, 70º , 29, 16º y 36, 70º .
El cristal de la sustancia fármaco de la invención puede producirse mediante el método mostrado en, por ejemplo, la Publicación Internacional WO 92/09279 y WO 99/65885.
El cristal de la sustancia fármaco de la invención está contenida en la preparación sólida de la invención preferentemente en una cantidad de 1 a 50 partes por peso en base a 100 partes por peso de la preparación sólida.
No hay restricciones particulares para el tamaño medio de partícula del cristal de la sustancia fármaco de la invención contenida en la preparación sólida de la invención. El tamaño medio de partícula es preferentemente 3 μm
o más y 50 μm o menos, cuando se determina mediante un análisis de imagen.
Ejemplos de excipientes para la preparación sólida de la invención incluyen lactosa, lactosa anhidra, celulosa cristalina, almidón de maíz, almidón pre-gelatinizado, almidón parcialmente pre-gelatinizado, D-manitol y fosfato cálcico dibásico. Particularmente la lactosa, la celulosa cristalina, almidones o sus combinaciones son preferentes. Los excipientes están contenidos en una cantidad de 50 a 98 partes por peso, y más preferentemente 60 a 95 partes por peso, en base a 100 partes por peso de la preparación sólida.
Ejemplos del agente desintegrante para la preparación sólida de la invención incluyen carmelosa sódica, carmelosa cálcica, hidroxipropilcelulosa de baja sustitución, croscarmelosa sódica, almidón de carboximetilo sódico y crospovidona. Particularmente la croscarmelosa sódica y el almidón parcialmente pre-gelatinizado son preferentes. El agente desintegrante está contenido en una cantidad de 1 a 25 partes por peso, preferentemente 1, 5 a 20 partes por peso, en base a 100 partes por peso de la preparación sólida.
Pueden añadirse muchos aglutinantes, lubricantes, agentes de... [Seguir leyendo]
Reivindicaciones:
1. Un comprimido que comprende una forma única de cristal A de ácido 2- (3-ciano-4-isobutiloxifenil) -4-metil-5-tiazol carboxílico, que tiene un patrón de difracción de polvo de rayos X que tiene picos específicos en un ángulo de reflejo 2Î de 6, 62º , 7, 18º , 12, 80º , 13, 26º , 16, 48º , 19, 58º , 21, 92º , 22, 68º , 25, 84º , 26, 70º , 29, 16º y 36, 70º , un excipiente y un agente desintegrante, donde el tamaño medio de partícula de dicha forma única de cristal es de 3 μm a 50 μm.
2. Un comprimido de acuerdo con la reivindicación 1, que contienen dicho cristal único en una cantidad de 1 a 50 partes por peso en base a 100 partes por peso del comprimido.
3. Un comprimido de acuerdo con la reivindicación 1 o reivindicación 2, donde dicho excipiente es uno o más seleccionado del grupo consistente en lactosa, lactosa anhidra, celulosa cristalina, almidón de maíz, almidón pregelatinizado, almidón parcialmente pre-gelatinizado, D-manitol y fosfato cálcico dibásico.
4. Un comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 3, que además comprende un aglutinante.
5. Un comprimido de acuerdo con la reivindicación 4, donde dicho aglutinante es uno o más seleccionado del grupo consistente en hidroxipropilcelulosa, hidroxipropilmetilcelulosa, y polivinilpirrolidona.
6. Un comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 5 preparado mediante un método de granulado húmedo.
7. Un comprimido de acuerdo con la reivindicación 1, donde dicho excipiente es uno o más seleccionado del grupo consistente en lactosa y almidón parcialmente pre-gelatinizado.
8. Un comprimido de acuerdo con la reivindicación 1 o reivindicación 7, que además comprende un aglutinante que es hidroxipropilcelulosa.
9. Un comprimido obtenido al cubrir el comprimido de la reivindicación 1 con un líquido de revestimiento que comprende agua purificada, glicol de polietileno e hidroxipropilmetilcelulosa.
10. Un método para producir un comprimido que comprende una forma única de cristal A de ácido 2- (3-ciano-4isobutiloxifenil) -4-metil-5-tiazol carboxílico, que tiene un patrón de difracción de polvo de rayos X que tiene picos específicos en un ángulo de reflejo 2Î de 6, 62º , 7, 18º , 12, 80º , 13, 26º , 16, 48º , 19, 58º , 21, 92º , 22, 68º , 25, 84º , 26, 70º , 29, 16º y 36, 70º , un excipiente y un agente desintegrante, donde el tamaño medio de partícula de dicha forma única de cristal es de 3 μm a 50 μm.
11. Un método para producir un comprimido de acuerdo con la reivindicación 10, donde dicho comprimido contiene dicho cristal único en una cantidad de 1 a 50 partes por peso en base a 100 partes por peso del comprimido.
12. Un método para producir un comprimido de acuerdo con la reivindicación 10 o reivindicación 11, donde dicho excipiente es uno o más seleccionado del grupo consistente en lactosa, lactosa anhidra, celulosa cristalina, almidón de maíz, almidón pre-gelatinizado, almidón parcialmente pre-gelatinizado, D-manitol y fosfato cálcico dibásico.
13. Un método para producir un comprimido de acuerdo con una cualquiera de las reivindicaciones 10 a 12, donde dicho comprimido comprende además un aglutinante.
14. Un método para producir un comprimido de acuerdo con la reivindicación 13, donde dicho aglutinante es uno o más seleccionado del grupo consistente en hidroxipropilcelulosa, hidroxipropilmetilcelulosa y polivinilpirrolidona.
15. Un método para producir un comprimido de acuerdo con una cualquiera de las reivindicaciones 10 a 14 que comprende una etapa de granulado húmedo.
16. Un método para producir un comprimido de acuerdo con la reivindicación 10, donde dicho excipiente es uno o más seleccionado del grupo consistente en lactosa y almidón parcialmente pre-gelatinizado.
17. Un método para producir un comprimido de acuerdo con la reivindicación 10 o reivindicación 16, que además comprende un aglutinante que es hidroxipropilcelulosa.
18. Un método para producir un comprimido de acuerdo con la reivindicación 10, que además comprende una etapa de recubrimiento de comprimido con un líquido de revestimiento, donde dicho líquido de revestimiento comprende agua purificada, glicol de polietileno e hidroxipropilmetilcelulosa.
19. Un comprimido de acuerdo con una cualquiera de las reivindicaciones 1 a 9 para su uso en el tratamiento de gota o hiperuricemia.
Patentes similares o relacionadas:
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Derivado de dihidroindolizinona, del 1 de Julio de 2020, de ONO PHARMACEUTICAL CO., LTD.: (3S)-3-[2-(6-amino-2-fluoro-3-piridinil)-4-fluoro-1H-imidazol-5-il]-7-[5-cloro-2-(1H-tetrazol-1-il)fenil]-2,3-dihidro- (1H)-indolizinona, una…
Inhibidor de fibrosis, del 1 de Julio de 2020, de NIPPON SHINYAKU CO., LTD.: Composición farmacéutica que comprende un derivado heterocíclico seleccionado de ácido 2-{4-[N-(5,6-difenilpirazin-2-il)-N-isopropilamino]butiloxi}acético […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]