Inmunoensayos para topiramato.
Un sistema para usar en un ensayo inmunodiagnóstico para detectar la presencia de topiramato en una muestra,
comprendiendo el sistema:
un anticuerpo anti-topiramato producido contra una composición inmunogénica que incluye un inmunógeno que tienen una estructura de fórmula 1, en el que L-X-Y es NH(CH2)2NHCO(CH2)6CO-Z, en donde Z es un resto inmunogénico seleccionado de uno de BSA o KLH; y**Fórmula**
un análogo de topiramato que tiene una estructura química de Fórmula 1;**Fórmula**
en la que:
L es uno del grupo NH(CH2)2NH, NHCO, NHCH2Ph, SO2, COO o O;
X es al menos uno de un enlace entre L e Y, un grupo aromático o un grupo alifático; y
Y se selecciona del grupo que consiste en alifático, alcohol, amina, amida, ácido carboxílico, aldehído, éster, éster activado, éster alifático, imidoéster, isocianato, isotiocianato, anhídrido, tiol, tiolactona, diazonio, maleimido, NHS, O-NHS y un enlazador derivado de los mismos acoplado a un grupo operativo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/038257.
Solicitante: Seradyn, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 46360 Fremont Blvd. Fremont, California 94538 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ARABSHAHI,LILI, OUYANG,ANLONG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2524603_T3.pdf

Fragmento de la descripción:
Inmunoensayos para topiramato Antecedentes de la invención
1. Campo de la invención
La presente invención se refiere a reactivos inmunodiagnósticos para topiramato y a protocolos. Más particularmente, la presente invención se refiere a topiramato, análogos de topiramato, inmunógenos y antígenos preparados a partir de análogos de topiramato, anticuerpos preparados a partir de inmunógenos basados en topiramato y a procedimientos de fabricar y usar los mismos.
2. Tecnología relacionada
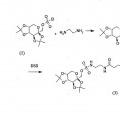
El topiramato está representado químicamente como sulfamato de 2,3:4,5-bis--(1-metil-etiliden-(B-D-fructopiranosa o sulfamato de 2,3:4,5-di--isopropiliden-beta-D-fructopiranosa, que se muestra a continuación. El topiramato es un fármaco antiepiléptico ("FAE") y no está químicamente relacionado con muchos FAE existentes. La FDA aprobó el topiramato, que es el principio activo de TOPAMAX®, en 1996 para su uso como terapia adyuvante en el tratamiento de adultos con convulsiones parciales con o sin generalización secundaria y también puede ser útil para el síndrome de Lennox-Gastaut y los espasmos infantiles.
Es bien conocido que varios fármacos, tales como los FAE, pueden tener diferentes perfiles farmacocinéticos y/o farmacodinámicos en poblaciones de pacientes diferentes, que tienen como resultado el control de fármacos terapéuticos ("CFT") de los FAE para que sean importantes vitalmente. Un objetivo de un programa de CFT es optimizar el desenlace clínico de un paciente tratando y/u optimizando un régimen de medicamentos con la ayuda de la determinación de las concentraciones del fármaco a varios tiempos tras la administración. De acuerdo con lo anterior, la dosis y el régimen del fármaco se pueden modular para un solo paciente o población de pacientes basándose en el CFT.
Varias características del topiramato indican que existe la necesidad clínica de individualizar la terapia para pacientes a través del uso de CFT. Se ha indicado que existen grandes variaciones entre individuos en la dosis frente a las concentraciones en suero en los pacientes. Asimismo, la variabilidad farmacocinética desempeña un papel importante en los requisitos de dosis de topiramato que son necesarias para alcanzar concentraciones séricas óptimas.
Se ha indicado que un intervalo adecuado de concentraciones óptimas en suero para topiramato sería de 7 a 24 |imol/l en pacientes que reciben una dosis de topiramato de 125 a 4 mg además de otros FAE. Algunos pacientes que reciben dosis considerablemente más altas, que pueden ser de hasta 2. mg, tenían concentraciones sistémicas de topiramato tan elevadas como de 8 |imol/l. Se puede usar un CFT eficaz para predecir regímenes de dosificación que pueden obtener concentraciones de topiramato adecuadas dentro del índice terapéutico.
Adicionalmente, se han realizado estudios adicionales de escalada de la dosis con topiramato con la intención de proceder a la monoterapia cuando sea posible. De acuerdo con lo anterior, se obtuvieron las concentraciones séricas valle del topiramato por la mañana y se relacionaron con el control de las convulsiones y los efectos secundarios asociados. Los resultados indicaron una clara mejoría del control de las convulsiones con una concentración en suero de topiramato en el intervalo de 15 a 75 |imol/l, pero se observó una reducción en el control de las convulsiones a concentraciones en suero superiores a 75 |imol/l. Asimismo, se produjo un incremento significativo de los efectos secundarios con concentraciones en suero superiores a 6 pimol/l. Por tanto, se ha sugerido una posible concentración en suero diana para topiramato de aproximadamente 15 a 6 |imol/l; no obstante, la mayoría de los pacientes pueden tener concentraciones en suero en los límites bajo a medio con un régimen de dosificación adecuado
Se han descrito muchos procedimientos para determinar la concentración sistémica del topiramato en un paciente. Véase Berry DJ, et al. Ther Drug Monit; 22:46-4 (2). Procedimientos de cromatografía de gases por capilaridad han descrito la determinación de topiramato en suero usando detección de ionización por llama y detección
**(Ver fórmula)**TOPIRAMATO
específica de nitrógeno. Véase Holland et al., J Chromatogr; 433:276-281 (1988), y Riffits et al., J Pharm Biomed Anal; 19:363-371 (1999), Tang et al., Ther Drug Monitoring; 22:195-21 (2). Adicionalmente, se ha demostrado que los procedimientos para usar GLC o HPLC con EM miden las concentraciones de topiramato. Véase, Mozayani A, et al. J Anal Toxicol; 23:556-558 (1999), Chen S, et al., J Chromatogr; 761: 133-7 (21), y Christensen et al., Ther Drug Monitoring; 24:658-664 (22). No obstante, dichos procedimientos son poco prácticos para su uso comercial debido a, por ejemplo, el largo tiempo de preparación de la muestra, el largo tiempo de ensayo, los elevados costes y los procedimientos laboriosos. Por tanto, se necesita un simple y rápido procedimiento analítico para medir los niveles en plasma del topiramato para un CFT eficaz.
El topiramato se puede medir en plasma o suero usando un inmunoensayo FPIA (Seradyn, Inc.) disponible comercialmente. Véase la patente de EE.UU. Ns 5.952.187. Aunque el inmunoensayo FPI actual es sencillo y rápido, el inmunoensayo está limitado por la poca biodisponibilidad de los análogos de topiramato anteriores y la pobre funcionalidad para el usuario.
Se han desarrollado técnicas de inmunoensayo para detectar varios fármacos en muestras biológicas y son adecuadas para dichas aplicaciones analíticas comerciales. De acuerdo con lo anterior, se pueden usar inmunoensayos para determinar rápidamente la cantidad de un fármaco y/o un metabolito del fármaco en la sangre de un paciente. Ejemplos de inmunoensayos pueden incluir, entre otros, inmunoensayo de micropartículas homogéneas (por ejemplo, inmunoturbidimétrico) o sistemas de microesferas cuantitativos ("QMS®"), inmunoensayos de polarización de fluorescencia ("FPIA"), inmunoensayo de enzima donante clonada ("CEDIA"), inmunoensayo de micropartículas quimioluminiscentes ("CMIA") y similares.
De acuerdo con lo anterior, sería ventajoso disponer de inmunoensayos configurados para detectar el topiramato en la sangre, suero, plasma y/u otros fluidos o muestras biológicas de un paciente. Adicionalmente, sería ventajoso disponer de análogos de topiramato para su uso en dichos inmunoensayos y/o inmunógenos basados en análogos de topiramato para su uso en la producción de anticuerpos anti-topiramato.
El documento US5952187 divulga un análogo de topiramato derivado en el resto sulfamato o en el grupo metilo del carbono 9 o del carbono 1.
Faivre-Chauvet et al, (1993) Nucí. Med.Biol. 2, 763-771 divulga un enlazador-inmunoconjugado para reducir la actividad específica.
Breve resumen de la invención
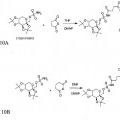
En general, la presente invención se refiere a ensayos inmunodiagnósticos para topiramato. Los análogos de topiramato pueden incluir grupos operativos, tal como restos inmunogénicos que se pueden usar para preparar anticuerpos anti-topiramato, restos antigénicos que se pueden usar en ensayos inmunodiagnósticos para topiramato o restos trazadores que se pueden usar en ensayos inmunodiagnósticos. Adicionalmente, los análogos de topiramato se pueden usar en ensayos inmunodiagnósticos para competir con topiramato por anticuerpos anti- topiramato.
De acuerdo con la presente invención se proporciona un sistema para usar en un ensayo inmunodiagnóstico para detectar la presencia de topiramato en una muestra, el sistema comprende:
un anticuerpo anti-topiramato producido contra una composición inmunogénica que incluye un inmunógeno que tienen una estructura de fórmula 1, en el que L-X-Y es NH(CH2)2NHCO(CH2)6CO-Z, en el que Z es un resto inmunogénico seleccionado de uno de BSA o KLH; y
**(Ver fórmula)** **(Ver fórmula)**Fórmula 2
en las que:
L es uno del grupo NH(CH^NH, NHCO, NHCH2Ph, SO2, COO, o O;
X es al menos uno de un enlace entre L e Y, un grupo aromático o un grupo alifático; y Y se selecciona del grupo que consiste en alifático, alcohol, amina, amida, ácido carboxílico, aldehído, éster, éster activado, éster alifático, imidoéster, isocianato, isotiocianato, anhídrido, tiol, tiolactona, diazonio, maleimido, NHS, O-NHS y un enlazador derivado de los mismos acoplado a un grupo operativo.
Adicionalmente, el anticuerpo puede ser un anticuerpo monoclonal y/o un anticuerpo policlonal. El anticuerpo puede tener al menos uno de afinidad, especificidad o avidez por un análogo de topiramato en comparación con topiramato que sea suficiente para usar en un ensayo inmunodiagnóstico homogéneo, heterogéneo o de otro tipo. Como tal, la interacción entre el anticuerpo y el... [Seguir leyendo]
Reivindicaciones:
1. Un sistema para usar en un ensayo inmunodiagnóstico para detectar la presencia de topiramato en una muestra, comprendiendo el sistema:
un anticuerpo anti-topiramato producido contra una composición inmunogénica que incluye un inmunógeno que tienen una estructura de fórmula 1, en el que L-X-Y es NH(CH2)2NHCO(CH2)6CO-Z, en donde Z es un resto inmunogénico seleccionado de uno de BSA o KLH; y
**(Ver fórmula)**O
VL-X-Y
w
o
un análogo de topiramato que tiene una estructura química de Fórmula 1:
O
Vux-Y
**(Ver fórmula)**en laque:
L es uno del grupo NH(CH2)2NH, NHCO, NHCH2Ph, S2, COO o O;
X es al menos uno de un enlace entre L e Y, un grupo aromático o un grupo alifático; y Y se selecciona del grupo que consiste en alifático, alcohol, amina, amida, ácido carboxílico, aldehido, éster, áster activado, éster alifático, imidoéster, isocianato, isotiocianato, anhídrido, tiol, tiolactona, diazonio, maleimido, NHS, O-NHS y un enlazador derivado de los mismos acoplado a un grupo operativo.
2. Un sistema como en la reivindicación 1, en el que el grupo operativo se selecciona del grupo que consiste en proteínas, lipoproteínas, glicoproteínas, polipéptidos, polisacáridos, ácidos nucleicos, polinucleótidos, ácidos teicoicos, isótopos radiactivos, enzimas, fragmentos enzimáticos, fragmentos de donantes de enzima, fragmentos aceptores de enzimas, sustratos de enzimas, inhibidores de enzimas, coenzimas, restos fluorescentes, restos fosforescentes, restos de regulación por aumento anti-stokes, restos quimioluminiscentes, restos luminiscentes, colorantes, sensibilizantes, partículas, micropartículas, partículas magnéticas, soportes sólidos, liposomas, ligandos, receptores, isótopos radiactivos de hapteno y combinaciones de los mismos.
3. Un sistema como en la reivindicación 2, en el que el anticuerpo es un anticuerpo policlonal.
4. Un sistema como en la reivindicación 2, en el que el anticuerpo es un anticuerpo monoclonal.
5. Un sistema como en la reivindicación 2, que además comprende al menos uno de los siguientes:
una composición madre de topiramato;
una serie de composiciones que contienen topiramato a concentraciones diferentes, formando la serie de composiciones un gradiente de concentraciones; el análogo de topiramato que tiene un resto trazador; el análogo de topiramato que tiene una micropartícula; el anticuerpo acoplado a una micropartícula;
el análogo de topiramato que tiene un donante de enzimas y un correspondiente aceptor de enzimas; el análogo de topiramato que tiene un aceptor de enzimas y un correspondiente donante de enzimas; o el anticuerpo cargado sobre una partícula adecuado para separar mediante filtración o sedimentación; o el anticuerpo a un título de al menos 1:5..
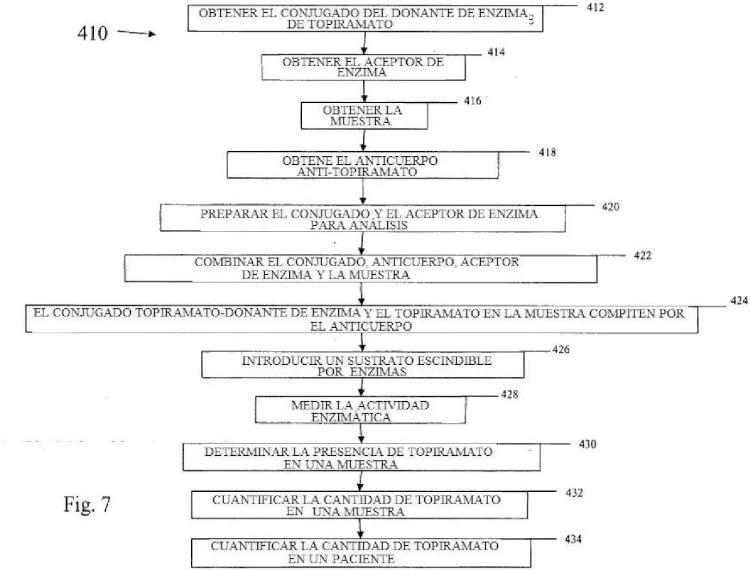
6. Un procedimiento de realizar un ensayo inmunodiagnóstico para detectar la presencia de topiramato en una muestra obtenida de un sujeto al que previamente se ha administrado topiramato, comprendiendo el procedimiento:
combinar un anticuerpo anti-topiramato y un análogo de topiramato con la muestra para formar una primera composición, en la que el anticuerpo anti-topiramato se produce contra una composición inmunogénica que incluye un inmunógeno que tiene una estructura de Fórmula I, en la que L-X-Y es NFi(CH2)2NHCO(CFÍ2)6CO- R, en donde R es uno de BSA o KLH;
O
VL'X-Y
**(Ver fórmula)**Fórmula 1
dejar que cualquier topiramato libre de la muestra y el análogo de topiramato compita por la unión con el anticuerpo.
detectar la unión entre el análogo de topiramato y el anticuerpo; y
en donde el análogo de topiramato tiene una estructura química de Fórmula 1;
**(Ver fórmula)** **(Ver fórmula)**L-X-Y
Fórmula 1
en laque:
L es uno del grupo NH(CH2)2NH, NHCO, NHCH2Ph, S2, COO o O;
X es al menos uno de un enlace entre L e Y, un grupo aromático o un grupo alifático; y Y se selecciona del grupo que consiste en alifático, alcohol, amina, amida, ácido carboxílico, aldehido, éster, éster activado, éster alifático, imidoéster, isocianato, isotiocianato, anhídrido, tiol, tiolactona, diazonio, maleimido, NHS, O-NHS y un enlazador derivado de los mismos acoplado a un grupo operativo.
7. Un procedimiento como en la reivindicación 6, en el que el grupo operativo se selecciona del grupo que consiste en proteínas, lipoproteínas, glicoproteínas, polipéptidos, polisacáridos, ácidos nucleicos, polinucleótidos, ácidos teicoicos, isótopos radiactivos, enzimas, fragmentos enzimáticos, fragmentos de donantes de enzima, fragmentos aceptores de enzimas, sustratos de enzimas, inhibidores de enzimas, coenzimas, restos fluorescentes, restos fosforescentes, restos de regulación por aumento anti-stokes, restos quimioluminiscentes, restos luminiscentes, colorantes, sensibilizantes, partículas, micropartículas, partículas magnéticas, soportes sólidos, liposomas, ligandos, receptores, isótopos radiactivos de hapteno y combinaciones de los mismos
8. Un procedimiento como en la reivindicación 6, que además comprende:
obtener el análogo de topiramato y el anticuerpo, en donde uno del análogo de topiramato y el anticuerpo está
acoplado con una micropartícula;
irradiar la primera composición con luz incidente; y
detectar una primera intensidad de la luz transmitida desde la primera composición.
9. Un procedimiento como en la reivindicación 8, que además comprende:
identificar una intensidad mínima de luz transmitida desde una composición de unión control que tiene el análogo de topiramato y anticuerpo y que no tiene topiramato libre;
comparar la intensidad mínima de la luz transmitida con la primera intensidad de la luz transmitida; y determinar si hay topiramato presente en la muestra, en donde si la intensidad mínima es diferente de la primera intensidad es una indicación de que hay topiramato presente en la muestra.
1. Un procedimiento como en la reivindicación 8, que además comprende:
combinar una cantidad conocida de topiramato con el análogo de topiramato y el anticuerpo para formar una composición de unión control;
irradiar la composición de unión control con luz incidente;
detectar una segunda intensidad de luz transmitida desde la composición de unión control; y
determinar la cantidad de topiramato presente en la muestra, en donde una comparación entre la primera
intensidad y la segunda intensidad es una indicación de la cantidad de topiramato presente en la muestra.
11. Un procedimiento como en la reivindicación 6, que además comprende:
obtener el análogo de topiramato, en el que el análogo de topiramato tiene un resto trazador;
separar el anticuerpo de la primera composición;
separar el análogo de topiramato no unido del anticuerpo; y
detectar el resto trazador unido con el anticuerpo.
12. Un procedimiento como en la reivindicación 11, que además comprende:
combinar una cantidad conocida de topiramato con el análogo de topiramato y el anticuerpo para formar una composición de unión control;
separar el anticuerpo de la primera composición de unión control;
detectar una primera cantidad de resto trazador unido al anticuerpo desde la primera composición; detectar una segunda cantidad de resto trazador unido al anticuerpo desde la composición de unión control; y determinar la cantidad de topiramato presente en la muestra, en el que una comparación entre la primera cantidad de resto trazador y la segunda cantidad del resto trazador es una indicación de la cantidad de topiramato presente en la muestra.
13. Un procedimiento como en la reivindicación 11, en el que el anticuerpo está acoplado con una partícula.
14. Un procedimiento como en la reivindicación 13, en el que la partícula es una partícula magnética.
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]