Procedimiento para la preparación de épsilon-caprolactona y 1,6-hexanodiol.
Procedimiento para la preparación de 1,6-hexanodiol y ε
-caprolactona que comprende las siguientes etapas:
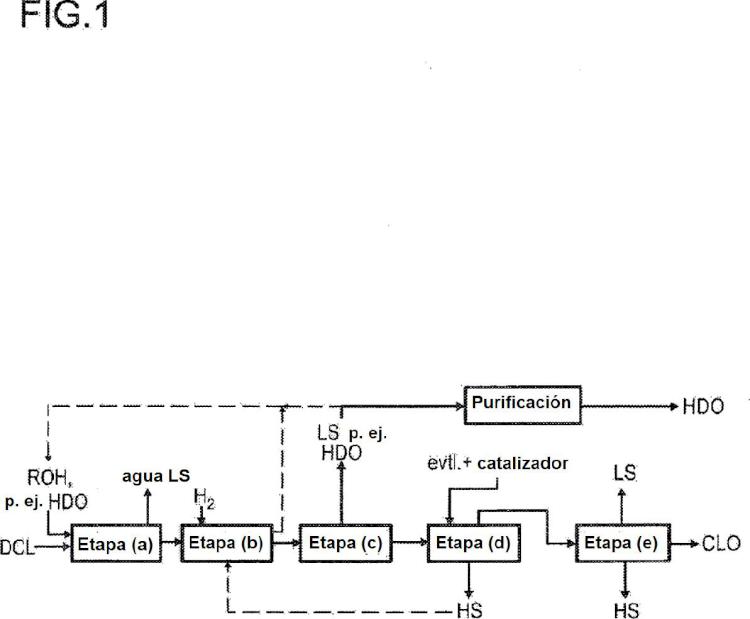
a) esterificación de DCL con un alcohol,
b) hidrogenación catalítica parcial de la mezcla de ésteres obtenida en la etapa (a),
c) destilación de la descarga de hidrogenación obtenida en la etapa (b) y, con ello, separación del producto de 5 cabeza que contiene 1,6-hexanodiol,
d) ciclación del éster del ácido 6-hidroxicaproico de la fracción de fondo de la etapa (c) en presencia de al menos un alcohol con un punto de ebullición, en el intervalo de presión usado, mayor que el de la ε-caprolactona, una mezcla de los mismos o una composición que contiene tales alcoholes, estando este alcohol de forma libre o también unido como parte del éster de la fracción de fondo y
(e) purificación de la ε-caprolactona del destilado de la etapa (d) mediante destilación,
llevándose a cabo la ciclación en la etapa (d) en la fase líquida en un aparato con columna con más de un nivel de separación teórico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/065276.
Solicitante: BASF SE.
Nacionalidad solicitante: Alemania.
Dirección: 67056 LUDWIGSHAFEN ALEMANIA.
Inventor/es: PINKOS, ROLF, BREUNINGER,DANIEL, ABILLARD,OLIVIER, KLEINMANN,EVA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C29/149 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 29/00 Preparación de compuestos que tienen grupos hidroxilo o grupos O-metal unidos a un átomo de carbono que no forma parte de un ciclo aromático de seis miembros. › con hidrógeno o gases que contienen hidrógeno.
- C07D313/04 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 313/00 Compuestos heterocíclicos que contienen ciclos de más de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › no condensados con otros ciclos.
PDF original: ES-2506465_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de e-caprolactona y 1,6-hexanodiol
La presente invención se refiere a un procedimiento para la preparación de s-caprolactona con una pureza de al menos el 99 % y para la preparación de 1,6-hexanodiol a partir de una solución de ácido dlcarboxillco (DCL), que comprende las etapas (a) esterificación de la DCL con alcohol, (b) hldrogenaclón catalítica parcial de los ásteres, (c) separación mediante destilación del 1,6-hexanodiol, (d) delación del áster de ácido 6-hldroxlcaprolco contenido en la fraedón de fondo y (e) purificación mediante destilación de la s-caprolactona del destilado de la delación, llevándose a cabo el procedimiento de tal manera que la delación tiene lugar en presencia de un alcohol de mayor punto de ebullición en relación con la s-caprolactona y llevándose a cabo la ciclación en la fase liquida en un aparato con columna con más de un nivel de separación teórico. En particular, la invención se refiere a un procedimiento en el que se emplea el alcohol de mayor punto de ebullición con respecto a la s-caprolactona ya para la esterificación de la DCL (etapa (a)), así como a un procedimiento en el que las condiciones de la hidrogenación (etapa b) y/o de la posterior destilación (etapa (c)) están seleccionadas de tal manera que el 1,6-hexanodiol producido en el procedimiento desplaza, mediante transesterificación, los alcoholes de menor punto de ebullición empleados originalmente para la esterificación. Además, la invención se refiere a formas de realización de este procedimiento en las que se continúa purificando mediante destilación el 1,6-hexanodiol de la etapa (c).
La s-caprolactona o las policaprolactonas preparadas a partir de la misma mediante poliadición sirven para la preparación de poliuretanos. El 1,6-hexanodiol representa un constituyente monomérico que se emplea, sobretodo, en el sector de los poliésteres y poliuretanos.
La asociación con instalaciones de producción para la preparación de ciclohexanol y ciclohexanona y el aprovechamiento del producto de desecho solución de ácido dicarboxílico (DCL) como producto de partida para la preparación de s-caprolactona y 1,6-hexanodiol conduce, frente al ácido 6-hidroxicaproico puro o ácido adípico puro, a costes de sustancia empleada favorables. Además representa un aprovechamiento respetuoso con el medio ambiente de un producto de desecho.
La solución acuosa de ácido dicarboxílico (DCL), que se produce durante la oxidación de ciclohexano a ciclohexanol y ciclohexanona (compárese con Ullmanns Encyclopedia of Industrial Chemistry, 5a Ed., 1987, Vol. A8, pág. 219) como productos secundarios contiene (calculado sin agua en % en peso) en general entre el 1 y el 4 % de ácido adípico, entre el 1 y el 6 % de ácido 6-hidroxicaproico, entre el 1 y el 1 % de ácido glutárico, entre el 1 y el 1 % de ácido 5-hldroxlvalérlco, entre el ,5 y el 5% de ácido 5-formilvalérico, entre el 1 y el 5% de 1,2- ciclohexanodioles, entre el 1 y el 5 % de 1,4-ciclohexanodioles, entre el 2 y el 1 % de ácido fórmico, así como múltiples otros ácidos mono- y dicarboxílicos, ásteres, compuestos oxo y oxa, cuyos contenidos individuales en general no superan el 5 %. Por ejemplo, cabe mencionar ácido acético, ácido propiónico, ácido butírico, ácido valérico, ácido caproico, ácido oxálico, ácido malónico, ácido dihidromucónico, ácido succínico, ácido 4-hidroxi- butírico, y-butirolactona y s-caprolactona como ácidos mono- y dicarboxílicos, ásteres, compuestos oxo y oxa. Es deseable usar la DCL para la obtención de 1,6-hexanodiol y s-caprolactona pura, partiendo del ácido 6- hidroxicaproico y ácido adípico contenidos en la DCL.
El estado de la técnica mencionado hasta ahora muestra que los diésteres de ácido adípico, preparados a partir de DCL y monoalcoholes se pueden hidrogenar con elevados rendimientos de aproximadamente el 96 al 99 % hasta dar 1,6-hexanodiol. A este respecto, para la hidrogenación se han usado catalizadores a base de cobre y óxido de cinc, cobre y óxido de aluminio o cobre, óxido de aluminio y óxido de cinc.
El documento WO 99/25672 A1 describe un procedimiento para la preparación de éster de ácido 6-hidroxicaproico a partir de DCL, esterificándose en primer lugar la DCL e hidrogenándose después de forma catalítica parcialmente. De la descarga de hidrogenación se retira mediante destilación 1,6-hexanodiol y a continuación se separa éster de ácido 6-hidroxicaproico.
La preparación de caprolactona a partir de DCL ya se ha descrito, por ejemplo, en el documento DE 1 618 143. A este respecto se hace reaccionar térmicamente DCL deshidratada con ácido fosfórico y se fracciona una mezcla de ácidos dicarboxílicos, caprolactona así como múltiples otros componentes. A este respecto se produce el fondo en parte de forma sólida y difícilmente soluble. Pero la caprolactona solo tiene una pureza del 98 % incluso después de otro tratamiento mediante destilación.
Además, se ha descrito en reiteradas ocasiones cómo hacer reaccionar ácido 6-hidroxicaproico o sus ásteres hasta dar caprolactona (por ejemplo, documentos DE 2 13 525, EP-A 349 861 y la bibliografía citada en los mismos).
En el ejemplo de realización del documento DE 196 7 954 (publicado también como documento WO 97/31883 A1) está descrito cómo esterificar DCL deshidratada con metanol y separar la mezcla de ásteres después de la separación de compuestos de bajo punto de ebullición en una fracción de éster de dimetilo de ácido adípico y una fracción de éster de metilo de ácido hidroxicaproico. Según esto, la fracción de éster de dimetilo de ácido adípico se hidrogenó en presencia de catalizadores que contienen cobre, óxido de cinc y óxido de aluminio hasta dar 1,6- hexanodiol y metanol, ascendiendo la conversión de ásteres a 22 °C y 22 MPa (22 bar) al 99,5 %, la selectividad
de 1,6-hexanodiol a > 99 %. La fracción de éster de metilo de ácido hidroxicaproico se cicló catalíticamente hasta dar caprolactona, ascendiendo la pureza después de la destilación final al 99,9 %. Para que durante la selección de metanol u otros alcoholes de bajo punto de ebullición para la esterlflcaclón de la DCL se pueda realizar la ciclación del éster de ácido 6-hidroxicaproico hasta dar caprolactona con un rendimiento satisfactorio, se tiene que separar antes de la delación el éster de ácido adlplco por completo de la fracción de éster de ácido 6-hidroxlcaprolco. Para asegurar esto se requiere, por un lado, una elevada complejidad de separación y, por otro lado, es necesaria una forma de proceder en la que se separa una parte del éster de ácido 6-hldroxlcaproico junto con el éster de ácido adípico y, por tanto, se pierde para la delación. El uso de alcoholes de mayor punto de ebullición para la esterlflcaclón de la DCL, en este procedimiento dificultaría la separación de la fracción de éster de ácido adlplco y de la fracción de éster de ácido 6-hidroxlcaprolco. En este procedimiento con el uso de metanol u otros alcoholes de bajo punto de ebullición para la esterificación de la DCL también es desventajoso que la esterificación se tiene que llevar a cabo, para evitar presiones muy elevadas, a temperaturas comparativamente reducidas (< 2 °C), por lo que, de forma habitual, se ha de usar un catalizador, por norma general ácido sulfúrico, para garantizar una esterificación eficaz. En estos casos, sin embargo, el ácido sulfúrico se tiene que volver a eliminar de forma compleja después de la esterificación. Además, la separación de agua de reacción en caso del uso de alcoholes de bajo punto de ebullición se consigue solo con una gran dificultad, de tal manera que esto en la práctica no se lleva a cabo. La presencia de agua en la esterlflcaclón entonces causa peores conversiones, de tal manera que todavía están contenidas cantidades de menor tamaño de ácido en la descarga de esterificación. Estas conducen en posteriores pasos del procedimiento (en particular en destilaciones) a la formación en particular de ásteres de ácido polihidroxicaproico en las fracciones de fondo. Estos se tienen que tratar de forma compleja y devolverse o se pierden para el procesamiento posterior hasta dar caprolactona o hexanodlol.
Además, el documento DE 196 7 954 describe una variante del procedimiento ("Variante E"), en particular para la preparación de pequeñas cantidades de caprolactona con una complejidad técnica mínima. Según esto, para la esterificación de la DCL se ha de usar un alcohol que tenga un mayor punto de ebullición que la caprolactona y la reacción se lleva a cabo sin aislamiento de la fracción de éster de ácido adípico de forma inicial en una reacción de un recipiente en presencia de un catalizador de... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de 1,6-hexanodiol y e-caprolactona que comprende las siguientes etapas:
a) esterificación de DCL con un alcohol,
b) hidrogenación catalítica parcial de la mezcla de ásteres obtenida en la etapa (a),
c) destilación de la descarga de hidrogenación obtenida en la etapa (b) y, con ello, separación del producto de cabeza que contiene 1,6-hexanodiol,
d) ciclación del áster del ácido 6-hidroxicaproico de la fracción de fondo de la etapa (c) en presencia de al menos un alcohol con un punto de ebullición, en el intervalo de presión usado, mayor que el de la s-caprolactona, una mezcla de los mismos o una composición que contiene tales alcoholes, estando este alcohol de forma libre o también unido como parte del áster de la fracción de fondo y
(e) purificación de la s-caprolactona del destilado de la etapa (d) mediante destilación,
llevándose a cabo la ciclación en la etapa (d) en la fase líquida en un aparato con columna con más de un nivel de separación teórico.
2. El procedimiento de acuerdo con la reivindicación 1, llevándose a cabo la ciclación del áster del ácido 6- hidroxicaproico en la etapa (d) en presencia de al menos un alcohol con un punto de ebullición, en el intervalo de presión usado, mayor que el de la s-caprolactona, estando unido este alcohol como parte de los ásteres de la fracción de fondo.
3. El procedimiento de acuerdo con las reivindicaciones 1 o 2, llevándose a cabo la esterificación en la etapa (a) con un alcohol que en el intervalo de presión de 1 a 15 kPa (de 1 a 15 mbar) tiene un mayor punto de ebullición que la s-caprolactona, una mezcla de los mismos o una composición que contiene tales alcoholes.
4. El procedimiento de acuerdo con una de las reivindicaciones 1 a 3, siendo los alcoholes usados para la esterificación en la etapa (a) alcoholes polihidroxílicos, en particular dioles.
5. El procedimiento de acuerdo con las reivindicaciones 3 o 4, usándose una parte de la descarga de hidrogenación de la etapa (b) como composición que contiene alcohol para la esterificación de la DCL en la etapa (a).
6. El procedimiento de acuerdo con una de las reivindicaciones 3 a 5, usándose una parte de la composición que contiene alcohol, que se obtiene como producto de cabeza de la destilación en la etapa (c), para la esterificación de la DCL en la etapa (a).
7. El procedimiento de acuerdo con una de las reivindicaciones 3 a 6, usándose 1,6-hexanodiol para la esterificación de la DCL en la etapa (a).
8. El procedimiento de acuerdo con las reivindicaciones 1 o 2, llevándose a cabo la esterificación en la etapa (a) con un alcohol que en el intervalo de presión de 1 a 15 kPa (de 1 a 15 mbar) tiene un menor punto de ebullición que la s-caprolactona, una mezcla de los mismos o una composición que contiene tales alcoholes y llevándose a cabo la hidrogenación en la etapa (b) y/o la destilación en la etapa (c) en condiciones que posibilitan un desplazamiento del alcohol de esterificación de menor punto de ebullición de la etapa (a) por el 1,6-hexanodiol producido durante la hidrogenación en el sentido de una transesterificación.
9. El procedimiento de acuerdo con la reivindicación 8, siendo las condiciones que posibilitan la transesterificación el uso de catalizador de hidrogenación con centros ácidos o básicos en la etapa (b), la presencia de ácidos o bases en la etapa (c) en una cantidad que causa en la alimentación al nivel de destilación un índice de acidez o basicidad de al menos ,1 y/o la presencia de catalizadores de transesterificación en las etapas (b) y/o (c) en cantidades, con respecto a la alimentación, de al menos 1 ppm.
1. El procedimiento de acuerdo con una de las reivindicaciones 1 a 9, estando ajustada la hidrogenación parcial en la etapa (b) de tal manera que se consigue una conversión de hidrogenación en el intervalo del 4 al 97 %.
11. El procedimiento de acuerdo con una de las reivindicaciones 1 a 1, obteniéndose la DCL mediante
I) oxidación de ciclohexano con oxígeno o gases que contienen oxígeno hasta dar mezclas de ciclohexanol, ciclohexanona y ácidos carboxílicos con hasta seis átomos de carbono y
II) reacción de la mezcla de reacción obtenida después de la etapa (I) con agua y separación de la DCL de la mezcla de reacción bifásica líquida.
12. El procedimiento de acuerdo con una de las reivindicaciones 1 a 11, purificándose adicionalmente mediante destilación el 1,6-hexanodiol de la fracción de cabeza de la destilación de la etapa (c).
13. El procedimiento de acuerdo con una de las reivindicaciones 1 o 3 a 12, estando compuesta la composición que contiene alcohol en una parte de al menos el 3 % en peso de los correspondientes alcoholes.
14. El procedimiento de acuerdo con una de las reivindicaciones 1 a 13, hidrogenando la hidrogenación en la etapa (b) de la mezcla de esterificación de la etapa (a) en la fase líquida en presencia de un cuerpo de conformado de catalizador, cuyo precursor se puede obtener mediante
(i) facilitación de un material oxídico que contiene óxido de cobre, óxido de aluminio y al menos uno de los óxidos
de lantano, wolframio, molibdeno, titanio, zirconio o hierro,
(ii) adición de cobre metálico en polvo, copos de cobre, cemento en polvo, grafito o una mezcla al material oxídico de la etapa (i) y
(iii) conformado de la mezcla resultante de la etapa (ii) hasta dar un cuerpo de conformado.
15. El procedimiento de acuerdo con una de las reivindicaciones 1 a 14, llevándose a cabo la esterificación en la 1 etapa (a) sin adición de catalizador.
16. El procedimiento de acuerdo con una de las reivindicaciones 1 a 15, separándose a través de la cabeza en la etapa (c) 1,2-ciclohexanodioles.
Patentes similares o relacionadas:
Procedimiento para la preparación de tetrahidrofurano, 1,4-butanodiol o gamma-butirolactona, del 8 de Noviembre de 2019, de BASF SE: Procedimiento para la preparación de tetrahidrofurano y/o 1,4-butanodiol y/o gamma-butirolactona, que comprende las etapas de a) preparación de ácido succínico […]
Producción de 1,6-hexanodiol a partir de ácido adípico, del 17 de Julio de 2019, de ARCHER-DANIELS-MIDLAND COMPANY: Procedimiento para preparar 1,6-hexanodiol, comprendiendo el procedimiento: hacer reaccionar un sustrato de ácido adípico e hidrógeno en presencia de un catalizador heterogéneo […]
Procedimiento para la producción de D-sorbitol, del 10 de Abril de 2019, de DSM IP ASSETS B.V.: Procedimiento para la producción del compuesto de fórmula (II):**Fórmula** en donde el compuesto de fórmula (I):**Fórmula** se hidrogena en presencia […]
Absorbentes de poliamina-poliol regenerativos sólidos en soporte de nanoestructura para la separación del dióxido de carbono a partir de mezclas gaseosas que incluyen el aire, del 10 de Enero de 2019, de UNIVERSITY OF SOUTHERN CALIFORNIA: Un absorbente de dióxido de carbono sólido para absorber dióxido de carbono a partir de una mezcla gaseosa y que libera el dióxido de carbono […]
Procedimiento para producir alcoholes grasos a partir de ésteres metílicos de ácidos grasos, del 11 de Diciembre de 2018, de L'AIR LIQUIDE, SOCIETE ANONYME POUR L'ETUDE ET L'EXPLOITATION DES PROCEDES GEORGES CLAUDE: Un procedimiento para obtener alcoholes grasos (FA) a partir de ésteres metílicos de ácidos grasos (FAME), caracterizado porque están comprendidas las […]
Procedimiento para la preparación de un éster alquílico de ácido carboxílico, del 7 de Noviembre de 2018, de BASF SE: Procedimiento para la preparación al menos de un éster alquílico de un ácido policarboxílico, en el que se realiza una destilación reactiva, poniendo […]
Hidrogenación de ésteres con complejos de Fe/ligandos tridentados, del 19 de Octubre de 2018, de FIRMENICH SA: Un procedimiento para la reducción por hidrogenación, utilizando H2 molecular, de un sustrato C3-C70 que contiene uno o dos grupos funcionales carbonilo o carboxílico en […]
Método para la producción de ésteres vinílicos, del 14 de Marzo de 2018, de OXEA GmbH: Método continuo, catalítico para la producción de un éster vinílico de la fórmula R-C(O)O-CH ≥ CH2 mediante la conversión de un ácido carbónico de la fórmula […]