Producción de L(-)-carnitina mediante cepas de Escherichia coli modificadas genéticamente.
Procedimiento para la producción de L-carnitina a partir de crotonobetaína,
sales o derivados de crotonobetaína y/o D-carnitina con E. coli modificada genéticamente mediante mutación insercional en ausencia de plásmidos, sin producción de γ-butirobetaína, caracterizado porque las modificaciones genéticas son al menos de una de las siguientes mutaciones:
- mutaciones para acelerar el flujo sobre el citrato,
- mutaciones para evitar la producción de γ-butirobetaína,
- mutaciones para incrementar la expresión del gen estructural (operon cai), mutaciones para incrementar la expresión del gen regulador (caiF) y evitar la represión por oxígeno.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201230867.
Solicitante: UNIVERSIDAD DE MURCIA.
Nacionalidad solicitante: España.
Inventor/es: CANOVAS DIAZ,MANUEL, IBORRA PASTOR,JOSE LUIS, ARENSE PARRA,Paula, FOULQUIE MORENO,María, CHARLIER,Daniel, BERNAL SÁNCHEZ,Vicente.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12P1/04 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 1/00 Preparación de compuestos o de composiciones, no prevista en los grupos C12P 3/00 - C12P 39/00, utilizando microorganismos o enzimas; Procedimientos generales de preparación de compuestos o composiciones que utilizan microorganismos o enzimas. › utilizando bacterias.
- C12P13/00 C12P […] › Preparación de compuestos orgánicos que contienen nitrógeno.
Fragmento de la descripción:
PRODUCCIÓN DE L (-) -CARNITINA MEDIANTE CEPAS DE ESCHERICHIA COLI MODIFICADAS
GENÉTICAMENTE
Campo de aplicación.
La presente invención se refiere a un procedimiento para la producción de L (-) -carnitina desde crotonobetaína, D (+) -carnitina y derivados, en un reactor donde las cepas modificadas genéticamente de modo insercional actúan como el biocatalizador de la reacción de hidratación.
Estado de la técnica.
La L (-) -carnitina es una sustancia ubicua que juega varios papeles en el metabolismo, especialmente en el transporte de los ácidos grasos de cadena larga a través de la membrana interna mitocondrial.
La función de L (-) -carnitina en el metabolismo de las células eucariotas ha dado lugar a una serie de aplicaciones clínicas, por ejemplo, en el tratamiento de pacientes con síndromes de deficiencia de carnitina, en la profilaxis y terapia de varias enfermedades cardiacas, y en terapias de sustitución para pacientes de hemodiálisis. Además, la L (-) -carnitina se ha utilizado como aditivo en bebidas energéticas, o se ha añadido a los medios de fermentación para incrementar la tasa de crecimiento de levaduras y bacterias. La creciente demanda del enantiómero biológicamente activo, L (-) -carnitina, para esto y otros propósitos, ha causado una amplia investigación sobre diferentes formas de sintetizar esta betaína en su forma ópticamente pura, ya que el racemato químicamente sintetizado no puede ser administrado debido a la inhibición de importantes enzimas, tales como las proteínas transportadoras de carnitina y la enzima carnitina acetiltransferasa.
Los procedimientos químicos más conocidos se basan en la resolución de la carnitina racémica o de otros precursores diasteroisómeros mediante los ácidos ópticamente activos (US 4, 254, 053) ) , donde la D (+) carnitina es un producto de desecho del proceso de resolución. Sin embargo, este problema se puede resolver mediante el uso de un amplio número de procedimientos biológicos para su producción a gran escala a partir de precursores aquirales de bajo coste (Jung et al., Synthesis of L-carnitine by microorganisms and isolated enzymes. Adv Biochem Eng Biotechnol 50:21-44.1993) .
Es especialmente interesante la hidratación esteroespecífica de la trans-crotonobetaina para dar L (-) -carnitina mediante el empleo de la cepas pertenecientes al género Escherichia (EP0320460) . La ventaja de este método radica en que el precursor aquiral puede, incluso, obtenerse por deshidratación química a partir de compuestos sin valor comercial, tales como la D (+) -carnitina.
El metabolismo de L (-) -carnitina ha sido caracterizado y ampliamente estudiado debido a su papel como osmoprotector en E. coli y su importancia en la supervivencia al estrés. Por otro lado, en eucariotas, la L (-) carnitina es esencial para el transporte de los ácidos grasos de cadena larga a través de la membrana interna mitocondrial la eliminación selectiva de residuos acilo y la modulación de la relación acilCoA/CoASH. Además, en varios trabajos se destacan los efectos beneficiosos de la L (-) -carnitina como antioxidante y neuroprotector (Mescka et al., 2011. In vivo neuroprotective effect of L-carnitine against oxidative stress in maple syrup urine disease. Metabolic Brain Disease 26 (1) :21-28.) .
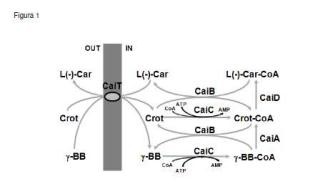
El microorganismo E. coli tiene la capacidad de transformar crotonobetaína (D, L-carnitina deshidratada) en L (-) -carnitina. En la ruta de biotransformación participan varias enzimas del metabolismo de carnitina (coenzima A transferasa, CaiB, coenzima A ligasa, CaiC, enoil deshidratasa, CaiD) , mientras que la reducción a γ-butirobetaína es catalizada por una crotonobetaína reductasa (CaiA) y CaiB, además, los ésteres de CoA están involucrados como intermedios de estas reacciones. Los estudios genéticos realizados han permitido conocer el metabolismo de E. coli O44K74 Existen dos operones divergentes, caiTABCDE y fixABCX, que se expresan de forma simultánea; el primero es responsable de las enzimas del metabolismo de carnitina y el segundo se requiere para el aporte de electrones necesarios para la reducción de carnitina como se muestra en la figura 1.
Existen diferentes sistemas para mejorar los procesos biotecnológicos con E. coli. La mayoría se basan en obtener una alta cantidad de biomasa para incrementar la producción de L (-) -carnitina. Así, las células en estado de reposo e inmovilizadas conducen a un incremento en la productividad de carnitina. De forma similar, la aplicación de fermentadores con recirculación celular y reactores de alta densidad celular mejoran dicha producción, debido a la presencia de suspensiones celulares en alta densidad y a la posibilidad de obtener un sistema viable a escala industrial. Los trabajos posteriores publicados con cepas recombinantes de E. coli como biocatalizador (Cánovas et al., 2005. Factors affecting the biotransformation of trimethylammonium compounds into L-carnitine by Escherichia coli. Biochemical Engineering Journal 26 (23) :145-154.) , aportan un beneficio en el proceso de biotransformación debido a la sobreexpresión de ciertos genes.
Los trabajos realizados sobre las rutas metabólicas y su regulación han clarificado la relación existente entre el metabolismo central y el metabolismo secundario, lo que reafirma la importancia de la ingeniería metabólica y de cofactor.
La optimización del proceso de biotransformación mediante los sistemas de células libres en crecimiento en suspensión permite mantener unas condiciones estables para las actividades enzimáticas, la energía necesaria y la regeneración de cofactor, lo que evita el descenso de la capacidad de biotransformación. Todo ello permitiría conseguir un bioproceso sin necesidad de utilizar una alta cantidad de biomasa, ya sea con células en estado de reposo o con alta densidad celular por recirculación. Además, los rendimientos de producción de L (-) -carnitina obtenidos en reactores continuos con células libres e inmovilizadas son siempre muy inferiores a los obtenidos en discontinuo y cuyos porcentajes no superaron el 40-45%. Por otra parte, los cultivos aerobios aportan mejores condiciones de crecimiento, a nivel de obtención de energía y en los procesos a mayor escala; sin embargo es conocido, que el metabolismo de carnitina se reprime por oxígeno a través de la proteína CaiF, que induce y controla la expresión del operon cai bajo la presencia de FNR .
Existe pues la necesidad de proporcionar un procedimiento que dé lugar a un mayor rendimiento en la producción de carnitina, mediante células de E. coli modificadas genéticamente en condiciones tanto anaerobias como aerobias.
Descripción de la invención.
Así pues en un primer aspecto, la presente invención se refiere a un procedimiento para la producción de Lcarnitina (en adelante, procedimiento de la presente invención) a partir de crotonobetaína, sales o derivados de crotonobetaína y/o D-carnitina con E. coli modificada genéticamente mediante mutación insercional en - butirobetaína, caracterizadoporquelasmodificacionesgenéticas
ܵ
ausenciadeplásmidos, sinproducciónde son al menos de una de las siguientes mutaciones:− mutaciones para acelerar el flujo sobre el citrato,
- butirobetaína,
ܵ
mutacionesparaevitarlaproducciónde −− mutaciones para incrementar la expresión del gen estructural (operon cai) , mutaciones para incrementar la expresión del gen regulador (caiF) y evitar la represión por oxígeno En una realización más en particular de la presente invención, las mutaciones para acelerar el flujo sobre el citrato consisten en la deleción de los genes que codifican la isocitrato liasa (aceA) , isocitrato deshidrogenasa fosfatasa/kinasa (aceK) o la deleción de ambos genes.
En una realización más en particular de la presente invención, las mutaciones para evitar la producción de ɣbutirobetaína consisten en la deleción del gen que codifica la crotonobetainil-CoA reductasa (gen caiA) .
En una realización más en particular de la presente invención, las mutaciones para incrementar la expresión de genes reguladores consisten en incrementar la expresión del operón cai, incrementar la expresión del gen regulador caiF y evitar la represión por oxígeno, consisten en la sustitución de los promotores pcai, y pcaiF por los promotores p8 y p37 respectivamente.
En una realización más en particular, el procedimiento de la presente invención se lleva a cabo con la cepa mutante E.coli BW 25113 ºaceK ºcaiA ºpcai cai-p37.
En otra realización más en particular, el procedimiento de la presente invención se realiza en un reactor continuo en medio de...
Reivindicaciones:
1. Procedimiento para la producción de L-carnitina a partir de crotonobetaína, sales o derivados de crotonobetaína y/o D-carnitina con E. coli modificada genéticamente mediante mutación insercional en ausencia de plásmidos, sin producción de ybutirobetaína, caracterizado porque las modificaciones genéticas son las siguientes mutaciones:
- mutaciones para acelerar el flujo sobre el citrato, -mutaciones para evitar la producción de y-butirobetaína, -mutaciones para incrementar la expresión del gen estructural (operon cal) ,
mutaciones para incrementar la expresión del gen regulador (caíF) y evitar la represión por oxígeno
2. Procedimiento según la reivindicación 1, donde las mutaciones para acelerar el flujo sobre el citrato_consisten en la deleción de los genes que codifican la isocitrato liasa (aceA) , isocitrato deshidrogenasa fosfatasa/kinasa (aceK) o la deleción de ambos genes.
3. Procedimiento según la reivindicación 1, donde las mutaciones para evitar la producción de y-butirobetaína consisten en la deleción del gen que codifica la crotonobetainil-CoA reductasa (gen caíA) .
4. Procedimiento según la reivindicación 1, donde las mutaciones para incrementar la expresión de genes reguladores consisten en incrementar la expresión del operón caí, incrementar la expresión del gen regulador eaíF y evitar la represión por oxígeno, consisten en la sustitución de los promotores peaí, y peaíF por los promotores p8 y p37 respectivamente.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, donde E. eoli es la cepa mutante E. eoli BW 25113 !1aeeK !1eaíA !1peaí eaí-p37.
6. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque la producción se realiza en un reactor continuo en medio de alimentación complejo o específico para el cultivo de E. eoli.
7. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque el procedimiento se realiza en condiciones aeróbicas o anaeróbicas.
8. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque la concentración de crotonobetaína, sales o derivados de crotonobetaína y/o Dcarnitina en el medio de reacción está comprendida entre 25 mM y 1 M.
9. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque E. eoli se encuentra bajo condiciones de crecimiento o en estado de reposo.
10. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque el procedimiento comprende múltiples ciclos de biotransformación.
11. Uso de E. eoli BW 25113 !1aeeK !1eaíA !1peaí eaí-p37 para la producción de Lcarnitina según el procedimiento descrito en las reivindicaciones 1-10.
Figura 1 Figura 2
Figura 3
Figura 4
A
Figura 5
Figura 6
Figura 7 A
B
LISTADO DE SECUENCIAS
lt;110gt; UNIVERSIDAD DE MURCIA
lt;120> PRODUCCIÓN DE L ( ) -CARNITINA MEDIANTE CEPAS DE ESCHERICHIA COLI MODIFICADAS GENÉTICAMENTE
lt;130gt; PT0015/2012
lt;160gt; 26
lt;170gt; PatentIn version 3.5
lt;210gt; 1
lt;211gt; 64
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Fwd-aceAK-PI
lt;400gt; 1 ccacataact atggagcatc tgcacatgaa aacccgtaca caacgtgtag gctggagctg 60
cttc 64
lt;210gt; 2
lt;211gt; 65
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Rev-aceAK-P2
lt;400gt; 2 tttgcctgcg ccgatacgca taaacatctt ccacatgccc ttcaccatat gaatatcctc 60
cttag 65
lt;210gt; 3
lt;211gt; 77
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Fwd-caiF-P1
lt;400gt; 3 ctgatgagga ccgttttttt ttgcccatta agtaaatctt ttggggaatc gatatttgtg 60
taggctggag ctgcttc 77
lt;210gt; 4
lt;211gt; 80
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Rev-caiF-p8
lt;400gt; 4
tctggctatg actcgttttg aagcaattaa acaaggccat attaaaattg tggattaacc 60
cgcgaattat atcatattgg 80
lt;210gt; 5
lt;211gt; 78
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Fwd-caiA-lox1
lt;400gt; 5 ctcccgtagg cctgataaga cgcatcagcg tcgcatcagg cagcgcacgg acataacttc 60
gtatagcata cattatac 78
lt;210gt; 6
lt;211gt; 81
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Rev-caiA-lox2
lt;400gt; 6 gcgaaacaga actggaaaga ttaattaacc cccaaaatat caagaggttg aaagataact 60
tcgtataatg tatgctatac g 81
lt;210gt; 7
lt;211gt; 77
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Fwd -caiTBC-p37
lt;400gt; 7 atttttgtta acatttaata taattattat taacctcgtg gacgcgttaa tggcaaaaat 60
gacatatacc acatgga 77
lt;210gt; 8
lt;211gt; 70
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; Mutante E. coli Rev-pcaiTBC-P2
lt;400gt; 8 attttttact cacaacagag cataacaaac tgattattaa tcaaaattaa catatgaata 60
tcctccttag 70
lt;210gt; 9
lt;211gt; 21
lt;212gt; DNA
lt;213gt; Artificial Sequence 2
lt;220gt; lt;223gt; dnaA oligo Forward
lt;400gt; 9 tggcgaaaga gctgactaac c 21
lt;210gt; 10 lt;211gt; 17 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; dnaA Oligo Reverse
lt;400gt; 10 acggcaggca tgaagca 17
lt;210gt; 11 lt;211gt; 20 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; polA Oligo Forward
lt;400gt; 11 gctgaacgtg cagccattaa 20
lt;210gt; 12 lt;211gt; 21 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; polA Oligo Reverse
lt;400gt; 12 caatcatcgc ccgtttgata a 21
lt;210gt; 13 lt;211gt; 20 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; caiT Oligo Forward
lt;400gt; 13 cacagttcac gcacagtacg 20
lt;210gt; 14 lt;211gt; 20 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; caiT Oligo Reverse
lt;400gt; 14
gcgcatgttg ttctataccg
lt;210gt; 15
lt;211gt; 20
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; caiB Oligo Forward
lt;400gt; 15 ccggaagatt ggtgtactcc 20
lt;210gt; 16
lt;211gt; 20
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; caiB Oligo Reverse lt;400gt; 16 ccgatatctt catcgaagcc 20
lt;210gt; 17
lt;211gt; 20
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; caiC Oligo Forward
lt;400gt; 17 ggcgacaagg ttgcactaca 20
lt;210gt; 18
lt;211gt; 19
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; caiC Oligo Reverse lt;400gt; 18 agcccgaacc agcaaaaga lt;210gt; 19
lt;211gt; 20
lt;212gt; DNA
lt;213gt; Artificial Sequence lt;220gt;
lt;223gt; fixA Oligo Forward
lt;400gt; 19 gcaggctttg atctgatcct
lt;210gt; 20
lt;211gt; 20
lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; fixA Oligo Reverse
lt;400gt; 20 ctcaacggtg agggtatctg 20
lt;210gt; 21 lt;211gt; 21 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; idc Oligo Forward
lt;400gt; 21 ggcacaaggc aagaagatca c 21
lt;210gt; 22 lt;211gt; 23 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; icd Oligo Reverse
lt;400gt; 22 agggataatc ggattttcag gaa 23
lt;210gt; 23 lt;211gt; 21 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; pta Oligo Forward
lt;400gt; 23 tcgcaaacta ccacgctaac a 21
lt;210gt; 24 lt;211gt; 21 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; pta Oligo Reverse
lt;400gt; 24 agactgggca aactggtgct t 21
lt;210gt; 25 lt;211gt; 15 lt;212gt; DNA lt;213gt; Artificial Sequence
lt;220gt; lt;223gt; aceA Oligo Forward
lt;400gt; 25 agcctcggcg cactg 15
5 10 lt;210gt; 26 lt;211gt; 24 lt;212gt; DNA lt;213gt; Artificial Sequence lt;220gt; lt;223gt; aceA Oligo Reverse
15 lt;400gt; 26 tagactgctt caatacccgc tttc 24
Patentes similares o relacionadas:
Procedimiento de preparación de aminas a partir de compuestos de carbonilo mediante reacción de transaminasa bajo precipitación de sal, del 10 de Junio de 2020, de Enzymicals AG: Procedimiento de preparación de un compuesto de sal amino que comprende: i) proporcionar un compuesto de carbonilo de fórmula general (I) **(Ver fórmula)** […]
Producción de anilina a través de antranilato, del 13 de Mayo de 2020, de Covestro Intellectual Property GmbH & Co. KG: Un procedimiento para la producción de anilina, que comprende las etapas de: a) proporcionar o-aminobenzoato, en el que dicho o-aminobenzoato comprende […]
Procedimiento de purificación de 1,5-diaminopentano, del 6 de Mayo de 2020, de CJ CHEILJEDANG CORP.: Un procedimiento de refinación de 1,5-diaminopentano, comprendiendo el procedimiento: concentrar un caldo de fermentación que incluye un carbonato de 1,5-diaminopentano; […]
Proceso para la preparación de una amina quiral ópticamente activa, del 27 de Noviembre de 2019, de LONZA AG: Un proceso para la preparación de una amina quiral ópticamente activa que comprende: a) proporcionar un aceptor de amino y un dador de amino, b) hacer reaccionar el […]
Producción microbiana de aminas grasas, del 20 de Noviembre de 2019, de Genomatica, Inc: Una célula bacteriana recombinante para la producción de una amina grasa, que comprende: (i) uno o más genes expresados que co 5 difican una […]
Composiciones y métodos para preparar (s)-norcoclaurina y (s)-norlaudanosolina e intermedios de síntesis de las mismas, del 23 de Octubre de 2019, de Willow Biosciences Inc: Un método de preparación de (S)-norcoclaurina o (S)-norlaudanosolina que comprende: (a) proporcionar al menos un precursor de la vía de la […]
Procedimiento para producir líquido que contiene azúcar, del 16 de Octubre de 2019, de TORAY INDUSTRIES, INC.: Procedimiento para producir un líquido que contiene azúcar utilizando una biomasa que contiene celulosa como materia prima, comprendiendo dicho procedimiento: hidrolizar […]
Microorganismos y métodos para la biosíntesis de adipato, hexametilendiamina y ácido 6-aminocaproico, del 17 de Julio de 2019, de Genomatica, Inc: Un organismo microbiano de origen no natural con una vía de hexametilendiamina que comprende al menos un ácido nucleico exógeno que codifica […]