Método para someter a prueba la enfermedad de Alzheimer midiendo la tasa de degradación de beta-amiloide en sangre y reactivo de diagnóstico.
Metodo para someter a prueba la enfermedad de Alzheimer, comprendiendo dicho metodoariadir un peptido p-amiloide 1-42 a una muestra de sangre,
on el quo P-amiloide 1-42 significa P-amiloidehumano compuesto por 42 aminoacidos y en el que el Oland° 0-amiloide 1-42 incluye un sitio quo va aescindirse por una enzima degradadora,
medir una cantidad residual del peptido p-amiloide 1-42 afiadido a la muestra de sangre mediante uninmunoensayo tipo sandwich de doble anticuerpo, en el quo se usan un anticuerpo quo reconoce un sitio Cterminaldel peptido p-amiloide 1-42 quo va a afiadirse a la muestra de sangre y un anticuerpo quoreconoce tan sitio N-terminal del mismo, para medir una actividad de degradaciOn de *tido p-amiloide 1-42 en la muestra de sangre, y
comparar la actividad de degradacion medida con la de la sangre de sujetos normales.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2007/057663.
Solicitante: EIDIA Co., Ltd.
Nacionalidad solicitante: Japón.
Dirección: 1-10-6 Iwamoto-cho, Chiyoda-ku Tokyo JAPON.
Inventor/es: TAKAYAMA,SHIGEO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/37 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › peptidasa o proteinasa.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2409058_T3.pdf
Fragmento de la descripción:
Método para someter a prueba la enfermedad de Alzheimer midiendo la tasa de degradación de beta-amiloide en sangre y reactivo de diagnóstico La presente invención se refiere a un método para someter a prueba una enfermedad en la que está ᆳ5 amiloide, tal como enfermedad de Alzheimer, midiendo la tasa de degradación de -amiloide en una muestra de sangre.
El -amiloide (denominada a continuación en el presente documento "AW) es un componente principal de la placa amiloide que es caracteristico del cerebro de un paciente con enfermedad de Alzheimer (EA) y se sabe que A se produce por una -secretasa que escinde una posición de un sitio N-terminal de una proteína precursora del
mismo (APP) y por una y-secretasa que escinde un sitio C-terminal de APP que está presente en una membrana celular.
Se sabe que las especies moleculares de Ap tienen diversos tamaños de peso molecular. Las especies más conocidas de aquéllas relacionadas con neurotoxicidad son especies de Ap compuestas por 42 aminoácidos (denominadas a continuación en el presente documento "APl-42") . El Apl-42 tiene una naturaleza que forma rápidamente fibras. Se sabe que A1-42 se deposita en los estadios tempranos de EA para formar una placa amiloide. Se considera que Apl-42 es una de las sustancias que provoca la aparición de EA.
Tal como se describió anteriormente, ha habido un aumento en la investigación sobre el proceso amiloidogénico de Ap y la relación entre Ap y la aparición de EA. Por otro lado, en los últimos años, se está aclarando gradualmente una ruta de degradación de Ap producido. En particular, el grupo de Saidou el al. ha descubierto la presencia de 20 neprilisina, que es una enzima de degradación de A localizada específicamente en células nerviosas del cerebro, y sugirieron que la EA puede estar provocada por un aumento en el nivel de Ap depositado en el cerebro debido a una disminución en la actividad de la enzima (documentos que no son de patente 1 a 3) . Mientras tanto, aunque se considera que Ap se produce en el cerebro y se transfiere a la sangre por el líquido cefalorraquídeo, se desconoce que la degradación de Ap en una parte que incluye sangre distinta de tejidos cerebrales, incluya la presencia o ausencia de una ruta de degradación y una enzima degradadora. El documento EP 0564946 da a conocer que el grado de escisión proteolítica de un sustrato de APP en presencia de la muestra de un paciente podría ser indicativo de enfermedad de Alzheimer.
Con respecto al diagnóstico de EA, se ha investigado un intento para diagnosticar pacientes con EA, en el que se usa Apl-42 como marcador de la enfermedad, porque Ap142 está estrechamente relacionado con la aparición de 30 EA. Se ha notificado que la concentración de Apl-42 en el liquido cefalorraquideo de un paciente con EA es reducida (documentos que no son de patente 4 a 7) . Sin embargo, el uso de líquido cefalorraquideo como muestra implica un alto riesgo de deterioro corporal o daño de funciones corporales para el paciente cuando está recogiéndose la muestra. Por tanto, actualmente, en la práctica, no es práctico el uso de líquido cefalorraquídeo como muestra, y no ha llegado a generalizarse su USO. Por otro Jado, se considera que las muestras de sangre (suero o plasma) son las más comunes como reactivos de diagnóstico in vitro y tienen un bajo riesgo de deterioro corporal. Sin embargo, es casi imposible detectar Ap en el suero usando los métodos de medición generales tales como el inmunoensayo tipo sándwich de doble anticuerpo que se han llevado a cabo hasta ahora; por tanto no se ha descubierto la utilidad clinica de la medición de A en el suero. Esto sugiere que es muy difícil diagnosticar pacientes con EA midiendo Apl-42 en muestras de sangre (documento que no es de patente 8) . En un estudio de diagnóstico de EA, en la actualidad, es muy problemático que no pueda realizarse el diagnóstico en una muestra de sangre usada generalmente como reactivo de diagnóstico in vitro.
Documento que no es de patente 1: Takaki Y, el al., J. Biochem (Tokio) . 2000; 128 (6) : 897-902.
Documento que no es de patente 2: Shirotani K, el al., J. Biol. Chem. 2001 276 (24) ; 21895-901.
Documento que no es de patente 3: Iwata N, el al., Science. 2001 292 (5521) ; 1550-2.
Documento que no es de patente 4: Tamaoka A, el al., J. Neurol. Sci. 1997; 148: 41-45.
Documento que no es de patente 5: Andreasen N, elal., Arch. Neurol. 1999; 56: 673-680.
Documento que no es de patente 6: Galasko D, el al., Arch. Neurol. 1998; 55: 937-945.
Documento que no es de patente 7: Molter R, el al., Ann Neurol 1995; 38: 643-648.
Documento que no es de patente 8: Tamaoka A, el al., J. Neurol. Sci. 1996; 141: 65-68.
Documento que no es de patente 9: Namba el al., Studies on New Immunoassay Method Using Electrochemiluminiscence (ECL) , JJCLA, 1996, vol. 21, n.o 5
Documento que no es de patente 10: Nature, 256, 459-497 (1975)
Problemas que han de resolverse por la invención La presente invención proporciona un método para someter a prueba la enfermedad de Alzheimer, según la reivindicación 1, que comprende medir una actividad de degradación de -amiloide 1-42 en una muestra de sangre, 5 en el que -amiJoide 1-42 significa -amiloide humano compuesto por 42 aminoácidos.
La presente invención proporciona además el uso de un reactivo de diagnóstico para someter a prueba la enfermedad de Alzheimer, según la reivindicación 3, que comprende, como componentes esenciales:
un péptido -amiloide 1-42 que va a añadirse a una muestra de sangre, siendo el péptido -amiloide 1-42, -amiloide humano compuesto por 42 aminoácidos;
un anticuerpo que reconoce un sitio C-terminal del péptido -amiloide 1-42; y
un anticuerpo que reconoce un sitio N-terminal del péptido -amiloide 1-42,
en el que se usa el reactivo de diagnóstico para medir una cantidad residual del péptido -amiloide 1-42 añadido a la muestra de sangre para medir una actividad de degradación de péptido -amiloide 1-42 en la muestra de sangre.
Se exponen realizaciones preferidas en las reivindicaciones dependientes.
El inventor de la presente invención ha investigado si podría medirse o no la presencia o ausencia de degradación y metabolismo de un péptido A en suero humano con la idea de resolver los problemas mencionados anterionmente. Con el fin de confinmar la degradación de AI-42 en sangre, se añadió un péptido sintético AI-42 a suero humano, y se midió con el tiempo la cantidad residual de A 1-42. La medición se realizó mediante un inmunoensayo tipo sándwich de doble anticuerpo basado en el método de electroquimioluminiscencia (documento que no es de patente 9) en el que se usó un anticuerpo específico para el sitio N-tenminal de AI-42 como anticuerpo primario y se usó un anticuerpo específico para el sitio C-terminal de AI-42 como anticuerpo secundario. Este método es un sistema de medición en el que es posible medir un A131-42 de longitud completa pero es imposible medir fragmentos de A131-42 producidos por degradación.
A partir de los resultados de la medición, se confirmó que el valor de medición del péptido sintético A 1-42 añadido disminuye con el paso del tiempo. Además, se confirmó que, cuando el péptido sintético A 1-42 se añadía a suero, se suprimfa significativamente la disminución en el valor de medición del péptldo sintético 1-42 con el paso del tiempo, añadiendo por adelantado un inhibidor de proteasas que puede inhibir la actividad de la enzima en el suero.
Estos hechos significan que A se fragmenta y degrada rápidamente en la sangre por una proteasa, y esa medición basada en el inmunoensayo tipo sándwich de doble anticuerpo que penmite la medición de sólo un AI-42 de 30 longitud completa es imposible porque el péptido sintético A 1-42 añadido se fragmenta y digiere enzimáticamente en la sangre.
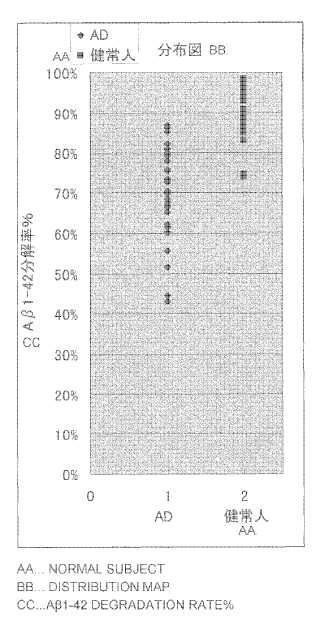
A continuación, se realizó una medición basada en el inmunoensayo tipo sándwich de doble anticuerpo para muestras obtenidas añadiendo una cantidad apropiada de un péptido sintético AI-42 a muestras de suero de pacientes con EA y sujeto normal y almacenando las mezclas a 25'C durante 20 horas. Se confrnmó que, en todas las muestras, las proteasas en las muestras degradaron al péptido sintético AI-42 porque los valores de medición disminuyen en el suero de pacientes con EA y sujetos normales en comparación con los medidos inmediatamente tras la adición del péptido sintético A 1-42. Los resultados obtenidos al comparar las tasas de disminución de los valores de medición en el suero de pacientes con EA y sujetos normales mostraron una diferencia significativa entre los mismos, y se confirmó la posibilidad de uso del... [Seguir leyendo]
Reivindicaciones:
1. Método para someter a prueba la enfermedad de Alzheimer, comprendiendo dicho método añadir un péptido -amiloide 1-42 a una muestra de sangre, en el que -amiloide 1-42 significa -amiloide humano compuesto por 42 aminoácidos y en el que el péptido -amiloide 1-42 incluye un sitio que va a escindirse por una enzima degradadora,
medir una cantidad residual del péptido -amiloide 1-42 añadido a la muestra de sangre mediante un inmunoensayo tipo sándwich de doble anticuerpo, en el que se usan un anticuerpo que reconoce un sitio C· terminal del péptido ·amiloide 1·42 que va a añadirse a la muestra de sangre y un anticuerpo que reconoce un sitio N·terminal del mismo, para medir una actividad de degradación de péptido ·amiloide 1· 42 en la muestra de sangre, y
comparar la actividad de degradación medida con la de la sangre de sujetos normales.
2. Método para someter a prueba la enfermedad de Alzheimer según la reivindicación 1, en el que la muestra de sangre es suero o plasma.
Uso de un reactivo de diagnóstico para someter a prueba la enfermedad de Alzheimer, que comprende, como componentes esenciales:
un péptido ·amiloide 1-42 que va a añadirse a una muestra de sangre; siendo el péptido ·amiloide 1·42, -amiloide humano compuesto por 42 aminoácidos e incluyendo el péptido ·amiloide 1·42 un sitio que va a escindirse por una enzima degradadora;
un anticuerpo que reconoce un sitio C·terminal del péptido ·amiloide 1·42; y
un anticuerpo que reconoce un sitio N·terminal del péptido ·amiloide 1-42,
en el que se usan el anticuerpo que reconoce un sitio C·terminal del péptido ·amiloide 1·42 y el anticuerpo que reconoce un sitio N·terminal del péptido ·amiloide 1·42 para medir una cantidad residual del péptido . amiloide 1·42 añadido a la muestra de sangre para medir una actividad de degradación de péptido . amiloide 1·42 en la muestra de sangre.
4. Uso según la reivindicación 3, en el que la muestra de sangre es suero o plasma.
FIG1
700000 -------, ...J -A81-42 o w 600000
'"
'o
c:
º 500000
<J)
'c
'E 400000.=l
º 300000 . .. .
'O
'"
'O
'
'. 'e '
'¡¡; 200000 -; . . ', .
c: " , ?-.;.': , º, -, . :': , ;.. ' .¡ :.
.
.2l
;;; 100000
"
o , ,
o 50 100 150 200 250 300 350 400 450
Concentración de péptldo (pg/ml)
FIG2
_-Muestra libre de inhibidor 12011 -_ Muestra con inhibidor añadido 100"
.', .... •.• ... . '
'"
>' 8011 . ' .' BOl! .,
c:
40" .
. , . -;.. ' 20" --..
.
o 5 10 15 20 25
Tiempo transcurrido tras el inicio de la incubación (h)
FIG.3
Mapa de distribución
100"
80"
-
10"
, ...
qo 60"
'C
e -o
'ü 501
..
'C
"'
..
al qo'C
. ', . ' -' I "'.: .. :"
! , .
qo'C
"' 3º"O) :, , :. \ , 1
(!.
20" ., . " ., "" '-i'
la"
'" . , \ "
, ',
,
o 2
EA Sujeto normal
FIG.4
100"
801
1,
CD '0
70" 601
5º"
el
40"
CD CD
3º" 20" 10"
:.
l.
1.
: _'.
, •
•.
o 1 2
EA Sujeto normal
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]