Dispersión sólida que comprende un principio activo de bajo punto de fusión y comprimido para administración oral que la comprende.
Procedimiento para la preparación de un comprimido para la administración oral,
que comprende:
(a) calentar un principio activo, que es ibuprofeno, dexibuprofeno (S(+)-ibuprofeno) o una mezcla de los mismos,hasta que se funda y añadirle un adsorbente farmacéuticamente aceptable, que es ácido silícico anhidro ligero, conun área superficial específica de 20 a 400 m2/g para obtener una dispersión sólida fusionada homogénea;
(b) enfriar, secar y pulverizar la dispersión sólida fusionada obtenida en la etapa (a) para obtener gránulos; y
(c) añadir un agente de control de la liberación o un excipiente farmacéuticamente aceptable a los gránulosobtenidos en la etapa (b) y comprimir la mezcla resultante en un comprimido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2006/005526.
Solicitante: Hanmi Science Co., Ltd. .
Nacionalidad solicitante: República de Corea.
Dirección: 550, Dongtangiheung-ro, Dongtan-myeon Hwaseong-si, Gyeonggi-do REPUBLICA DE COREA.
Inventor/es: WOO, JONG SOO, YI, HONG GI, KIM,Sang-Wook, RYU,JAE KUK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
PDF original: ES-2429097_T3.pdf
Fragmento de la descripción:
Dispersión sólida que comprende un principio activo de bajo punto de fusión y comprimido para administración oral que la comprende. 5
Campo de la invención La presente invención se refiere a un procedimiento de formación de comprimidos que comprende una dispersión sólida fusionada que comprende un principio activo de bajo punto de fusión, y a un comprimido para administración oral que la comprende.
Antecedentes de la invención Los fármacos antiinflamatorios no esteroideos, como el ibuprofeno o el dexibuprofeno (S (+) -ibuprofeno) , que presentan bajos puntos de fusión tienden a fundirse por el calor generado durante el proceso de formación de comprimidos, causando problemas de taponamiento y pegado, especialmente cuando el contenido del fármaco es elevado. Con el fin de evitar estos problemas, es necesario usar una cantidad relativamente elevada de excipientes, pero en ese caso debe aumentarse la unidad de dosificación para lograr una concentración eficaz del principio activo en plasma.
Por consiguiente, se han descrito numerosos procedimientos para comprimir eficazmente tales principios activos de bajo punto de fusión en un comprimido. Por ejemplo, los documentos WO 92/020334 y DE 3.922.441 describen una composición farmacéutica que comprende una sal de ibuprofeno o de dexibuprofeno, y el documento WO 93/004676 describe una composición farmacéutica que comprende aglomerados de ibuprofeno, usando una suspensión que comprende ibuprofeno o una sal del mismo, almidón, un agente tensioactivo, agua y un disolvente. El documento WO 01/41733 describe un procedimiento de fusión para la preparación de gránulos de AINE que presentan propiedades de compresión ventajosas.
El documento WO 95/001781 describe un procedimiento para la preparación de un comprimido bicapa formado por
una capa de liberación rápida y una capa de liberación controlada, en el que la capa de liberación rápida comprende ibuprofeno, almidón de maíz, polivinilpirrolidona reticulada, carboximetilalmidón y estearato de magnesio, mientras que la capa de liberación controlada comprende ibuprofeno, manitol, hidroxipropilmetilcelulosa, talco, estearato de magnesio y sílice coloidal.
Sin embargo, los procedimientos anteriores no resuelven de forma completamente satisfactoria los problemas de taponamiento y pegado que aparecen durante el proceso de formación de comprimidos.
Resumen de la invención Por consiguiente, es un objetivo de la presente invención proporcionar un procedimiento para la preparación de una dispersión sólida fusionada que comprenda un principio activo de bajo punto de fusión y que pueda comprimirse fácilmente en un comprimido.
Otro objetivo de la presente invención consiste en proporcionar un procedimiento para la preparación de un 45 comprimido para administración oral que la comprenda y que sea capaz de mantener una liberación uniforme de los fármacos a lo largo de un periodo de tiempo prolongado.
De acuerdo con un aspecto de la presente invención, se proporciona un procedimiento para la preparación de una dispersión sólida fusionada que comprende un principio activo de bajo punto de fusión, de 80ºC o menos, y un 50 absorbente farmacéuticamente aceptable con un área superficial específica de 20 a 400 m2/g.
De acuerdo con un aspecto de la presente invención, se proporciona un procedimiento para la preparación de un comprimido de liberación controlada para administración oral que comprende la dispersión sólida fusionada.
De acuerdo con otro aspecto de la presente invención, se proporciona un procedimiento para la preparación de un comprimido multicapa para administración oral formado por una capa de liberación rápida y una capa de liberación controlada que contienen la dispersión sólida fusionada.
De acuerdo con otro aspecto más de la presente invención, se proporciona un procedimiento para la preparación de un comprimido para la administración oral, que comprende:
(a) calentar un principio activo de bajo punto de fusión, de 80ºC o menos, hasta que se funda y añadirle un absorbente farmacéuticamente aceptable con un área superficial específica de 20 a 400 m2/g para obtener una 5 dispersión sólida fusionada homogénea;
(b) enfriar, secar y pulverizar la dispersión sólida fusionada obtenida en la etapa (a) para obtener gránulos; y
(c) añadir un agente de control de la liberación o un excipiente farmacéuticamente aceptable a los gránulos 10 obtenidos en la etapa (b) y comprimir la mezcla resultante en un comprimido.
Breve descripción de los dibujos Fig. 1: Perfiles de disolución in vitro de los comprimidos de liberación rápida preparados en los ejemplos 6 a 10 de la 15 presente invención;
Fig. 2: Perfiles de disolución in vitro del comprimido de liberación controlada preparado en el ejemplo 11 de la presente invención, así como los de los comprimidos bicapa formados por una capa de liberación rápida y una capa de liberación controlada, preparados en los ejemplos 12 y 13 de la presente invención;
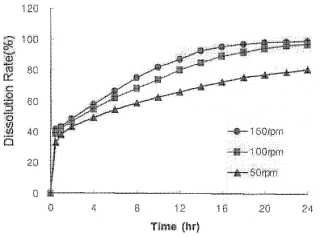
Fig. 3: Variación del perfil de disolución in vitro del comprimido preparado en el ejemplo 12 de la presente invención en función de la velocidad de rotación de las paletas;
Fig. 4: Perfiles de disolución in vitro de los comprimidos bicapa formados por una capa de liberación rápida y una 25 capa de liberación controlada, preparados en los ejemplos 14 a 16 de la presente invención; y
Fig. 5: Variación del perfil de disolución in vitro del comprimido preparado en el ejemplo 16 de la presente invención en función de la velocidad de rotación de las paletas.
Descripción detallada de la invención El comprimido para la administración oral comprende un comprimido de liberación controlada que comprende una dispersión sólida fusionada que contiene un principio activo y un agente de control de la liberación, un comprimido de liberación rápida que comprende la dispersión sólida fusionada y un excipiente farmacéuticamente aceptable y un comprimido multicapa para la administración oral que presenta una capa de liberación controlada generada usando ingredientes para el comprimido de liberación controlada y una capa de liberación rápida generada usando ingredientes para el comprimido de liberación rápida.
A continuación se describe en detalle cada ingrediente del comprimido: 40
Dispersión sólida fusionada La dispersión sólida fusionada de la presente invención comprende un principio activo con un punto de fusión de 80ºC o menos y uno o más absorbentes farmacéuticamente aceptables con un área superficial específica de 20 a 45 400 m2/g. La dispersión sólida fusionada puede comprender además un agente de compresión seleccionado del grupo formado por un alcohol de azúcar, un polímero hidrosoluble, una base oleosa y una mezcla de los mismos. La relación de peso entre principio activo : absorbente farmacéuticamente aceptable : agente de compresión asciende preferentemente a 1:0, 01-3:1-2.
(1) Principio activo En la presente invención, el principio activo usado en la dispersión sólida fusionada presenta un punto de fusión de 80ºC o menos, preferentemente de 50 a 80ºC, incluyendo los ejemplos representativos del principio activo ibuprofeno (punto de fusión: 75-77ºC) , dexibuprofeno (punto de fusión: 50-54ºC) o una mezcla de los mismos, que 55 son fármacos antiinflamatorios no esteroideos útiles para el tratamiento de la artritis reumatoide.
(2) Absorbente farmacéuticamente aceptable En la presente invención, el absorbente farmacéuticamente aceptable usado en la dispersión sólida fusionada puede ser uno de los que se usan convencionalmente en el campo farmacéutico, incluyendo los ejemplos representativos del absorbente ácido silícico anhidro ligero, hidrotalcita, silicato de magnesio y aluminio, hidróxido de aluminio, silicato de aluminio, metasilicato de magnesio y aluminio, bentonita, lactosa, dextrina, almidón, celulosa microcristalina, hidroxipropilmetilcelulosa, hidroxipropilcelulosa, hidroxietilcelulosa, etilcelulosa, metilcelulosa,
polietilenglicol, polivinilpirrolidona reticulada finamente dividida o una mezcla de los mismos.
Con el fin de evitar problemas tales como el taponamiento y el pegado que aparecen a causa de la fusión del principio activo por el calor generado durante la formación de comprimidos, se usa en particular un absorbente farmacéuticamente aceptable con un área superficial específica de 20 a 400 m2/g, preferentemente de 100 a 300
m2/g, más preferentemente de 150 a 250 m2/g. Cuando el área superficial específica del absorbente farmacéuticamente aceptable se encuentra por debajo del límite inferior, siguen apareciendo... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de un comprimido para la administración oral, que comprende:
(a) calentar un principio activo, que es ibuprofeno, dexibuprofeno (S (+) -ibuprofeno) o una mezcla de los mismos, hasta que se funda y añadirle un adsorbente farmacéuticamente aceptable, que es ácido silícico anhidro ligero, con un área superficial específica de 20 a 400 m2/g para obtener una dispersión sólida fusionada homogénea;
(b) enfriar, secar y pulverizar la dispersión sólida fusionada obtenida en la etapa (a) para obtener gránulos; y 10
(c) añadir un agente de control de la liberación o un excipiente farmacéuticamente aceptable a los gránulos obtenidos en la etapa (b) y comprimir la mezcla resultante en un comprimido.
2. Procedimiento según la reivindicación 1, que comprende además la etapa de adición de un agente de compresión seleccionado del grupo formado por un alcohol de azúcar, un polímero hidrosoluble, una base oleosa y una mezcla de ellos durante la adición del ácido silícico anhidro ligero en la etapa (a) .
3. Procedimiento según la reivindicación 1, en el que la dispersión sólida fusionada comprende el
principio activo y el adsorbente farmacéuticamente aceptable en una relación de peso de 1:0, 01 a 1:3. 20
4. Procedimiento según la reivindicación 2, en el que la dispersión sólida fusionada comprende el principio activo y el agente de compresión en una relación de peso de 1:0 a 1:2.
5. Procedimiento según la reivindicación 2, en el que el alcohol de azúcar se selecciona del grupo 25 formado por xilitol, sorbitol, manitol y una mezcla de los mismos.
6. Procedimiento según la reivindicación 2, en el que el polímero hidrosoluble se selecciona del grupo formado por hidroxipropilmetilcelulosa, hidroxipropilcelulosa, polivinilpirrolidona, polietilenglicol, poli (óxido de etileno) , poli (alcohol vinílico) y una mezcla de los mismos.
7. Procedimiento según la reivindicación 2, en el que la base oleosa se selecciona del grupo formado por ésteres de sacarosa y ácido graso, behenato de glicerilo, palmitoestearato de glicerilo, monooleato de glicerilo, monoestearato de glicerilo y una mezcla de los mismos.
8. Procedimiento según la reivindicación 1, en el que el comprimido para la administración oral es un comprimido de liberación controlada que comprende la dispersión sólida fusionada y un agente de control de la liberación para la liberación lenta del principio activo.
9. Procedimiento según la reivindicación 8, en el que el comprimido para la administración oral 40 comprende además un excipiente farmacéuticamente aceptable.
10. Procedimiento según la reivindicación 9, en el que el comprimido para la administración oral comprende la dispersión sólida fusionada, el agente de control de la liberación y el excipiente farmacéuticamente aceptable en una relación de peso de 1:0, 01-3:0-3.
11. Procedimiento según la reivindicación 1, en el que el comprimido para la administración oral es un comprimido multicapa formado por una capa de liberación rápida que comprende la dispersión sólida fusionada y el excipiente farmacéuticamente aceptable y una capa de liberación controlada que comprende la dispersión sólida fusionada y un agente de control de la liberación.
12. Procedimiento según la reivindicación 8 u 11, en el que el agente de control de la liberación se selecciona del grupo formado por poli (óxido de etileno) con un peso molecular de 10.000 a 9.000.000, hidroxipropilmetilcelulosa con un peso molecular de 1.000 a 4.000.000, hidroxipropilcelulosa, polímero de carboxivinilo, poli (alcohol vinílico) , goma xantano, goma guar, goma garrofín, carboximetilcelulosa y sus derivados,
metilcelulosa y sus derivados y copolímero de povidona-poli (acetato de vinilo) con un peso molecular de 2.000 a 2.000.000.
13. Procedimiento según la reivindicación 11, en el que la capa de liberación controlada comprende además un excipiente farmacéuticamente aceptable.
14. Procedimiento según una cualquiera de las reivindicaciones 9, 11 y 13, en el que el excipiente farmacéuticamente aceptable se selecciona del grupo formado por polivinilpirrolidona reticulada, carboximetilcelulosa sódica reticulada, carboximetilalmidón, un copolímero de metacrilato cálcico-divinilbenceno,
poli (alcohol vinílico) , lactosa, celulosa microcristalina y derivados de celulosa, almidón y sus derivados, ciclodextrina y derivados de dextrina, almidón pregelatinizado y sus derivados, sílice coloidal, estearato de magnesio, monoestearato de glicerilo, estearilfumarato sódico, talco y aceite de ricino hidrogenado.
15. Procedimiento según la reivindicación 11, en el que la capa de liberación rápida comprende la dispersión sólida fusionada y el excipiente farmacéuticamente aceptable en una relación de peso comprendida en el intervalo de 1:0, 05 a 1:3.
16. Procedimiento según la reivindicación 13, en el que la capa de liberación controlada comprende la dispersión sólida fusionada, el agente de control de la liberación y el excipiente farmacéuticamente aceptable en una 15 relación de peso de 1:0, 01-3:0-3.
Patentes similares o relacionadas:
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Cápsulas blandas entéricas de liberación controlada de ésteres de fumarato, del 1 de Julio de 2020, de Banner Life Sciences LLC: Una composición farmacéutica oral que comprende una cápsula blanda entérica que encapsula fumarato de monometilo suspendido en una matriz líquida […]
Método para tratar enfermedades recurrentes de la piel y la membrana mucosa provocadas por HSV-1 y HSV-2, del 24 de Junio de 2020, de Tets, Viktor Veniaminovich: Una preparación que incluye una base que contiene 0.5% ó 1% de sal de (2,6-diclorofenil)amida del ácido carbopentoxisulfanílico de fórmula general: **(Ver […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]
Formulaciones de rifaximina y sus usos, del 6 de Mayo de 2020, de SALIX PHARMACEUTICALS, INC.: Una forma de dispersión sólida de rifaximina que comprende rifaximina y un polímero seleccionado de: succinato de acetato de hidroxipropilmetilcelulosa (HPMC-AS) […]
Agente terapéutico para la disfunción meibomiana, del 6 de Mayo de 2020, de SANTEN PHARMACEUTICAL CO., LTD.: Una composición farmacéutica que comprende sirolimus a una concentración de 0,01 a 0,5% (p/v) como único ingrediente activo para uso en la supresión de la obstrucción de […]
Régimen de dosificación para dosis olvidadas para ésteres de paliperidona inyectables de acción prolongada, del 22 de Abril de 2020, de Janssen Pharmaceuticals, Inc: Un depósito de palmitato de paliperidona inyectable para su uso en el tratamiento de un paciente con necesidad de tratamiento psiquiátrico seleccionado […]