Uso de genes KIR para predecir respuesta a terapia.
Un procedimiento de identificación de sujetos que probablemente responden a terapia basada en anti-factor denecrosis tumoral alfa,
procedimiento que comprende las etapas de:
a. evaluar la presencia, ausencia o nivel cuantitativo de al menos un gen KIR seleccionado de 2DS2 y 2DL2para un sujeto; o evaluar la presencia, ausencia o nivel cuantitativo de un pr 5 oducto de expresión codificadopor el gen;
b. evaluar la presencia, ausencia o nivel cuantitativo de un gen que codifica un ligando KIR seleccionado delgrupo 1 de HLA-C y el grupo 2 de HLA-C; o evaluar la presencia, ausencia o nivel cuantitativo de un productode expresión codificado por el gen; y
c. estratificar el sujeto en base a la presencia, ausencia o nivel cuantitativo del al menos un gen KIR o enbase a la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; y lapresencia, ausencia o nivel cuantitativo del gen que codifica el ligando KIR o en base a la presencia, ausenciao nivel cuantitativo de un producto de expresión codificado por ese gen.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/010547.
Solicitante: UNIVERSITY OF ULSTER.
Nacionalidad solicitante: Reino Unido.
Dirección: CROMORE ROAD, COLERAINE COUNTY LONDONDERRY BT52 1SA REINO UNIDO.
Inventor/es: BERRAR,Daniel, BJOURSON,Anthony, MCGEOUGH,Cathy.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2385628_T3.pdf
Fragmento de la descripción:
Uso de genes KIR para predecir respuesta a terapia.
Antecedentes
Los receptores similares a inmunoglobulina de células asesinas (KIR) son los principales productos de la agrupación del gen complejo receptor de leucocitos, localizada en el cromosoma humano 19q13.4. Esta familia de receptores polimórficos puede ser de función tanto activante (2DS/3DS) como inhibidora (2DL/3DL) y modulan la función de células asesinas naturales (NK) y de linfocitos T mediante el reconocimiento de moléculas de clase I del antígeno leucocitario humano (HLA) de histocompatibilidad sobre células diana. La integración de señales activadoras e inhibidoras transducidas por KIR sobre subconjuntos de NK y linfocitos T desempeña una función en el mantenimiento de un equilibrio entre la vigilancia inmunitaria eficaz y la reacción autoinmunitaria. Hasta la fecha se han identificado 15 genes KIR, de los que los tipos 2DS/2DL son quizás los mejor caracterizados. KIR2DL2 y KIR2DL3 inhibidores reconocen ligandos del grupo 1 de HLA-C. Sin embargo, su receptor activador correspondiente KIR2DS2 demuestra poca o no demuestra afinidad de unión por estos ligandos. KIR2DL1 inhibidor reconoce ligandos del grupo 2 de HLA-C y, similarmente, su receptor activador correspondiente KIR2DS1 se une con mucha menos afinidad. Los individuos pueden ser homocigotos (C1/C1, C2/C2) o heterocigotos (C1/C2) para HLA-C1 o -C2. Si un individuo carece del ligando para un KIR particular, entonces ese KIR se considera normalmente no funcional.
Dentro del repertorio de receptores de NK, los KIR son una familia de receptores clave que regulan la actividad de células NK. Además de su función innata, las células NK tienen el potencial de interactuar con componentes del sistema inmunitario adaptativo, que incluyen linfocitos T y células dendríticas. Esta función dual de las células NK sugiere su probable implicación en respuestas inmunitarias autorreactivas tales como artritis reumatoide (AR) . Los KIR también están presentes en linfocitos T CD8+ y linfocitos T CD4+CD28, confirmando su implicación adicional en inmunidad adaptativa.
Sin embargo, la función precisa para KIR en linfocitos T sigue sin ser clara. Se especula que pueden soportar la capacidad para escapar del ataque de linfocitos T citotóxicos, que reaccionan con autoantígenos. De forma interesante, se encontró que la expresión de KIR2DL1/2DS1 en una población de linfocitos T CD8+ era sorprendentemente menor en pacientes con AR en comparación con controles sanos. La regulación por disminución de KIR2DL1 inhibidor en estos linfocitos T podría reducir el umbral para la iniciación de una respuesta inmunitaria.
Las enfermedades autoinmunitarias afectan a millones de personas en todo el mundo y, con más de 70 tipos distintos de patologías asociadas a procesos autoinmunitarios, representan un área amplia y de rápido movimiento de investigación e interés clínico. El factor de necrosis tumoral alfa (TNFa) , en particular, emergió de estos estudios como un mediador inflamatorio clave en el proceso inflamatorio crónico, que actúa de regulador fundamental de la expresión de otras citocinas pro-inflamatorias tales como interleucina-1 (IL-1) e interleucina-6 (IL-6) . Por tanto, TNFa se ha convertido en una diana clave para intervención terapéutica en el ámbito de las enfermedades autoinmunitarias. En los últimos años se han autorizado varios fármacos derivados biotecnológicamente que eligen TNFa como diana, cambiando en profundidad la terapia de varias enfermedades autoinmunitarias basadas en inflamación.
A este respecto, se han desarrollado dos formas distintas de agentes biológicos que eligen TNF como diana, concretamente anticuerpos monoclonales (MAb) y receptores de TNF solubles dímeros. Ambos tipos de agentes biológicos están autorizados para uso clínico para diferentes indicaciones:
Infliximab (Remicade®) es un Mab IgG1 quimérico que se une a TNFa y TNFº y lisa células productoras de TNF para neutralizar su actividad. La Agencia estadounidense del medicamento (FDA) lo ha autorizado para el tratamiento de psoriasis, enfermedad de Crohn pediátrica, espondilitis anquilosante, enfermedad de Crohn, artritis psoriásica, artritis reumatoide y colitis ulcerosa.
Etanercept (Enbrel®) es un dímero recombinante de proteínas de receptores de TNF p75 humanos fusionado y unido a IgG1 humana que actúa competitivamente para inhibir la unión de TNF a su receptor de la superficie celular, originalmente autorizado en 1998 por la FDA para tratar la dolorosa hinchazón de articulaciones y el deterioro producido por artritis reumatoide. Hasta la fecha no se ha mostrado que etanercept sea eficaz en el tratamiento de enfermedad de Crohn.
Adalimumab (Humira) ™ es un MAb anti-TNFa humanizado que se une con alta afinidad a TNFa. A partir de febrero de 2007, adalimumab ha sido autorizado para el tratamiento de artritis reumatoide, artritis psoriásica, espondilitis anquilosante y enfermedad de Crohn. Se han enviado datos a la FDA para ampliar la marca para incluir el tratamiento de psoriasis en placas. La sustitución de elementos murinos con humanos ha producido una reducción en la producción de anticuerpos que neutralizan adalimumab.
Rituximab, comercializado bajo los nombres comerciales Rituxan® y MabThera®, un anticuerpo monoclonal quimérico, es una terapia más recientemente autorizada basada en TNF-a autorizada paraartritis reumatoide.
Nuevos agentes biológicos tales como antago de TNFa han mostrado una eficacia sorprendente en el tratamiento de enfermedades tales como artritis reumatoide, pero el 20-40% de los pacientes no responden a terapia, y actualmente no hay marcadores predictivos clínicamente útiles de respuesta al tratamiento. Esto es agravado por el hecho de que los fármacos anti-TNFa son muy caros, costando más de 8000£ por paciente por año (en 2007 en el Reino Unido) , y los pacientes reciben tratamiento durante 3-6 meses antes de que pueda determinarse la respuesta clínica. La capacidad para segregar pacientes en cohortes que responderán, o no responderán, a tratamiento es un requisito urgente. Tal enfoque de medicina personalizada en la que los tratamientos son confeccionados a medida para el cumplimiento genético del individuo representa el uso más rentable de presupuestos sanitarios y evita efectos secundarios evitables para aquellos pacientes que no dan beneficio clínico. Por tanto, la capacidad para predecir la respuesta a terapia anti-TNFa encontraría utilidad universal en la gestión clínica de pacientes con enfermedades autoinmunitarias, tales como AR.
Un objeto de la presente invención es predecir prospectivamente la probable respuesta clínica de pacientes a agentes terapéuticos usados en terapia con TNF, basándose en el genotipo del paciente, en particular evaluando la presencia, ausencia o nivel cuantitativo de al menos un gen KIR, y evaluando la presencia, ausencia o nivel cuantitativo de un gen que codifica un ligando KIR.
Resumen de la invención
Según un primer aspecto de la presente invención se proporciona el uso de al menos un gen receptor similar a inmunoglobulina de células asesinas seleccionado de 2D52 y 2DL2; y un gen que codifica y ligando KIR seleccionado del grupo 1 de HLA-C y el grupo 2 de HLA-C; para la identificación de sujetos que probablemente responden a terapia basada en anti-factor de necrosis tumoral.
Según un segundo aspecto de la presente invención se proporciona un procedimiento de identificación de sujetos que probablemente responden a terapia basada en factor de necrosis tumoral, procedimiento que comprende las etapas de evaluar la presencia, ausencia o nivel cuantitativo de al menos un gen KIR seleccionado de 2D52 y 2DL2 para un sujeto; o evaluar la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; evaluar la presencia, ausencia o nivel cuantitativo de un gen que codifica y ligando KIR seleccionado del grupo 1 de HLA-C y el grupo 2 de HLA-C; o evaluar la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; y estratificar el sujeto basándose en la presencia, ausencia o nivel cuantitativo del al menos un gen KIR o basándose en la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; y la presencia, ausencia o nivel cuantitativo del gen que codifica el ligando KIR o basándose en la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen.
Para los fines de esta memoria descriptiva, el uso se determina por una combinación de factores, siendo uno... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de identificación de sujetos que probablemente responden a terapia basada en anti-factor de necrosis tumoral alfa, procedimiento que comprende las etapas de:
a. evaluar la presencia, ausencia o nivel cuantitativo de al menos un gen KIR seleccionado de 2DS2 y 2DL2 para un sujeto; o evaluar la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen;
b. evaluar la presencia, ausencia o nivel cuantitativo de un gen que codifica un ligando KIR seleccionado del grupo 1 de HLA-C y el grupo 2 de HLA-C; o evaluar la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; y
c. estratificar el sujeto en base a la presencia, ausencia o nivel cuantitativo del al menos un gen KIR oen base a la presencia, ausencia o nivel cuantitativo de un producto de expresión codificado por el gen; y la presencia, ausencia o nivel cuantitativo del gen que codifica el ligando KIR o en base a la presencia, ausencia
o nivel cuantitativo de un producto de expresión codificado por ese gen.
2. Un procedimiento según la reivindicación 1, en el que la presencia, ausencia o nivel cuantitativo del al menos un gen KIR se evalúa evaluando la presencia, ausencia o nivel cuantitativo del producto de expresión del al menos un gen KIR.
3. Un procedimiento según la reivindicación 1 ó 2, en el que la presencia, ausencia o nivel cuantitativo del gen que codifica un ligando KIR se evalúa evaluando la presencia, ausencia o nivel cuantitativo del producto de expresión del gen que codifica el ligando KIR.
4. Un procedimiento según la reivindicación 2, en el que el producto de expresión es un polipéptido codificado por el al menos un gen KIR.
5. Un procedimiento según la reivindicación 3, en el que el producto de expresión es un polipéptido codificado por el gen que codifica el ligando KIR.
6. Un procedimiento según cualquier reivindicación precedente, en el que la terapia en base a anti-factor de necrosis tumoral alfa es una intervención terapéutica que elige como diana la señalización del factor de necrosis tumoral alfa.
7. Un procedimiento según cualquier reivindicación precedente, en el que el al menos un gen KIR es 2DS2, y en el que el ligando KIR es el grupo 1 de HLA-C.
8. Un procedimiento según la reivindicación 1, en el que el procedimiento comprende además la etapa de determinar el haplotipo del sujeto.
9. Un procedimiento según la reivindicación 8, en el que la presencia de un haplotipo del grupo B es indicativo de que un sujeto responderá (es un paciente que responde al tratamiento) .
10. Un procedimiento según cualquier reivindicación precedente, en el que la presencia de al menos una copia de 2DS2 y homocigosidad del grupo 1 de HLA-C (C1/C1) es indicativo de que un sujeto responderá (es un paciente que responde al tratamiento) .
11. Un procedimiento según cualquier reivindicación precedente, en el que la presencia de al menos una copia de 2DS2 y homocigosidad del grupo 2 de HLA-C (C2/C2) es indicativo de que un sujeto responderá (es un paciente que responde al tratamiento) .
12. Un procedimiento según cualquier reivindicación precedente, en el que el procedimiento comprende además la etapa de evaluar la puntuación DAS28 del sujeto.
13. Uso de al menos un gen receptor similar a inmunoglobulina de células asesinas seleccionado de 2DS2 y 2DL2 y un gen que codifica un ligando KIR seleccionado de grupo 1 de HLA-C y el grupo 2 de HLA-C para la identificación de sujetos que probablemente responden a terapia basada en anti-factor de necrosis tumoral.
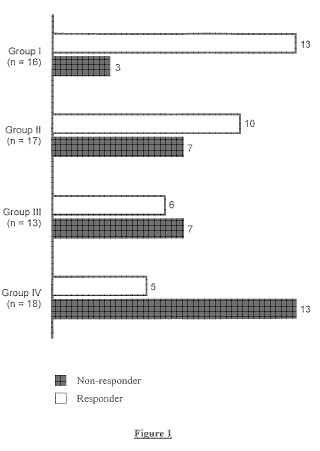
B.
Grupo I (2DS2+ HLA-C homo) Grupo IV (2DS2-HLA-C hetero) Valor de p de diferencia DAS28 en el nivel inicial DAS28 después de 3 meses Mejora de DAS Nº de pacientes que responden al tratamiento/pacientes que no responden al tratamiento 6, 05 (intervalo, 4, 28-8, 96) 4, 25 (intervalo, 2, 11-7, 27) 1, 80 (intervalo, -1, 85-3, 92) 13/3 5, 64 (intervalo, 3, 75-7, 38) 5, 16 (intervalo, 1, 95-7, 22) 0, 48 (intervalo, -2, 25-3, 32) 5/13 0, 324 0, 104 0, 022 0, 003 Valor de P de mejora 0, 001 0, 161Figura 2
Patentes similares o relacionadas:
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]