SISTEMA PARA LA PREVENCIÓN ELECTROQUÍMICA DE LA DISEMINACIÓN TUMORAL EN TRAYECTOS DE AGUJA Y MÉTODO PARA USAR EL SISTEMA.
Sistema para la prevención electroquímica de la diseminación tumoral en trayectos de aguja y método para usar el sistema.
Sistema de prevención de la diseminación de células tumorales en trayectos de aguja, que comprende:
un instrumento (1) quirúrgico percutáneo con una parte distal percutáneamente intraducible en un tejido (3) de un paciente;
un generador de corriente eléctrica (2) que genera corriente con al menos un componente de corriente continua con un primer terminal (2a) conectado al extremo proximal (1a) del instrumento (1) y un segundo terminal (2b) conectado un electrodo (4) aplicado a la piel del paciente, de manera que el instrumento (1) actúa como primer electrodo, el electrodo de contacto (4) actúa como segundo electrodo y el tejido (3) actúa como electrolito;
el generador de corriente eléctrica (2) es susceptible de inducir una circulación transitoria de la corriente con la componente de corriente continua, entre la parte del instrumento (1) introducida en el tejido y el electrodo de contacto (4), resultante en una de una densidad de corriente promedio, medida en la superficie en la parte percutáneamente introducible del instrumento (1), de al menos una densidad de corriente elegida en el rango entre 1 mA/cm2 y 1000 mA/cm2 para periodos de circulación entre 0,1 segundos y 10 minutos, de forma que el producto de la densidad de corriente promedio por el tiempo sea superior a 50 mA.s/cm2 e inferior a 10000 mA.s/cm2 para generar reacciones electroquímicas que producen un microentorno suficientemente tóxico (5) en el tejido (3) alrededor de la parte del instrumento (1) introducida en el tejido del paciente.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201031848.
Solicitante: UNIVERSITAT POMPEU FABRA.
Nacionalidad solicitante: España.
Inventor/es: IVORRA CANO,ANTONIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61B10/02 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61B DIAGNOSTICO; CIRUGIA; IDENTIFICACION (análisis de material biológico G01N, p.ej. G01N 33/48). › A61B 10/00 Otros métodos o instrumentos para el diagnóstico, p. ej. para el diagnóstico por vacunación; Determinación del sexo; Determinación del período de ovulación; Instrumentos para raspar la garganta. › Instrumentos para la toma de muestras celulares o para biopsias (dispositivos para la toma de muestras de sangre A61B 5/15).
Fragmento de la descripción:
Sistema para la prevención electroquímica de la diseminación tumoral en trayectos de aguja y método para usar el sistema.
Campo técnico de la invención
La presente invención se encuadra en el campo técnico del instrumental médico y, particularmente, se refiere a sistemas para prevenir la diseminación tumoral en los trayectos de agujas de biopsia, laparoscópicas y similares cuando éstas, después de haber sido insertadas en un tejido tumoral, se extraen a través del trayecto en los tejidos no-tumorales por los que han sido insertadas, y en las que la diseminación tumoral se previene mediante la aplicación de una corriente eléctrica a la aguja.
Antecedentes de la invención
Según la Librería Nacional de Medicina de los Institutos Nacionales de la Salud estadounidenses, la diseminación tumoral o neoplásmica se define como la implantación local de células tumorales por contaminación de instrumentos médicos y equipos quirúrgicos después de la resección quirúrgica. Este efecto provocado por la intervención médica se puede producir, por ejemplo, en intervenciones laparoscópicas o durante la adquisición de biopsias. En el caso particular de los instrumentos en forma de aguja, como los que se emplean para examinar, escindir o extirpar tumores, se emplea el término "diseminación en trayectos de aguja" ("needle-tract seeding") para la implantación de células neoplásmicas a lo largo del trayecto de inserción del instrumento en el tejido del paciente. Las tasas de riesgo concretas de este efecto están siendo objeto de debate. Así, en el caso de las biopsias de cáncer de mama, la incidencia clínica difiere mucho entre los estudios existentes, pero aún así se considera que es una cuestión de preocupación real. En el caso de las biopsias de lesiones del hígado, dos evaluaciones recientes (R. Stigliano, L. Marelli, D. Yu, N. Davies, D. Patch and A. K. Burroughs, "Seeding following percutaneous diagnostic and therapeutic approaches for hepatocellular carcinoma. What is the risk and the outcome? Seeding risk for percutaneous approach of HCC", Cancer Treat. Rev., vol. 33, pp. 437-447, Aug, 2007; M. A. Silva, B. Hegab, C. Hyde, B. Guo, J. A. Buckels and D. F. Mirza, "Needle track seeding following biopsy of liver lesions in the diagnosis of hepatocellular cancer: a systematic review and meta-analysis", Gut, vol. 57, pp. 1592-1596, Nov, 2008.) parecen indicar que el riesgo de la diseminación es superior al 2%. Si bien este valor parece ser, a primera vista, relativamente bajo, lo cierto es que se ha reconocido que debido a este fenómeno se ha perdido la posibilidad de curar algunos pacientes y, como consecuencia, se ha propuesto restringir las indicaciones para la biopsia percutánea en el hígado.
Se considera que la diseminación de las células tumorales en el trayecto de la aguja se puede producir por convección celular debido a la entrada de sangre en el trayecto, por migración celular a través de tejidos rotos, y por desplazamiento celular provocado por el vástago o la punta del instrumento durante la extracción del mismo, siendo este último el mecanismo de diseminación de células tumorales al que algunos investigadores atribuyen una relevancia particular.
A fin de prevenir la diseminación tumoral en el trayecto de la aguja cuando se toman biopsias, se han diseñado diversos sistemas. Así, se conocen dispositivos para la adquisición de biopsias que comprenden una funda de material flexible que evita que las células tumorales sean arrastradas fuera del trayecto de inserción. Las desventajas de este tipo de dispositivos son la necesidad de modificar los dispositivos de biopsia actualmente existentes, lo cual resulta en dispositivos de mayor grosor, y el hecho de que en realidad estos dispositivos no minimizan la posibilidad de la diseminación de células tumorales causada por migración o desplazamiento celular.
También se conocen métodos para provocar la cauterización o ablación térmica de los tejidos que rodean el trayecto de la aguja mediante el calentamiento de la misma, como se describe, por ejemplo, en los documentos WO9614018A1 y US2003109802A1. o mediante calentamiento los tejidos alrededor del trayecto de la aguja en base al efecto Joule con corrientes de radiofrecuencia, como describen P. F. Laeseke, T. C. Winter 3rd, C. L. Davis, K. R. Stevens, C. D. Johnson, F. J. Fronczak, J. G. Webster and F. T. Lee Jr, en "Postbiopsy bleeding in a porcine model: reduction with radio-frequency ablation-preliminary results", Radiology, vol. 227, pp. 493-499, May, 2003, y S. A. Dromi, J. Locklin and B. J. Wood, en "Radiofrequency cauterization: an alternative to reduce post-biopsy hemorrhage", Cardiovasc. Intervent. Radiol., vol. 28, pp. 681-682, Sep-Oct, 2005. Este tipo de dispositivos requiere un control exhaustivo de la temperatura de la aguja y de su entorno, lo cual requiere al menos un sensor de temperatura en la parte distal de la sonda y, por tanto, la modificación del diseño, ya que, una falta de control de la temperatura puede resultar en temperaturas excesivamente elevadas que pueden incomodar al paciente, provocar que la aguja quede adherida al tejido cauterizado o, por otra parte, un tratamiento insuficiente del tejido que rodea el trayecto de la aguja, además de que existe el riesgo de que el calentamiento dañe las muestras tomadas.
El documento WO2009156506A1 describe una aguja para biopsias que presenta dos conductores eléctricos conectados a un generador de alta frecuencia y dispuestos de tal forma que entre sus terminaciones fluye una corriente eléctrica alterna de alta frecuencia que se produce completamente en el tejido del paciente, de manera que se produce una cauterización por calor en el mismo tejido sin calentamiento directo de la aguja, consiguiéndose así evitar la diseminación de células tumorales activas y hemorragias en el trayecto de la aguja. Básicamente, esta aguja de biopsias adolece de los mismos inconvenientes en cuanto a la necesidad del control de temperatura que los anteriormente mencionados con referencia a las agujas para biopsias en los que se calienta la aguja para conseguir la cauterización.
Se conoce también un tratamiento de tumores sólidos basado en reacciones electroquímicas que son reacciones químicas que se producen en la interfase entre un electrodo de metal y el medio biológico y que conllevan la transferencia de electrones entre el electrodo y el medio biológico cuando una corriente continua fluye a través de la interfase. Estas reacciones comprenden oxidaciones y reducciones que implican especies químicas del electrodo y del medio biológico. Algunas de las especies resultantes pueden, cuando se liberan en el medio biológico, dañar componentes del tejido o interferir con procesos biológicos hasta el punto de comprometer la viabilidad celular. Para la destrucción de tumores sólidos, estas reacciones químicas se inducen mediante agujas metálicas introducidas en el tumor y a las que se aplican corrientes bajas, denominándose este tratamiento "tratamiento electroquímico". Típicamente se aplican densidades de corriente del orden de los 100 mA/cm2 durante decenas de minutos o incluso horas, para crear áreas de ablación con diámetros del orden de unos milímetros o unos pocos centímetros. Estas técnicas también se conocen como "tratamiento con corriente continua", "ablación electrolítica" o "electrólisis", si bien este último nombre se emplea en el campo de la depilación en la que se provocan estas reacciones cerca de los folículos del pelo para conseguir una depilación permanente.
Descripción de la invención
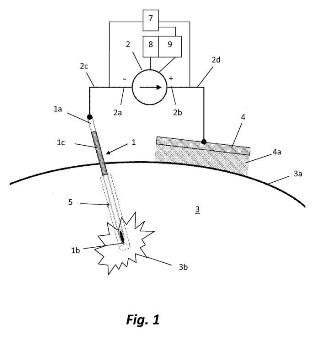
La presente invención tiene por objeto superar los inconvenientes del estado de la técnica más arriba detallados, mediante un sistema de prevención de la diseminación de células tumorales en trayectos de aguja, que comprende un instrumento quirúrgico percutáneo con un extremo proximal, un extremo distal, una parte distal percutáneamente introducible en un tejido (3) de un paciente y potencialmente causante del fenómeno de diseminación, y una superficie externa de material eléctricamente conductor entre el extremo proximal (1a) y el extremo distal (1b); así como un generador de corriente eléctrica conectado a la aguja a través de un primer cable y, mediante un segundo cable, a un electrodo de contacto aplicable a la piel de un paciente; y se caracteriza porque
el generador de corriente eléctrica es un generador de corriente con al menos una componente de comente continua con un primer terminal conectado al extremo proximal del instrumento mediante dicho primer cable y un segundo terminal conectado al electrodo a través...
Reivindicaciones:
1. Sistema de prevención de la diseminación de células tumorales en trayectos de aguja, que comprende un instrumento (1) quirúrgico percutáneo con un extremo proximal (1a), un extremo distal (1b), una parte distal percutáneamente introducible en un tejido (3) de un paciente y una superficie externa de material eléctricamente conductor entre el extremo proximal (1a) y el extremo distal (1b); y un generador de corriente eléctrica (2) conectado al instrumento (1) a través de un primer cable (2c) y, mediante un segundo cable (2d), a un electrodo de contacto aplicable (4) a la piel de un paciente; caracterizado porque
el generador de comente eléctrica (2) es un generador de corriente con al menos una componente de corriente continua con un primer terminal (2a) conectado al extremo proximal (1a) del instrumento (1) mediante dicho primer cable (1c) y un segundo terminal (2b) conectado al electrodo (4) a través de dicho segundo cable (2d), de manera que el instrumento (1) actúa como primer electrodo, el electrodo de contacto (4) actúa como segundo electrodo y el tejido (3) actúa como electrolito;
el generador de corriente eléctrica (2) es susceptible de inducir una circulación transitoria de la corriente con la componente de corriente continua, entre la parte del instrumento (1) introducida en el tejido y el electrodo de contacto (4), resultante en una de una densidad de corriente promedio, medida en la superficie en la parte percutáneamente introducible del instrumento (1), de al menos una densidad de corriente elegida en el rango entre 1 mA/cm2 y 1000 mA/cm2 para periodos de circulación entre 0,1 segundos y 10 minutos, de forma que el producto de la densidad de corriente promedio por el tiempo sea superior a 50 mA.s/cm2 e inferior a 10000 mA.s/cm2, para generar reacciones electroquímicas que producen un microentorno suficientemente tóxico (5) en el tejido (3) alrededor de la parte del instrumento (1) introducida en el tejido del paciente.
2. Sistema, según la reivindicación 1, caracterizado porque producto de la densidad de corriente promedio por el tiempo es superior a 100 mA.s/cm2 e inferior a 4000 mA.s/cm2.
3. Sistema, según la reivindicación 1 ó 2, caracterizado porque el generador de corriente eléctrica (2) es susceptible de generar en la parte del instrumento (1) introducida en el tejido (3), al menos una densidad de corriente elegida entre 1 mA/cm2, para un intervalo de tiempo comprendido entre 50 segundos y 10 minutos, y 200 mA/cm2, para un intervalo de tiempo comprendido entre 0.25 segundos y 30 segundos, y preferentemente entre 5 mA/cm2, para un intervalo de tiempo comprendido entre 30 segundos y 5 minutos, y 100 mA/cm2, para un intervalo de tiempo comprendido entre 1 segundo y 30 segundos.
4. Sistema, según la reivindicación 1, 2 ó 3, caracterizado porque el primer terminal (2a) es negativo, de manera que el instrumento (1) actúa como cátodo y el segundo terminal es positivo, de manera que el electrodo de contacto (4) actúa como ánodo, para producir un pH de al menos 8,5 y preferentemente entre 10 y 13,8 en dicho microentorno tóxico (5).
5. Sistema, según la reivindicación 1, 2 ó 3, caracterizado porque el primer terminal (2a) es positivo, de manera que la aguja (1) actúa como ánodo y el segundo terminal es negativo, de manera que el electrodo de contacto (4) actúa como cátodo.
6. Sistema, según una de las reivindicaciones 1 a 5, caracterizado porque el instrumento (1) está provisto, en la cercanía de su extremo proximal (1a), de una funda (1c) eléctricamente aislante que puede desplazarse por el vástago de la parte percutáneamente intraducibie del instrumento (1) para evitar la formación del microentorno tóxico (5) en la piel y en las regiones del tejido (3) subyacentes.
7. Sistema, según una de las reivindicaciones precedentes, caracterizado porque comprende medios de detección (7) para detectar el inicio de la extracción del instrumento (1) del tejido (3).
8. Sistema, según la reivindicación 7, caracterizado porque los medios de detección de corriente (7) comprenden un medidor de impedancia, para detectar incrementos en la impedancia entre el instrumento (1) y el electrodo de contacto (4).
9. Sistema, según la reivindicación 7, caracterizado porque los medios de detección de corriente (7) comprende un sensor de aceleración conectado al extremo proximal (1a) del instrumento (1).
10. Sistema, según una de las reivindicaciones precedentes, caracterizado porque comprende medios de control de suministro de corriente (8) conectados al generador de corriente eléctrica (2), para aumentar progresivamente la corriente eléctrica suministrada por el generador de corriente eléctrica (2) desde cero hasta generar la densidad de corriente elegida en la parte del instrumento (1) introducida en el tejido (3) hasta la densidad de corriente elegida, y reducir progresivamente la corriente eléctrica correspondiente a la densidad de corriente elegida (1) desde el nivel elegido hasta cero antes de la extracción del instrumento (1).
11. Sistema, según una de las reivindicaciones precedentes, caracterizado porque está diseñado para aplicar, conjuntamente con la corriente continua, una componente de corriente alterna para calentar ligeramente el tejido.
12. Sistema, según una de las reivindicaciones precedentes, caracterizado porque la parte percutáneamente introducible del instrumento (1) es una aguja.
13. Sistema, una de las reivindicaciones 1 a 11. caracterizado porque la parte percutáneamente introducible del instrumento (1) es una parte de un instrumento laparoscópico.
14. Sistema, según una de las reivindicaciones 1 a 11, caracterizado porque el instrumento (1) es una aguja de biopsia.
15. Sistema, según una de las reivindicaciones 12-14, caracterizado porque la parte percutáneamente introducible del instrumento (1) es de acero inoxidable.
16. Método para usar el sistema definido según la reivindicación 1 para prevenir la diseminación de células tumorales en trayectos de aguja, caracterizado porque comprende generar, mediante el generador de corriente (2) conectado al extremo proximal (1a) del instrumento (1) y al electrodo de contacto (4), una corriente continua para inducir en la parte del instrumento (1) introducida en el tejido (3), una densidad de corriente elegida entre 1 mA/cm2 y 1000 mA/cm2 para periodos de circulación entre 0,1 segundos y 10 minutos, de forma que el producto de la densidad de corriente promedio por el tiempo sea superior a 50 mA.s/cm2 e inferior a 10000 mA.s/cm2, para generar reacciones electroquímicas que producen un microentorno suficientemente tóxico (5) en el tejido (3) alrededor de la parte del instrumento (1) introducida en el tejido (3).
17. Método, según la reivindicación 16, caracterizado porque producto de la densidad de corriente promedio por el tiempo es superior a 100 mA.s/cm2 e inferior a 4000 mA.s/cm2.
18. Método, según la reivindicación 16 ó 17, caracterizado porque se genera al menos en la parte del instrumento (1) introducida en el tejido (3), al menos una densidad de corriente elegida entre 1 mA/cm2. para un intervalo de tiempo comprendido entre 50 segundos y 10 minutos, y 200 mA/cm2, para un intervalo de tiempo comprendido entre 0,25 segundos y 30 segundos, y preferentemente entre 5 mA/cm2, para un intervalo de tiempo comprendido entre 30 segundos y 5 minutos, y 100 mA/cm2, para un intervalo de tiempo comprendido entre 1 segundo y 30 segun- dos.
19. Método, según la reivindicación 16, 17 ó 18, caracterizado porque se elige una densidad de corriente y un tiempo de aplicación de corriente que produce un microentorno tóxico (5) de un diámetro de al menos 0.05 mm, preferentemente entre 0.1 mm y 2 mm alrededor de la parte del instrumento (1) introducida en el tejido (3).
20. Método, según una de las reivindicaciones 16 a 19, caracterizado porque el primer terminal (2a) del generador de corriente eléctrica (2) es negativo, de manera que el instrumento (1) actúa como cátodo y el segundo terminal es positivo, de manera que el electrodo de contacto (4) actúa como ánodo, para producir un pH suprafisiológico, preferentemente un pH de al menos 8,5, preferentemente entre 10 y 13.8 en dicho microentorno tóxico (5).
21. Método, según una de las reivindicaciones 16 a 18, caracterizado porque el primer terminal (2a) es positivo, de manera que el instrumento (1) actúa como ánodo y el segundo terminal es negativo, de manera que el electrodo de contacto (4) actúa como cátodo.
22. Método, según una de las reivindicaciones 16 a 21, caracterizado porque, cuando el instrumento (1) está introducida en el tejido (3), la corriente eléctrica se aumenta progresivamente la corriente eléctrica suministrada por el generador de corriente eléctrica (2) desde cero hasta generar la densidad de corriente en instrumento (1) hasta la densidad de corriente elegida, y, antes de extraer el instrumento (1) del tejido (3) se reduce la comente eléctrica correspondiente a la densidad de corriente elegida progresivamente hasta cero.
23. Método, según una de las reivindicaciones 16 a 22, caracterizado porque la densidad de corriente elegida se aplica durante un tiempo máximo de 60 segundos.
24. Método, según una de las reivindicaciones 16 a 23, caracterizado porque la densidad de corriente elegida y su tiempo de aplicación se seleccionan de manera que no producen un calentamiento superior a 55ºC durante más de 10 segundos en la parte del instrumento (1) introducida en el tejido (3).
25. Método, según una de las reivindicaciones 16 a 24, caracterizado porque se aplica, conjuntamente con la corriente continua, una componente de corriente alterna para calentar ligeramente el tejido.
26. Método, según una de las reivindicaciones 16 a 25, caracterizado porque como parte percutáneamente introducible del instrumento (1) se emplea una aguja.
27. Método, una de las reivindicaciones 16 a 25, caracterizado porque como parte percutáneamente introducible del instrumento (1) se emplea una parte de un instrumento laparoscópico.
28. Método, según una de las reivindicaciones 16 a 25, caracterizado porque el instrumento quirúrgico (1) es una aguja de biopsia.
29. Sistema, según una de las reivindicaciones precedentes, caracterizado porque se emplea una aguja de acero inoxidable como instrumento quirúrgico (1).
Patentes similares o relacionadas:
Aguja para biopsia de próstata, del 15 de Julio de 2020, de DEBN Sp. z o.o: Aguja para biopsia de próstata que comprende una cánula , un estilete afilado , que está montado de manera deslizante en la cánula, unos mangos (3a, […]
Instrumento quirúrgico de mano, y una herramienta y un dispositivo de protección, del 15 de Julio de 2020, de Zastrow, Frank: Dispositivo quirúrgico dental de mano con una herramienta móvil , en donde se forma una zona de trabajo en un extremo distal de la herramienta y en donde […]
Estructura de aguja para realizar biopsias por punción, del 8 de Julio de 2020, de Creo Medical Limited: Aparato quirúrgico para introducir material a través de una aguja en un tejido biológico, comprendiendo el aparato: una fuente de alimentación para suministrar […]
Disposición de aguja, del 24 de Junio de 2020, de SAGA SURGICAL AB: Una disposición de aguja para una aplicación médica, comprendiendo la disposición de aguja: una funda de aguja alargada que tiene una superficie de […]
Torunda, del 17 de Junio de 2020, de NIPRO CORPORATION: Una torunda que comprende: una porción de mango flexible y una porción de punta esférica provista en una porción de punta de dicha porción de mango y hecha […]
Aparato para biopsia y aspiración de médula ósea, del 10 de Junio de 2020, de Teleflex Medical Devices S.à.r.l: Un conjunto acoplador que puede hacerse funcionar para enganchar de manera liberable un extremo de un árbol de accionamiento que se extiende […]
Aparato para realizar biopsias de próstata transperineales guiadas y con manos libres, del 3 de Junio de 2020, de Corbin Clinical Resources, LLC: Un aparato , que comprende: un soporte superior que comprende un eje longitudinal; una primera barra de estabilización […]
Dispositivo de mano para extraer muestras de tejido, del 27 de Mayo de 2020, de TeesuVac ApS: Un dispositivo de mano para la extracción de muestras de tejido , comprendiendo una disposición de agujas y una disposición de control , comprendiendo […]