Sensores de nanopartículas magnéticas espintrónicas con un área activa localizada en una pared de dominio magnético.
Un sensor de detección de presencia de nanopartícula magnética,
comprendiendo dicho sensor:
un soporte (1) sobre el cual se dispone el sensor;
una pluralidad de contactos no magnéticos (Iin, GND, V1, V2) dispuestos sobre el soporte y conectados eléctricamente y conductivamente al sensor;
el medio de medición de la magnetorresistencia sobre el sensor conectado a dicha pluralidad de contactos no magnéticos,
que se caracteriza en que:
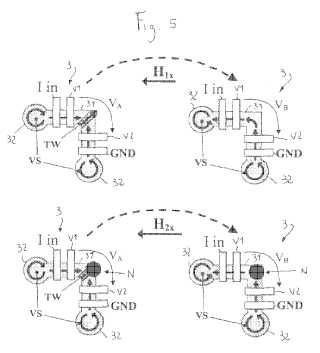
- el sensor incluye una estructura ferromagnética plana (3), que comprende un área de detección (31), conformada como una tira doblada para formar una esquina,
- el sensor está estructurado para aplicar un campo magnético para provocar que el área de detección asuma selectivamente, como una respuesta al campo magnético aplicado:
una primera configuración de espín que comprende una pared de dominio (TW) “cabeza-a-cabeza”, y
una segunda configuración de espín, en la que dicha pared de dominio (TW) está ausente, en donde dicha transición entre la primera configuración y la segunda configuración es proporcionada por el campo magnético aplicado, que tiene una componente que es paralela a uno de los lados del ángulo del área de detección con una intensidad superior al umbral de transición predecible (H1x); estando dicho umbral de transición, detectable mediante magnetorresistencia, afectado por la proximidad de una nanopartícula magnética (N) al área de detección.
- dicho medio de medición está estructurado para proporcionar una medida de dicho umbral de transición a través de medidas de la magnetorresistencia del área de detección en dichas primera y segunda configuraciones de espín asumidas tras la aplicación de dicho campo magnético.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/054808.
Solicitante: POLITECNICO DI MILANO.
Nacionalidad solicitante: Italia.
Dirección: Piazza Leonardo da Vinci 32 20133 Milano ITALIA.
Inventor/es: BERTACCO,RICCARDO, VAVASSORI,PAOLO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01R33/12 G01 […] › G01R MEDIDA DE VARIABLES ELECTRICAS; MEDIDA DE VARIABLES MAGNETICAS (indicación de la sintonización de circuitos resonantes H03J 3/12). › G01R 33/00 Dispositivos o aparatos para la medida de valores magnéticos. › Medida de propiedades magnéticas de artículos o muestras de sólidos o de fluidos (en los que interviene la resonancia magnética G01R 33/20).
PDF original: ES-2390403_T3.pdf
Fragmento de la descripción:
Sensores de nanopartículas magnéticas espintrónicas con un área activa localizada en una pared de dominio magnético
ANTECEDENTES
Campo técnico
La presente invención se refiere generalmente a sensores de nanopartículas magnéticas y a procedimientos de reconocimiento molecular, adecuados para aplicaciones en varios campos distintos.
Como tal, el reconocimiento biomolecular es la interacción entre biomoléculas, que tienen una afinidad mutua o que presentan algún tipo de complementariedad. Ejemplos de dichas interacciones son la hibridación ADN-ADN, el reconocimiento anticuerpo-antígeno y el enlace ligando-receptor [H.A. Ferreira y col., IEEE Transactions on Magnetics 41, 4140 (2005) ].
Descripción de la técnica relacionada
El reconocimiento biomolecular está en realidad omnipresente en la vida, ya que constituye la base del funcionamiento de los mecanismos celulares. Ejemplos evidentes son la replicación del código genético, la generación de enzimas, la fabricación y modificación de glícidos de proteína y ácidos nucleicos, el transporte intracelular y extracelular, el metabolismo celular, por mencionar algunos de los procesos biológicos más comunes. Por otro lado, más usos familiares del reconocimiento biomolecular comprenden pruebas de embarazo, verificación del grupo sanguíneo, escrutinio genético y tratamientos de cáncer dirigidos a sitio, actualmente en desarrollo. Está claro que la detección del reconocimiento biomolecular es más y más importante en campos tales como el cuidado sanitario, la industria farmacéutica, el análisis medioambiental y, en general, en aplicaciones biotecnológicas.
En general, la detección da como resultado la utilización de una biomolécula conocida que se usa de sonda para una muestra de ensayo, en busca de un analito diana específico. Una estrategia habitual para detectar moléculas biológicas es unir un marcador a la molécula diana, lo que produce una señal observable externamente. Tradicionalmente, esto se implementa mediante el uso de un reconocimiento molecular entre la molécula diana y un receptor específico (por ejemplo un anticuerpo) etiquetado con el marcador. El marcador puede ser un radioisótopo, una enzima o una molécula fluorescente, como en el caso de las técnicas de LIF (Fluorescencia Inducida por Luz, en sus siglas en inglés) . Recientemente también se han usado, como marcadores para biodetección, micropartículas y nanopartículas magnéticas, debido a sus ventajas con respecto a los demás marcadores. Las propiedades magnéticas de las nanopartículas son estables con el tiempo, ya que el magnetismo no se ve afectado ni por la química de los reactivos, ni se ven sometidos a fotoblanqueo (un problema relacionado con el uso de marcadores fluorescentes) . Además, en aplicaciones biológicas, generalmente no existe una señal de ruido de fondo significativa, y los campos magnéticos no se ven apantallados por los reactivos o por biomateriales en disolución acuosa. Además, se puede usar el magnetismo para manejar de forma remota las partículas magnéticas. Cabe destacar que el tamaño de las partículas magnéticas debería ser tan reducido como sea posible para introducir la mínima perturbación posible con respecto a la afinidad entre las moléculas sonda y las moléculas diana. En cualquier caso, es necesario encontrar un compromiso entre este último aspecto y la necesidad de un momento magnético, dimensionado de tal modo que se pueda detectar con un sensor específico con una relación señal-ruido apropiada. Hasta ahora, varios grupos de investigación han usado partículas con un diámetro de entre unas pocas micras y 16 nm.
En los últimos años, se han desarrollado multitud de dispositivos de detección de campos magnéticos muy sensibles, tal como los sensores de magnetorresistencia gigante (GMR) [M.N. Baibich y col., Phys. Rev. Lett. 61 (21) , 2472-2475 (1988) ] y los sensores magnéticos de válvula de espín [B. Dieny y col., J. Appl. Phys. 69 (8) , 4774 (1991) ; P.P. Freiras y col., Sens Actuat A Phys, 81 (1-3) , 2 (2000) ] que permiten la medición de campos magnéticos extremadamente débiles, tales como los generados por una única micropartícula magnética. Además de los sensores GMR, se ha demostrado la detección de partículas magnéticas individuales con sensores Hall de silicio miniaturizados [P.A. Besse y col., Appl. Phys. Lett. 80 (22) , 4199 (2002) ] y sensores de efecto Hall plano, basados en películas delgadas de Permalloy (aleación FeNi) [L. Ejsing y col., Appl. Phys. Lett. 84 823) , 4729 (2004) ]. Más recientemente, se han aplicado sensores de magnetorresistencia de túnel (TMR) al reconocimiento molecular, basados en uniones de túnel magnético (MTJ) [W. Shen y col., Appl. Phys. Lett. 2008, 103, 07A306], debido a su superior sensibilidad y estabilidad con respecto a la temperatura. El uso de magnetorresistencia anisotrópica en sensores de anillo, como detectores de partículas sensibles, ha sido sugerido por Miller y col. [M.M. Miller y col., Appl. Phys. Lett. 81, 2211 (2002) ] y, más recientemente, dicha estrategia ha sido extendida por L. Llandro y col. [L. Llandro y col., Appl. Phys. Lett. 91, 203904 (2007) ] a sensores de anillo multicapa (válvula de pseudo-espín) basados en el efecto de magnetorresistencia gigante (GMR) . En el primer caso, el sensor de anillo fue fabricado en NiFe y se diseñó para detectar la componente radial del campo creado por una microesfera individual (diámetro 4, 3 micras) , magnetizada por un campo magnético alterno. En el segundo caso, se presenta la detección de una microesfera superparamagnética con un diámetro de 4 micras, usando un sensor de anillo de válvula de pseudoespín. En ausencia de la partícula, la magnetización de la capa libre del sensor se modificada por un campo magnético externo periódico, de tal modo que cada vez que se establece una configuración de alineamiento antiparalelo de las capas magnéticas se genera un pico de GMR. Una vez que se ha colocado una partícula magnética sobre el sensor, la partícula apantalla al campo magnético externo y provoca un cambio en los campos externos necesarios para revertir la capa libre. Con el fin de comparar varios sensores de reconocimiento biomolecular, se han de tener en cuenta los siguientes parámetros:
1) Sensibilidad biológica – corresponde a la capacidad para detectar concentraciones bajas del analito diana en muestras biológicas, y normalmente viene dada en términos de límite de detección (LOD) ; un LOD bajo corresponde a una alta sensibilidad biológica;
2) Rango dinámico – dicho parámetro indica el rango de concentración del analito, que puede detectarse con el sensor, operando en un régimen lineal en un ensayo biológico dado.
En algunos casos, la sensibilidad biológica no es un problema, ya que se pueden aplicar procesos de amplificación que permiten un aumento en la concentración de analito, tal como la reacción en cadena de polimerasa (PCR) , para el ADN en genómica. En otras aplicaciones (tal como proteómica) , sin embargo, no existen métodos adecuados para la amplificación, y por tanto se requiere una elevada sensibilidad biológica.
El rango dinámico es una característica que a menudo entra en conflicto con la sensibilidad biológica. Los sensores, diseñados para detectar partículas individuales, no son capaces de contabilizar números elevados de moléculas, por lo que su aplicación en mediciones de concentración de analitos se vuelve problemática.
Además, el artículo de P. Vavassori y col., Appl. Phys. Lett. 91, 093114 (2007) , sobre anillos cuadrados de Permalloy aplicados al campo de almacenamiento magnético, es útil para comprender en su plenitud el contenido de la presente invención.
SUMARIO DE LA INVENCIÓN
En vista de los problemas mencionados anteriormente, el objeto de la invención es un sensor para detectar la presencia de una nanopartícula magnética como se define en la reivindicación 1 anexa. En las reivindicaciones dependientes se presentan realizaciones particulares del sensor.
Otro objetivo adicional de la invención es un conjunto de sensores para detectar moléculas diana como se define en la reivindicación 7 anexa. En las reivindicaciones 8-11 dependientes se definen realizaciones particulares del conjunto de sensores.
Otro objetivo de la invención es un método para detectar moléculas diana como se define en la reivindicación 12 anexa.
De acuerdo con los ejemplos particulares,... [Seguir leyendo]
Reivindicaciones:
1. Un sensor de detección de presencia de nanopartícula magnética, comprendiendo dicho sensor:
un soporte (1) sobre el cual se dispone el sensor;
una pluralidad de contactos no magnéticos (Iin, GND, V1, V2) dispuestos sobre el soporte y conectados eléctricamente y conductivamente al sensor;
el medio de medición de la magnetorresistencia sobre el sensor conectado a dicha pluralidad de contactos no magnéticos,
que se caracteriza en que:
- el sensor incluye una estructura ferromagnética plana (3) , que comprende un área de detección (31) , conformada como una tira doblada para formar una esquina,
- el sensor está estructurado para aplicar un campo magnético para provocar que el área de detección asuma selectivamente, como una respuesta al campo magnético aplicado:
una primera configuración de espín que comprende una pared de dominio (TW) “cabeza-a-cabeza”, y
una segunda configuración de espín, en la que dicha pared de dominio (TW) está ausente, en donde dicha transición entre la primera configuración y la segunda configuración es proporcionada por el campo magnético aplicado, que tiene una componente que es paralela a uno de los lados del ángulo del área de detección con una intensidad superior al umbral de transición predecible (H1x) ; estando dicho umbral de transición, detectable mediante magnetorresistencia, afectado por la proximidad de una nanopartícula magnética (N) al área de detección.
- dicho medio de medición está estructurado para proporcionar una medida de dicho umbral de transición a través de medidas de la magnetorresistencia del área de detección en dichas primera y segunda configuraciones de espín asumidas tras la aplicación de dicho campo magnético.
2. El sensor de acuerdo con la reivindicación 1, en el que el sensor está estructurado de tal modo que dicha transición entre la primera y la segunda configuraciones se debe a un efecto de magnetorresistencia anisotrópica.
3. El sensor de acuerdo con la reivindicación 1, en el que la nanoestructura (3) consiste en el área de detección (31) , sobre cuyos extremos opuestos se disponen discos terminales relativos (32) .
4. El sensor de acuerdo con la reivindicación 3, en el que dichos contactos comprenden un par de contactos de inyección (Iin, GND) dispuestos desde los extremos opuestos del área de detección (31) , que son adaptados para permitir la inyección de una corriente eléctrica a través del área de detección (31) , y un par de contactos de lectura (V1, V2) dispuestos desde los extremos opuestos del área de detección (31) , que están adaptados para permitir una medición de la diferencia de potencial (VA, VB) entre los extremos del área de detección (31) .
5. El sensor de acuerdo con al menos una de las reivindicaciones precedentes, en donde en dicha primera configuración de espín la pared de dominio (TW) “cabeza-a-cabeza” es así para atrapar y dirigir una nanopartícula magnética hacia el área de detección (31) .
6. El sensor de acuerdo con la menos una de las reivindicaciones precedentes, en el que el sensor se dispone de tal modo que permita realizar la detección de una molécula individual y/o pueda emplearse en sistemas para la síntesis y/o análisis a nivel de moléculas individuales.
7. Un conjunto de sensores para detectar moléculas diana, a las cuales se unen nanopartículas magnéticas (N) como marcadores, comprendiendo dicho conjunto de sensores un soporte (I) provisto de:
una pluralidad de sitios de detección (DS) , a los cuales se asocian las respectivas moléculas de unión, adaptadas para unirse selectivamente a dichas moléculas diana, y los respectivos sensores, estando adaptado cada uno de ellos a detectar la presencia de una nanopartícula magnética (N) en el respectivo sitio de detección (DS) ,
que se caracteriza en que cada sensor se lleva a la práctica de acuerdo con al menos una de las anteriores reivindicaciones.
8. El conjunto de acuerdo con la reivindicación 7, en el que dichos sensores se disponen para formar una pluralidad de cadenas de sensor lado a lado (300) , en donde cada cadena de sensores está hecha de una pluralidad de nanoestructuras (3) de una sola pieza, estando cada nanoestructura de una pieza constituida por el área de detección (31) conformada como una tira doblada para formar una esquina, en los extremos de la cual se colocan los respectivos discos terminales (32) , estando dichas nanoestructuras de una pieza conectadas de tal modo que cada nanoestructura de una pieza comparte un disco terminal (32) con la siguiente.
9. El conjunto de acuerdo con la reivindicación 8, en donde dichos contactos comprenden una pluralidad de contactos de inyección (Iin, GND; Iiiu, GND) , adaptados para permitir la inyección de una corriente eléctrica a través del área de detección (31) de cada nanoestructura de una pieza, y una pluralidad de contactos de lectura (310, 320; 410, 420) , adaptados para permitir una medición de la diferencia de potencial entre los extremos del área de detección (31) de cada nanoestructura unitaria.
10. El conjunto de acuerdo con la reivindicación 9, en el que dichos contactos de lectura (310, 320) están dispuestos de tal modo que las áreas de detección (31) de las nanoestructuras de una pieza correspondientes, en posición sobre las diferentes cadenas de sensores (300) , están conectadas en paralelo, estando conectadas dichas cadenas de sensores en paralelo a un par de dichos contactos de inyección (Iin, GND) para permitir la inyección simultánea de las respectivas corrientes eléctricas a través de las cadenas de sensores (300) .
11. El conjunto de acuerdo con la reivindicación 9, en el que dichos contactos de lectura (410, 420) son dos y están conectados simultáneamente a las diferentes cadenas de sensores (300) , y están dispuestas de tal modo que las áreas de detección (31) de cada cadena de sensores están conectadas en serie, estando conectada cada cadena de sensores a un respectivo contacto (Iiin) de dichos contactos de inyección para permitir la inyección independiente de una respectiva corriente eléctrica a través de cada cadena de sensores.
12. Un método para detectar moléculas diana, a las cuales se ligan nanopartículas magnéticas (N) como marcadores, comprendiendo el método las siguientes etapas:
proporcionar un conjunto de sensores de acuerdo con una de las reivindicaciones 7 a 11,
aplicar un primer campo magnético, con el objetivo de obtener dicha primera configuración de espín en cada nanoestructura (3) , y posteriormente retirar dicho primer campo magnético;
disponer una muestra biológica que contenga dichas moléculas diana sobre los sitios de detección (DS) ;
aplicar un segundo campo magnético con el objetivo de cambiar dicha primera configuración de espín a dicha segunda configuración de espín en cada nanoestructura (3) , y posteriormente retirar dicho segundo campo magnético;
retirar las moléculas diana no ligadas químicamente a las moléculas de unión, de los sitios de detección (DS) ;
aplicar un tercer campo magnético con el objetivo de obtener, de nuevo, dicha primera configuración de espín en cada nanoestructura (3) , y posteriormente retirar dicho tercer campo magnético; y
llevar a cabo mediciones del campo de transición crítico entre dicha primera configuración de espín y dicha segunda configuración de espín a través de determinaciones de magnetorresistencia sobre los sensores, mediante dicha pluralidad de contactos.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]