Procedimientos para cuantificar la filtración de proteína desde resinas de cromatografía de afinidad basada en proteína.
Un procedimiento para cuantificar la filtración de proteína desde una resina de cromatografía de afinidad basadaen proteína,
seleccionándose dicha proteína entre Proteína A (PrA), Proteína G (PrG) y Proteína L (PrL),comprendiendo el procedimiento las etapas de:
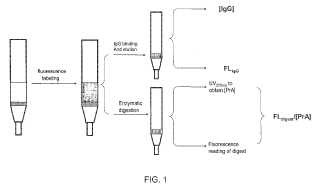
(a) marcar la resina de cromatografía basada en proteína con una o más marcas fluorescentes;
(b) dividir la resina marcada en una primera y segunda partes iguales;
(c) tratar la primera parte con un medio adecuado para liberar la proteína marcada de la resina y añadir unacantidad en exceso de inmunoglobulina (Ig) a la segunda parte;
(d) medir la fluorescencia (FLdigest) y la concentración de proteína ([proteína]) de la resina tratada en la primeraparte de la etapa (c); y
(e) medir la concentración de eluato de Ig de la resina ([Ig]) y la señal de fluorescencia en un eluato de Ig (FLIg)de la segunda parte de la etapa (c),
en el que la filtración de proteína se cuantifica calculando {(FLIg)/((FLdigest)/[proteína]))}/[Ig].
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/005142.
Solicitante: EMD Millipore Corporation.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 290 CONCORD ROAD BILLERICA, MA 01821 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BIAN, NANYING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2391931_T3.pdf
Fragmento de la descripción:
Procedimientos para cuantificar la filtración de proteína desde resinas de cromatografía de afinidad basada en proteína
Campo de la invención
La presente invención se refiere a procedimientos para cuantificar la filtración de proteína desde resinas de cromatografía de afinidad basada en proteína seleccionadas entre resinas de cromatografía de afinidad basada en proteína A, proteína G y proteína L.
Antecedentes
La cromatografía de afinidad basada en proteína se ha usado ampliamente en la purificación de proteínas, ADN, y otras moléculas químicas y biológicas a diversas escalas, variando de escala de laboratorio, piloto a producción. Véase, por ejemplo, Hermanson y col., Immobilized Affinity Ligand Techniques, Academic Press, Inc. San Diego, CA, págs. 317-34b (1992) . Entre ellas, las resinas de cromatografía de afinidad basada en proteína A (PrA) , proteína G (PrG) y proteína L (PrL) son bien conocidas y ampliamente usadas en procedimientos para la detección y/o purificación de inmunoglobulinas (Ig) , sin embargo, cada una tiene diferentes especificidades con respecto a la unión de Ig.
Como un ejemplo, reactivos basados en PrA han encontrado especialmente un uso extendido en el campo de la biotecnología, por ejemplo, la cromatografía de afinidad para la captura y purificación de anticuerpos así como en procedimientos de detección de anticuerpos. Actualmente, los medios o resinas de afinidad basados en PrA probablemente son los medios de afinidad más ampliamente usados para el aislamiento de anticuerpos monoclonales y sus fragmentos a partir de diferentes muestras incluyendo cultivo celular. Por consiguiente, diversas matrices que comprenden ligandos de proteína A están disponibles en el mercado incluyendo, por ejemplo, ProSep®-vA High Capacity, ProSep® vA Ultra y ProSep® UltraPlus (Millipore) y Protein A Sepharose™, rmp Protein A Sepharose Fast Flow, MabSelect™, MabSelect Xtra™ y MabSelect SuRe® (GE Healthcare) , Poros MabCapture A (Applied Biosystems) y Sartobind Protein A (Sartorius) .
Sumario de la invención
Aunque son altamente deseables resinas de cromatografía de afinidad basada en proteína, por ejemplo, resinas de cromatografía de afinidad basada en proteína A, G y L, para la purificación de analitos o moléculas que se unen a las mismas, por ejemplo, inmunoglobulinas (Ig) en el caso de PrA, PrG y PrL, un inconveniente es la filtración de la proteína, por ejemplo, proteína A, G o L, de la columna de cromatografía junto con el analito o molécula de interés, por ejemplo, una inmunoglobulina. Por ejemplo, la cromatografía de afinidad basada en proteína A es altamente deseable para la purificación a gran escala de anticuerpos, por ejemplo, a causa de su capacidad de unirse específicamente a anticuerpos con elevada capacidad y para conseguir elevada pureza, sin embargo, la PrA lixiviada, a causa de su propia actividad biológica y perfil toxicológico, habitualmente se considera una impureza indeseable en un eluato de inmunoglobulina. Por consiguiente, en algunos aspectos de la presente invención, es deseable controlar la filtración de PrA y eliminarla finalmente en etapas de cromatografía posteriores. Por ejemplo, un modo de minimizar la filtración de PrA es usar resinas de PrA que muestren la cantidad más baja de filtración de PrA desde una columna de cromatografía. Por consiguiente, en algunos aspectos, los procedimientos de la presente invención pueden usarse para identificar resinas de cromatografía de afinidad basada en proteína incluyendo, aunque sin limitación, resinas de cromatografía de afinidad basada en PrA, PrG y PrL, que muestren la cantidad más baja de filtración desde la columna de cromatografía. Dichas resinas de cromatografía de afinidad basada en proteína incluyen resinas conocidas así como aquellas que pueden desarrollarse en el futuro.
Se han desarrollado varios ensayos de exploración basados en Ensayo Inmunoabsorbente Ligado a Enzimas (ELISA del inglés Enzime-Linked Immunosorbant Assay) para detectar la filtración de PrA desde columnas de cromatografía. Sin embargo, la mayoría de estos ensayos son de naturaleza cualitativa y generalmente muestran una mayor variabilidad (por ejemplo, ≥25%) para ser adecuados como herramienta analítica, por ejemplo, para proporcionar una comparación de las resinas de cromatografía de afinidad basada en PrA, identificar resinas que muestren la cantidad más baja de filtración de PrA y para controlar la PrA lixiviada en combinaciones de elución de anticuerpos después de la cromatografía de afinidad y las posteriores etapas de cromatografía.
Se han usado ampliamente marcas fluorescentes en investigación bioquímica y química a causa de su elevada sensibilidad y selectividad asociada con dichas marcas. Por ejemplo, la proteína A lixiviada de resinas de afinidad se ha detectado previamente usando colorantes fluorescentes, sin embargo, dichos colorantes se han usado principalmente para generar información cualitativa, por ejemplo, detección, y no para proporcionar ninguna información cuantitativa, por ejemplo, la cantidad de PrA lixiviada. Véase, por ejemplo, Carter-Franklin, y col., Journal of Chromatography A, 1163: 105-111 (2007) .
La presente invención se refiere, al menos en parte, a procedimientos cuantitativos para detectar la filtración de proteína, por ejemplo, PrA, desde medios o resinas de cromatografía usando, por ejemplo, marcas fluorescentes. Los procedimientos de acuerdo con la invención muestran una variabilidad de menos del 10% y son especialmente
adecuados para identificar resinas de cromatografía PrA que muestren la cantidad más baja de filtración de PrA.
En un aspecto de acuerdo con la presente invención, se proporciona un procedimiento para cuantificar la filtración de PrA desde una resina de cromatografía de afinidad basada en PrA, donde el procedimiento comprende las etapas de: (a) marcar la resina de cromatografía basada en PrA, con una o más marcas fluorescentes; (b) dividir la resina marcada en una primera y segunda partes iguales; (c) tratar la primera parte con un medio adecuado para liberar la PrA marcada de la resina y añadir una cantidad en exceso de Ig a la segunda parte; (d) medir la fluorescencia (FLdigest) y la concentración de PrA ([PrA]) de la resina tratada en la primera parte de la etapa (c) ; y (e) medir la concentración de elución de Ig de la resina ([Ig]) y la señal de fluorescencia en un eluato de Ig (FLIg) de la segunda parte de la etapa (c) , donde la filtración de PrA se cuantifica calculando { (FLIg) / ( (FLdigest) /[PrA]) }/[Ig].
En otro aspecto de acuerdo con la presente invención, se proporciona un procedimiento para cuantificar la filtración de PrA desde una resina de cromatografía de afinidad basada en PrA, donde el procedimiento comprende las etapas de: (a) marcar la resina de cromatografía basada en PrA con una o más marcas fluorescentes; (b) añadir una cantidad en exceso de Ig a la resina marcada y medir la concentración de elución de Ig de la resina ([Ig]) y la señal de fluorescencia en el eluato de Ig (FLIg) de la resina; (c) retirar la Ig residual de la resina seguido del tratamiento de la resina con un medio adecuado para liberar la PrA marcada de la resina; y (d) medir la fluorescencia (FLdigest) y la concentración de PrA ([PrA]) de la resina tratada, donde la filtración de PrA se cuantifica calculando { (FLIg) / ( (FLdigest) /[PrA]) }/[Ig].
En algunas realizaciones, los procedimientos de la invención se usan para cuantificar la filtración de proteína G (PrG) desde una resina de cromatografía de afinidad basada en PrG.
Por consiguiente, en otro aspecto más de acuerdo con la invención, se proporciona un procedimiento para cuantificar la filtración de PrG desde una resina de cromatografía de afinidad basada en PrG, que comprende las etapas de: (a) marcar la resina de cromatografía basada en PrG con una o más marcas fluorescentes; (b) dividir la resina marcada en una primera y segunda partes iguales; (c) tratar la primera parte con un medio adecuado para liberar la PrG marcada de la resina y añadir una cantidad en exceso de Ig a la segunda parte; (d) medir la fluorescencia (FLdigest) y la concentración de PrG ([PrG]) de la resina tratada en la primera parte de la etapa (c) ; y (e) medir la concentración de elución de Ig de la resina ([Ig]) y la señal de fluorescencia en un eluato de Ig (FLIg) de la segunda parte de la etapa (c) , donde la filtración de PrG se cuantifica calculando { (FLIg) / ( (FLdigest)... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para cuantificar la filtración de proteína desde una resina de cromatografía de afinidad basada en proteína, seleccionándose dicha proteína entre Proteína A (PrA) , Proteína G (PrG) y Proteína L (PrL) , comprendiendo el procedimiento las etapas de:
(a) marcar la resina de cromatografía basada en proteína con una o más marcas fluorescentes;
(b) dividir la resina marcada en una primera y segunda partes iguales;
(c) tratar la primera parte con un medio adecuado para liberar la proteína marcada de la resina y añadir una cantidad en exceso de inmunoglobulina (Ig) a la segunda parte;
(d) medir la fluorescencia (FLdigest) y la concentración de proteína ([proteína]) de la resina tratada en la primera parte de la etapa (c) ; y
(e) medir la concentración de eluato de Ig de la resina ([Ig]) y la señal de fluorescencia en un eluato de Ig (FLIg) de la segunda parte de la etapa (c) , en el que la filtración de proteína se cuantifica calculando { (FLIg) / ( (FLdigest) /[proteína]) ) }/[Ig].
2. Un procedimiento para cuantificar la filtración de proteína desde una resina de cromatografía de afinidad basada en proteína, seleccionándose dicha proteína entre Proteína A (PrA) , Proteína G (PrG) y Proteína L (PrL) , comprendiendo el procedimiento las etapas de:
(a) marcar la resina de cromatografía basada en proteína con una o más marcas fluorescentes;
(b) añadir una cantidad en exceso de inmunoglobulina (Ig) a la resina marcada y medir la concentración de eluato de Ig de la resina ([Ig]) y la señal de fluorescencia en un eluato de Ig (FLIg) de la resina;
(c) retirar la Ig residual de la resina seguido de tratamiento de la resina con un medio adecuado para liberar la proteína marcada de la resina; y
(d) medir la fluorescencia (FLdigest) y la concentración de proteína ([proteína]) de la resina tratada; en el que la filtración de proteína se cuantifica calculando { (FLIg) / ( (FLdigest) /[proteína]) }/[Ig].
3. El procedimiento de la reivindicación 1 ó 2, en el que la inmunoglobulina es una IgG.
4. El procedimiento de la reivindicación 1 ó 2, que comprende adicionalmente la etapa de retirar la proteína lixiviada usando una o más de cromatografía de intercambio catiónico, cromatografía de intercambio aniónico y cromatografía de intercambio hidrófobo, cromatografía de reparto débil, cromatografía con hidroxiapatita, o cualquier combinación de las mismas.
5. El procedimiento de la reivindicación 1 ó 2, en el que la marca fluorescente se selecciona entre el grupo compuesto por Alexa Fluor 488, Dylight 488, HiLyte Fluor 488, 5-FAM, SE y 6-FAM, SE.
6. El procedimiento de la reivindicación 1 ó 2, en el que el medio adecuado comprende tratamiento químico.
7. El procedimiento de la reivindicación 6, en el que el tratamiento químico comprende el uso de un ácido o base.
8. El procedimiento de la reivindicación 1 ó 2, en el que el medio adecuado comprende tratamiento enzimático.
9. El procedimiento de la reivindicación 8, en el que el tratamiento enzimático comprende el uso de tripsina, pepsina, quimotripsina, termolisina y subtelisina.
10. El procedimiento de la reivindicación 1 ó 2, en el que la resina de cromatografía basada en proteína se selecciona entre el grupo compuesto por ProSep A high capacity, ProSep A Ultra, ProSep Ultra Plus, Mabselect, Mabselect Xtra, Mabselect Sure, Sepharose Protein A, Sartobind Protein A y Protein Sepharose Fast Flow.
11. El procedimiento de la reivindicación 1 ó 2, en el que la fluorescencia se mide usando un fluorómetro.
12. El procedimiento de la reivindicación 1 ó 2, en el que la Ig se eluye usando un pH adecuado.
13. El procedimiento de la reivindicación 1 ó 2, en el que la Ig es monoclonal.
14. El procedimiento de la reivindicación 1 ó 2, en el que la Ig es policlonal.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]